
|
Notes de cours, aide-mémoire
Chimie inorganique. Aide-mémoire : brièvement, le plus important
Annuaire / Notes de cours, aide-mémoire table des matières
1. La relation entre les processus du métabolisme et l'énergie dans le corps. Système thermodynamique Les processus de la vie sur Terre sont en grande partie dus à l'accumulation d'énergie solaire dans les substances biogènes (protéines, lipides, glucides) et aux transformations ultérieures de ces substances dans les organismes vivants avec libération d'énergie. Les travaux de A. M. Lavoisier (1743-1794) et de P. S. Laplace (1749-1827) ont montré par des mesures calorimétriques directes que l'énergie dégagée au cours de la vie est déterminée par l'oxydation des produits alimentaires par l'oxygène de l'air inhalé par les animaux. Avec le développement aux XIX-XX siècles. thermodynamique, il est devenu possible de calculer quantitativement la conversion de l'énergie dans les réactions biochimiques et de prédire leur direction. La méthode thermodynamique repose sur un certain nombre de concepts stricts : « système », « état du système », « énergie interne du système », « fonction de l'état du système ». système thermodynamique tout objet de la nature est appelé, composé d'un nombre suffisamment grand de molécules (unités structurelles) et séparé des autres objets de la nature par une surface limite réelle ou imaginaire (interface). Les objets de la nature qui ne sont pas inclus dans le système sont appelés l'environnement. Les caractéristiques les plus courantes des systèmes sont m - la masse de la substance contenue dans le système et E - l'énergie interne du système. La masse de la substance du système est déterminée par la masse totale des molécules qui le composent. L'énergie interne du système est la somme des énergies du mouvement thermique des molécules et de l'énergie d'interaction entre elles. Les systèmes selon la nature de l'échange de matière et d'énergie avec l'environnement sont divisés en trois types: isolés, fermés et ouverts. système isolé on appelle système qui n'échange ni matière ni énergie avec le milieu (Δm = 0, ΔE = 0). Un système fermé est un tel système qui n'échange pas de matière avec l'environnement, mais peut échanger de l'énergie (Δm = 0, ΔE^ 0). L'échange d'énergie peut être réalisé en transférant de la chaleur ou en effectuant un travail. système ouvert on dit qu'un tel système peut échanger à la fois de la matière et de l'énergie avec le milieu (Δm ≠ 0, ΔE ≠ 0). Un exemple important de système ouvert est la cellule vivante. Les systèmes, en fonction de l'état d'agrégation de la substance dont ils sont composés, sont divisés en homogènes et hétérogènes. Dans un système homogène, il n'y a pas de changements brusques dans les propriétés physiques et chimiques lors du passage d'une zone du système à une autre. Un exemple d'un tel système est le plasma sanguin, qui est une solution de diverses substances biogènes. Un système hétérogène se compose de deux ou plusieurs parties homogènes. Un exemple de système hétérogène est le sang total, c'est-à-dire le plasma avec des cellules - érythrocytes et leucocytes. 2. La première loi de la thermodynamique. Concepts caractérisant le système La première loi de la thermodynamique fournit un cadre quantitatif rigoureux pour analyser l'énergie de divers systèmes. Pour le formuler, il est nécessaire d'introduire un certain nombre de nouveaux concepts qui caractérisent le système. L'état du système est l'un des concepts les plus importants. Un état est compris comme un ensemble de propriétés du système qui permettent de définir un système du point de vue de la thermodynamique. Comme caractéristique généralisée de l'état du système, les concepts suivants sont utilisés : "équilibre", "stationnaire", "état transitoire". L'état du système est appelé équilibre si toutes les propriétés restent constantes pendant une longue période de temps et qu'il n'y a pas de flux de matière et d'énergie dans le système. Si les propriétés du système sont constantes dans le temps, mais qu'il existe des flux de matière et d'énergie, l'état est dit stationnaire. Quantitativement, les états sont distingués à l'aide de variables thermodynamiques. Les variables thermodynamiques sont les quantités qui caractérisent l'état du système dans son ensemble. Ils sont également appelés paramètres thermodynamiques du système. Les variables thermodynamiques les plus importantes sont la pression p, la température T, le volume du système V ou la masse totale du système m, les masses de produits chimiques (composants) mk qui composent le système ou la concentration de ces substances m. Il est à noter que des caractéristiques similaires (température, poids, composition des fluides biologiques, tension artérielle) sont utilisées par le médecin pour déterminer l'état du patient. Le passage d'un système d'un état à un autre est appelé par processus. À la suite du processus, l'état du système et les variables thermodynamiques changent. Si nous désignons la valeur de la variable thermodynamique à l'état initial par X1 , et enfin - X2 , alors la variation de cette variable est respectivement égale à ΔX = X2 - X1 et s'appelle l'incrément de la variable thermodynamique X. L'incrément, pris avec le signe opposé, s'appelle la diminution de la variable X. L'énergie interne du système E est l'une des fonctions thermodynamiques de l'état. Une caractéristique importante des fonctions de l'État est leur indépendance par rapport à la méthode permettant d'atteindre un état donné du système. La variation de l'énergie interne du système ΔE est due au travail W, qui est effectué lors de l'interaction du système avec l'environnement, et de l'échange de chaleur Q entre l'environnement et le système, le rapport entre ces quantités est le contenu de la première loi de la thermodynamique. L'augmentation de l'énergie interne du système ΔE dans un processus est égale à la chaleur Q reçue par le système, plus le travail W effectué sur le système dans ce processus: ∆E=Q+W. Dans les systèmes biologiques, la chaleur est généralement dégagée par le système vers l'environnement extérieur et le travail est effectué par le système en raison de la perte d'énergie interne. Il convient de représenter l'enregistrement mathématique de la première loi de la thermodynamique sous la forme : ∆E = Q - W. Toutes les quantités dans les formules ci-dessus sont mesurées en joules (J). 3. Première loi de la thermodynamique La première loi de la thermodynamique est l'une des lois fondamentales de la nature qui ne peut être dérivée d'aucune autre loi. Sa validité est prouvée par de nombreuses expériences, en particulier des tentatives infructueuses de construction d'une machine à mouvement perpétuel du premier type, c'est-à-dire une telle machine qui pourrait fonctionner pendant une durée arbitrairement longue sans fournir d'énergie de l'extérieur. Selon les conditions du processus dans le système, diverses fonctions d'état sont utilisées, qui sont dérivées de la première loi de la thermodynamique. Dans le même temps, au lieu de systèmes biologiques complexes, des modèles simplifiés sont utilisés pour obtenir des conclusions sur les transformations de masse et d'énergie. La pression dans le système est maintenue constante, elle est égale à la pression externe. De tels processus se produisant à p = const sont appelés isobares. Le travail d'expansion effectué dans un processus isobare est connu pour être : W = ρΔV, où ΔV est l'incrément de volume du système, égal à la différence entre les volumes dans les états 2 et 1. En substituant le travail du développement dans l'expression mathématique de la première loi et en effectuant des transformations simples, on obtient : Qρ = ΔE + pΔV = (E2 + ρV2) - (E1 +ρΔV1) où Qρ est la chaleur du processus isobare ; 1, 2 - index liés au début et à la fin du processus. La valeur (E + pV) est fonction de l'état du système, notée H et appelée enthalpie : H = E + ρV. Ainsi, l'expression peut s'écrire : Qp =H2 -H1 = ∆H. De cette expression il résulte que enthalpie - fonction d'état dont l'incrément est égal à la chaleur reçue par le système dans le processus isobare. La mesure de l'incrément d'enthalpie dans un certain procédé peut être réalisée en réalisant ce procédé dans un calorimètre à pression constante. C'est ainsi que A.M. Lavoisier et P.S. Laplace ont mené leurs expériences, étudiant l'énergétique du métabolisme dans un organisme vivant. Dans les cas où le changement d'état du système se produit à volume constant, le processus est appelé isochore. Dans ce cas, le changement de volume AV est égal à zéro, et conformément à la formule, le travail d'expansion W = 0. Ensuite, à partir de l'expression mathématique de la première loi de la thermodynamique, il s'ensuit : Qv = ∆E. La définition thermodynamique découle de la relation ci-dessus : énergie interne - fonction d'état dont l'incrément est égal à la chaleur QV obtenue par le système dans le processus isochore. Par conséquent, le changement d'énergie interne dans un certain processus peut être mesuré en effectuant ce processus dans un calorimètre à volume constant. Il s'ensuit qu'à ρ = const les incréments d'énergie interne et d'enthalpie sont liés par la relation : ∆H = ∆E + ρ∆V. 4. Loi de Hess La section de la thermodynamique qui étudie la transformation de l'énergie dans les réactions chimiques s'appelle la thermodynamique chimique. L'équation de réaction pour laquelle les changements d'énergie interne ΔE, d'enthalpie ΔH ou d'une autre fonction d'état correspondant à cette réaction sont indiqués est appelée thermochimique. Les réactions chimiques au cours desquelles l'enthalpie du système diminue (ΔH < 0) et la chaleur est libérée dans le milieu extérieur sont appelées exothermique. Réactions dans lesquelles l'enthalpie augmente (ΔH > 0) et le système absorbe de la chaleur Qp à l'extérieur s'appellent endothermique. L'oxydation du glucose avec l'oxygène se produit avec la libération d'une grande quantité de chaleur (Qp \u2800d XNUMX kJ//mol), c'est-à-dire ce processus est exothermique. L’équation thermochimique correspondante peut s’écrire С6 Н12 О6 + 602 = 6С02 + 6Н2Oh, ΔH = 2800 kJ. Les réactions se produisant en solution s'accompagnent généralement d'une légère modification du volume du système, c'est-à-dire ΔV ≈ 0. À cet égard, dans de nombreux cas, dans les calculs biologiques, on peut supposer que ΔH = ΔE. Par conséquent, le dégagement de chaleur dans de tels systèmes est principalement dû à une diminution de l'énergie interne à la suite de la réaction, et vice versa. L'enthalpie de formation du composé A est la variation de l'enthalpie du système ΔHA accompagnant la formation de 1 mole de composé A à partir de substances simples. Les enthalpies de formation de l'oxygène, du carbone, de l'hydrogène et de toutes les autres substances élémentaires (simples) sont supposées être nulles. Toutes choses étant égales par ailleurs, l'énergie interne et l'enthalpie sont proportionnelles à la quantité de matière dans le système. De telles fonctions thermodynamiques sont dites extensives. Du point de vue de la thermodynamique, la réaction de la forme générale nAA + pВ =nС + nD , Δh est la transition du système depuis l'état initial avec l'enthalpie H1 à l'état 2 avec enthalpie H2. La variation de l'enthalpie du système à la suite de cette transition, appelée l'enthalpie de cette réaction, est égale à la différence : AHPya =H2 -H1 = (noncHc + nDHD) - (nАНА + nBHB). La loi de constance des sommes de chaleur a été découverte par le chimiste russe G. I. Hess en 1840. Il est le découvreur de l'applicabilité de la première loi de la thermodynamique aux transformations chimiques et le fondateur de la thermodynamique chimique. Actuellement, la loi de Hess est considérée comme une conséquence de la première loi de la thermodynamique et est formulée comme suit : l'incrément d'enthalpie dans la formation de produits donnés à partir de réactifs donnés à pression constante ne dépend pas du nombre et du type de réactions résultant de la formation de ces produits. Dans les calculs thermochimiques, ce n'est pas la loi de Hess elle-même qui est plus souvent utilisée, mais sa conséquence, dérivée ci-dessus pour le cas particulier de l'oxydation du glucose sous forme d'égalité (2). Pour une réaction présentée sous forme générale pАA + pвB = = nсC + nDD, une conséquence de la loi de Hess s'écrit avec l'égalité ΔHPya = (nonCAHC + nDAHD) - (nAAHA ++nBAHB ) et se formule comme suit : l'enthalpie de réaction est égale à la somme algébrique des enthalpies de formation d'une quantité stoechiométrique de produits moins la somme algébrique des enthalpies de formation d'une quantité stoechiométrique de réactifs. 5. La deuxième loi de la thermodynamique. Énergie libre de Gibbs Le corps effectue un travail en dépensant l'énergie interne stockée sous la forme de l'énergie d'interaction chimique des atomes de ses substances constitutives. L'expression mathématique ΔE = Q - W de la première loi de la thermodynamique détermine la relation exacte entre la consommation d'énergie interne du système ΔE, le travail W effectué par le système et l'énergie Q perdue sous forme de chaleur. Cependant, à partir de la première loi de la thermodynamique, il est impossible de déterminer la part de l'énergie interne consommée qui peut être convertie en travail. Les estimations théoriques des coûts sont basées sur la deuxième loi de la thermodynamique. Cette loi impose des restrictions strictes sur l'efficacité de la conversion de l'énergie en travail et, en outre, vous permet d'introduire des critères pour la possibilité d'un flux spontané d'un processus. Le processus s'appelle spontanés'il est réalisé sans aucune influence, lorsque le système est laissé à lui-même. Il existe des processus dans lesquels l'énergie interne du système ne change pas (ΔE = 0). De tels processus comprennent, par exemple, l'ionisation de l'acide acétique dans l'eau. Un certain nombre de processus spontanés procèdent à une augmentation de l'énergie interne (ΔE > 0). Cela comprend, en particulier, les réactions typiques de formation de composés bioinorganiques d'albumine (protéine du plasma sanguin) avec des ions métalliques, tels que Cu2+. La variation de l'énergie interne AE pour les systèmes fermés ne peut pas servir de critère pour les processus spontanés. Par conséquent, la première loi de la thermodynamique, dont ce critère est issu, ne suffit pas à résoudre la question de la spontanéité, ainsi que l'efficacité des processus. La solution de ces questions est obtenue à l'aide de la deuxième loi de la thermodynamique. Pour formuler la deuxième loi de la thermodynamique, il est nécessaire d'introduire les notions de processus réversibles et irréversibles au sens thermodynamique. Si le système est en équilibre, cet état se maintient indéfiniment dans les mêmes conditions extérieures. Lorsque les conditions externes changent, l'état du système peut changer, c'est-à-dire qu'un processus peut avoir lieu dans le système. Un processus est dit thermodynamiquement réversible si, lors du passage de l'état initial 1 à l'état final 2, tous les états intermédiaires sont en équilibre. Un processus est dit thermodynamiquement irréversible si au moins un des états intermédiaires est hors d'équilibre. Un processus réversible ne peut être effectué qu'avec un changement suffisamment lent des paramètres du système - température, pression, concentration de substances, etc. Le taux de changement des paramètres doit être tel que les écarts par rapport à l'équilibre qui se produisent au cours du processus sont négligeables. Il convient de noter qu'un problème important en médecine est associé à la réversibilité - la préservation des tissus à basse température. Les procédés réversibles sont le cas limite des procédés réels se produisant dans la nature et réalisés en industrie ou en laboratoire. 6. La deuxième loi de la thermodynamique. Entropie Travail maximal Wмакс, qui peut être obtenu avec une perte d'énergie interne ΔE donnée dans le processus de transition de l'état 1 à l'état 2, n'est atteint que si ce processus est réversible. Conformément à l'expression de la première loi de la thermodynamique, la chaleur minimale Qmin Qmin \uXNUMXd ΔE - Wмакс . Le facteur d'efficacité maximal réalisable, qui caractérise la rentabilité de l'énergie interne du système, est respectivement égal à ηмакс=Wмакс / ΔE. Dans un processus irréversible de transition de l'état 1 à l'état 2, le travail effectué par le système est inférieur à W. Pour calculer le facteur maximal hмакс avec une valeur connue de ΔE, il faut connaître la valeur de Wмакс ou Qmin Wмакс = ΔE - Qmin , donc ηмакс \u1d XNUMX - ΔE / Qmin . valeur Qmin peut être calculée à partir de la deuxième loi de la thermodynamique en utilisant une fonction d'état thermodynamique appelée entropie. Le concept d'entropie a été introduit (1865) par le physicien allemand R. Yu. Clausius (1822-1888), l'un des fondateurs de la thermodynamique et de la théorie cinétique moléculaire des processus thermiques. Définition thermodynamique de l'entropie selon Clausius : l'entropie est une fonction d'état dont l'incrément ΔS est égal à la chaleur Qmin amené au système dans un processus isotherme réversible, divisé par la température absolue T à laquelle le processus est effectué : ∆S = Qmin /T. Il découle de la formule que l'unité d'entropie est J/K. Un exemple de processus isotherme réversible est la lente fonte de la glace dans un thermos rempli d'eau à 273°K. Il a été établi expérimentalement que pour faire fondre 1 mole de glace (18 g), il faut fournir au moins 6000 J de chaleur. Dans ce cas, l'entropie du système « glace - eau » dans le thermos augmente de ΔS = 6000 J : 273°K = 22 J/K. Lorsqu'un thermos contenant de l'eau est refroidi à 273 °K, 6000 1 J de chaleur peuvent être lentement évacués et XNUMX mol de glace se forme lors de la cristallisation de l'eau. Pour ce processus, Qmin a une valeur négative dans la formule. En conséquence, l’entropie du système glace-eau lorsqu’une mole de glace est formée diminue de ΔS = 1 J/K. De même, il est possible de calculer la variation d'entropie pour tout processus physique et chimique isotherme, si la chaleur fournie au système ou retirée de celui-ci au cours de ces processus est connue. Comme le sait la physique, cette chaleur peut être déterminée à l'aide de mesures calorimétriques. Ainsi, le changement d'entropie, ainsi que de deux autres fonctions de l'état du système - l'énergie interne et l'enthalpie, est une quantité déterminée expérimentalement. La signification physique de l'entropie, ainsi que de l'énergie interne, est clairement révélée lorsque l'on considère les processus se produisant dans des systèmes isolés du point de vue de la cinétique moléculaire. 7. Formule de Boltzmann Les systèmes isolés, par définition, n'échangent ni matière ni énergie avec l'environnement. Bien sûr, de tels systèmes n'existent pas vraiment dans la nature. Cependant, une très bonne isolation peut être obtenue en plaçant le système dans un thermos scellé avec un bouchon de liège. Il s'avère que tout processus spontané ne peut avoir lieu dans un système isolé que s'il est caractérisé par une augmentation de l'entropie ; à l'équilibre, l'entropie du système est constante : ∆S ≥ 0. Cette affirmation, basée sur des observations expérimentales, est l'une des formulations possibles de la seconde loi de la thermodynamique. Un processus inverse à spontané, selon la deuxième loi de la thermodynamique, ne peut pas se dérouler dans un système isolé, car un tel processus se caractérise par une diminution de l'entropie. L'examen de divers systèmes isolés montre que les processus spontanés sont toujours associés à une augmentation du nombre de micro-états w du système. Dans les mêmes processus, l'entropie S du système augmente, c'est-à-dire que l'entropie augmente avec une augmentation du nombre de micro-états. Pour la première fois, l'existence d'une telle dépendance a été remarquée par le physicien autrichien L. Boltzmann, qui en 1872 a proposé la relation : КБ =R/NA = 1,38 - 1023 J/K, où KБ - Constante de Boltzmann, égale au rapport de la constante des gaz R à la constante d'Avogadro NA . Cette relation s'appelle la formule de Boltzmann. La formule de Boltzmann permet de calculer théoriquement l'entropie d'un système à partir du nombre de ses micro-états possibles. Ces calculs sont en bon accord avec les valeurs déterminées expérimentalement. En particulier, on sait que le nombre de micro-états des substances cristallines à 0°K est proche de w0 "1. Ainsi, les valeurs absolues de l'entropie des substances cristallisantes peuvent être déterminées, contrairement à l'énergie interne E et à l'enthalpie H, pour lesquelles seules des valeurs relatives peuvent être déterminées. Une augmentation du nombre de micro-états d'un système dans de nombreux cas peut être associée à une augmentation du désordre dans ce système, avec une transition vers des distributions plus probables de l'énergie du système. Sur la base de la relation de Boltzmann, on peut donner une définition cinétique moléculaire de l'entropie. L'entropie est une mesure de la probabilité qu'un système soit dans un état donné ou une mesure du désordre du système. L'importance du concept d'entropie est due au fait que sur la base de cette valeur, il est possible de prédire la direction des processus spontanés. Cependant, l'applicabilité de la mesure de l'entropie comme critère de direction des processus est limitée aux systèmes isolés conformément à la formulation de la deuxième loi de la thermodynamique. 8. L'énergie de Gibbs Comme critère de spontanéité des processus dans les systèmes ouverts et fermés, une nouvelle fonction d'état est introduite : l'énergie de Gibbs. Cette fonction doit son nom au grand physicien américain D. W. Gibbs (1839-1903), qui a dérivé cette fonction et l'a ensuite utilisée dans des travaux thermodynamiques. L'énergie de Gibbs est déterminée en fonction de l'enthalpie H et de l'entropie S à l'aide des relations : G = H - S, ∆G = ∆H - ∆S. Basée sur l'énergie de Gibbs, la deuxième loi de la thermodynamique peut être formulée comme suit : dans des conditions isothermes isobares (p, T = const), seuls de tels processus peuvent se produire spontanément dans le système, à la suite de quoi l'énergie de Gibbs du système diminue (ΔG < 0). le système ne change pas (G = const, AG = 0). ΔG < 0, p, T = const. Il résulte de ce qui précède que l'énergie de Gibbs joue un rôle important dans l'étude des processus bioénergétiques. Avec cette fonction d'état, vous pouvez prédire la direction des processus spontanés dans les systèmes biologiques et calculer l'efficacité maximale réalisable. L'énergie de Gibbs G, comme l'enthalpie H, est fonction de l'état du système. Par conséquent, la variation de l'énergie de Gibbs ΔG peut être utilisée pour caractériser les transformations chimiques de la même manière que la variation d'enthalpie ΔН. Les équations de réaction pour lesquelles la variation d'énergie de Gibbs correspondant à ces réactions est indiquée sont également appelées thermochimiques. Les réactions chimiques, au cours desquelles l'énergie de Gibbs du système diminue (ΔG < 0) et un travail est effectué, sont dites exergoniques. Les réactions, à la suite desquelles l'énergie de Gibbs augmente (ΔG > 0) et un travail est effectué sur le système, sont appelées endergoniques. Dérivée de la deuxième loi de la thermodynamique, l'énergie de Gibbs est une fonction d'état. Par conséquent, tout comme pour l'enthalpie, la loi de Hess pour l'énergie de Gibbs peut être formulée sous la forme suivante : la variation de l'énergie de Gibbs lors de la formation de produits donnés à partir de réactifs donnés à pression et température constantes ne dépend pas du nombre et du type de réactions aboutissant à la formation de ces produits. Un exemple important de l'application de la loi de Hess est le calcul de l'énergie de Gibbs de la réaction d'oxydation du glucose avec le dioxygène. La variation de l'énergie de Gibbs dans cette réaction à p = 101 kPa et T = 298°K, déterminée à l'extérieur du corps, est ΔG° = 2880 kJ/mol. L'équation thermochimique correspondante s'écrit : С6Н12О6 + 6O2 = 6 CO2 + 6Н2Ah, ΔGPya° = 2880 kJ/mol. Dans les cellules de l'organisme, cette réaction s'effectue en plusieurs étapes successives étudiées par les biochimistes. On peut prédire à partir de la loi de Hess que la somme des changements d'énergie de Gibbs dans toutes les réactions intermédiaires est ΔGPya: G1 +ΔG2 +ΔG3 + … +∆Gn = ∆GPya °. L'énergie de Gibbs d'une réaction est égale à la somme algébrique des énergies de Gibbs de formation d'une quantité stoechiométrique de produits moins la somme algébrique des énergies de Gibbs de formation d'une quantité stoechiométrique de réactifs : GPya = (noncGc + nDGD)(nAGA + nBGB). 9. Solution. Classement des solutions Selon l'état d'agrégation, les solutions peuvent être gazeuses, liquides et solides. Toute solution est constituée de solutés et d'un solvant, bien que ces concepts soient quelque peu arbitraires. Par exemple, selon le rapport de la quantité d'alcool et d'eau, ce système peut être une solution d'alcool dans l'eau ou d'eau dans l'alcool. Habituellement, le solvant est considéré comme le composant qui se trouve dans la solution dans le même état d'agrégation qu'avant la dissolution. La doctrine des solutions intéresse particulièrement les médecins car les fluides biologiques les plus importants - sang, lymphe, urine, salive, sueur - sont des solutions de sels, protéines, glucides, lipides dans l'eau. Les fluides biologiques participent au transport des nutriments (graisses, acides aminés, oxygène), des médicaments vers les organes et tissus, ainsi qu'à l'excrétion des métabolites (urée, bilirubine, dioxyde de carbone, etc.) de l'organisme. Le plasma sanguin est un milieu pour les cellules - lymphocytes, érythrocytes, plaquettes. Dans les milieux liquides du corps, la constance de l'acidité, la concentration des sels et des substances organiques est maintenue. Cette constance est appelée homéostasie de concentration. Classement des solutions Les solutions de substances ayant une masse molaire inférieure à 5000 5000 g/mol sont appelées solutions de composés de faible poids moléculaire (LMC), et les solutions de substances ayant une masse molaire supérieure à XNUMX XNUMX g/mol sont appelées solutions de composés de haut poids moléculaire ( HMC). En fonction de la présence ou de l'absence de dissociation électrolytique, les solutions NMS sont divisées en deux classes : les solutions d'électrolytes et de non-électrolytes. Solutions d'électrolytes - solutions de sels, acides, bases, ampholytes se dissociant en ions. Par exemple, les solutions KNO3, HCl, KOH, Al(OH)3 , glycine. La conductivité électrique des solutions électrolytiques est supérieure à celle du solvant. Solutions de non-électrolytes - solutions de substances qui ne se dissocient pratiquement pas dans l'eau. Par exemple, des solutions de saccharose, de glucose, d'urée. La conductivité électrique des solutions non électrolytiques diffère peu de celle d'un solvant. Les solutions de NMS (électrolytes et non-électrolytes) sont dites vraies, contrairement aux solutions colloïdales. Les vraies solutions se caractérisent par une composition homogène et l'absence d'interface entre le soluté et le solvant. La taille des particules dissoutes (ions et molécules) est inférieure à 109m La plupart des DIU sont des polymères dont les molécules (macromolécules) sont constituées d'un grand nombre de groupes répétitifs ou d'unités monomères interconnectées par des liaisons chimiques. Les solutions de DIU sont appelées solutions de polyélectrolytes. Les polyélectrolytes comprennent les polyacides (héparine, acide polyadénylique, acide polyaspartique, etc.), les polybases (polylysine), les polyampholytes (protéines, acides nucléiques). Les propriétés des solutions HMS diffèrent considérablement de celles des solutions NMS. Par conséquent, ils seront abordés dans une section distincte. Ce chapitre est consacré aux solutions d'électrolytes de bas poids moléculaire, ampholytes et non-électrolytes. 10. L'eau comme solvant Le solvant le plus répandu sur notre planète est l'eau. Le corps d'une personne moyenne pesant 70 kg contient environ 40 kg d'eau. Dans le même temps, environ 25 kg d'eau tombent sur le liquide à l'intérieur des cellules et 15 kg de liquide extracellulaire, qui comprend le plasma sanguin, le liquide intercellulaire, le liquide céphalo-rachidien, le liquide intraoculaire et le contenu liquide du tractus gastro-intestinal. Dans les organismes animaux et végétaux, l'eau est généralement supérieure à 50% et, dans certains cas, la teneur en eau atteint 90 à 95%. En raison de ses propriétés anormales, l'eau est un solvant unique, parfaitement adapté à la vie. Tout d'abord, l'eau dissout bien les composés ioniques et de nombreux composés polaires. Cette propriété de l'eau est en grande partie due à sa constante diélectrique élevée (78,5). Une autre grande classe de substances hautement solubles dans l'eau comprend des composés organiques polaires tels que les sucres, les aldéhydes, les cétones et les alcools. Leur solubilité dans l'eau s'explique par la tendance des molécules d'eau à former des liaisons polaires avec les groupes fonctionnels polaires de ces substances, par exemple avec les groupes hydroxyle des alcools et des sucres ou avec l'atome d'oxygène du groupe carbonyle des aldéhydes et des cétones. Voici des exemples de liaisons hydrogène importantes pour la solubilité des substances dans les systèmes biologiques. En raison de sa polarité élevée, l'eau provoque l'hydrolyse des substances. Étant donné que l'eau est la partie principale de l'environnement interne du corps, elle assure les processus d'absorption, de mouvement des nutriments et des produits métaboliques dans le corps. Il convient de noter que l'eau est le produit final de l'oxydation biologique de substances, en particulier du glucose. La formation d’eau résultant de ces processus s’accompagne de la libération d’une grande quantité d’énergie – environ 29 kJ/mol. D'autres propriétés anormales de l'eau sont également importantes : tension superficielle élevée, faible viscosité, points de fusion et d'ébullition élevés et densité plus élevée à l'état liquide qu'à l'état solide. L'eau est caractérisée par la présence d'associés - groupes de molécules reliées par des liaisons hydrogène. En fonction de leur affinité pour l'eau, les groupes fonctionnels de particules dissoutes sont divisés en hydrophiles (attirant l'eau), facilement solvatables par l'eau, hydrophobes (repoussant l'eau) et amphiphiles. Les groupes hydrophiles comprennent les groupes fonctionnels polaires : hydroxyle -OH, amino -NH2 , thiol -SH, carboxyle -COOH. Aux groupes hydrophobes - non polaires, par exemple les radicaux hydrocarbonés : CHXNUMX-(CH2)п -, DE6Н5 -. Les acides aminés comprennent des substances (acides aminés, protéines) dont les molécules contiennent à la fois des groupes hydrophiles (-OH, -NH2 , -SH, -COOH) et des groupements hydrophobes : (CH3 - (CH2)п ,-DE6Н5🇧🇷 Lorsque des substances amphiphiles sont dissoutes, la structure de l'eau change en raison de l'interaction avec des groupes hydrophobes. Le degré d'ordre des molécules d'eau proches des groupes hydrophobes augmente et le contact des molécules d'eau avec les groupes hydrophobes est minimisé. Des groupements hydrophobes, s'associant, poussent les molécules d'eau hors de leur zone de localisation. 11. La concentration de la solution et comment l'exprimer Solution Un système homogène de composition variable de deux substances ou plus dans un état d'équilibre est appelé. Les substances qui composent une solution sont appelées composants de la solution. Une caractéristique importante d'une solution est sa concentration. Cette valeur détermine de nombreuses propriétés de la solution. Concentration des substances (composant de la solution) est une quantité mesurée par la quantité de soluté contenue dans une certaine masse ou volume d'une solution ou d'un solvant. Les moyens les plus couramment utilisés pour exprimer la concentration sont : la fraction massique, la concentration molaire, la concentration molaire équivalente, la fraction molaire, la fraction volumique, le titre. Fraction massique W(X) exprimée en fractions d'unité, en pourcentage (%), en ppm (un millième de pour cent) et en parties par million (ppm). La fraction massique est calculée par les formules : W(X) = m(X)/m(pp), W(X) = m(X)/m(pp) × 100 %, où m(X) - masse du composant donné X (soluté), kg (g); m (pp) est la masse de la solution, kg (g). La concentration molaire est exprimée en mol/m3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. En médecine, l'utilisation d'unités de mol / l est préférable. La concentration molaire est calculée par la formule : C(X) =n(X)/V(pp) = m(X)/M(X) ×V(rr), où n(X) - quantité de substance dissoute du système, mol; M(X) est la masse molaire du soluté, kg/mol ou g/mol ; m(X) est la masse de la substance dissoute, respectivement, kg ou g; V(rr) - volume de solution, l. concentration molaire b(X) exprimé en unités de mol/kg. Formulaire d'enregistrement, par exemple: b (HCl) \u0,1d XNUMX mol / kg. Calculer la concentration molaire par la formule : b(X) =n(X)/m(rl) = m(X)/M(X) ×m(rl) où m(rl) - masse de solvant, kg. En chimie, la notion d'équivalent et de facteur d'équivalence est largement utilisée. Équivalent on appelle une particule réelle ou conditionnelle de la substance X, qui dans une réaction acido-basique donnée équivaut à un ion hydrogène, ou dans une réaction redox donnée - à un électron, ou dans une réaction d'échange donnée entre sels - à une unité de charge. Fraction volumique f(X) exprimée en fractions d'unité ou en pourcentage, elle se calcule par la formule : Ф(X) = V(X)/ V(rr) où v(X) - le volume de ce composant X de la solution ; V(rr) est le volume total du solvant. Le titre de la solution est noté T(X), unité de mesure - kg/cm3 , g/cm3 , g/ml. Le titre de la solution peut être calculé à l'aide de la formule : Т(X) = m(X)/ V(rr) où m(X) est la masse de la substance, généralement g ; V(rr) volume de la solution, ml. 12. Processus de dissolution La nature du processus de dissolution est complexe. Naturellement, la question se pose de savoir pourquoi certaines substances sont facilement solubles dans certains solvants et peu solubles ou pratiquement insolubles dans d'autres. La formation de solutions est toujours associée à certains processus physiques. Un de ces processus est la diffusion d'un soluté et d'un solvant. En raison de la diffusion, les particules (molécules, ions) sont éliminées de la surface de la substance dissoute et sont uniformément réparties dans tout le volume du solvant. C'est pourquoi, en l'absence d'agitation, la vitesse de dissolution dépend de la vitesse de diffusion. Cependant, il est impossible d'expliquer la solubilité inégale des substances dans divers solvants uniquement par des processus physiques. Le grand chimiste russe D. I. Mendeleev (1834-1907) pensait que les processus chimiques jouaient un rôle important dans la dissolution. Il a prouvé l'existence d'hydrates d'acide sulfurique H2SO4H2OH2SO42H2OH2SO44H2O et certaines autres substances, par exemple, C2Н5OH3H2A. Dans ces cas, la dissolution s'accompagne de la formation de liaisons chimiques entre les particules du soluté et le solvant. Ce processus est appelé solvatation, dans le cas particulier où le solvant est l'eau, hydratation. Comme cela a été établi, selon la nature de la substance dissoute, des solvates (hydrates) peuvent se former à la suite d'interactions physiques : interaction ion-dipôle (par exemple, lors de la dissolution de substances à structure ionique (NaCI, etc. ); interaction dipôle-dipôle - lors de la dissolution de substances à structure moléculaire (substances organiques )). Les interactions chimiques sont réalisées grâce aux liaisons donneur-accepteur. Ici, les ions solutés sont des accepteurs d'électrons et les solvants (Н2Oh, NH3) - donneurs d'électrons (par exemple, formation de complexes aquatiques), ainsi que du fait de la formation de liaisons hydrogène (par exemple, dissolution de l'alcool dans l'eau). La preuve de l'interaction chimique d'un soluté avec un solvant est fournie par les effets thermiques et le changement de couleur qui accompagnent la dissolution. Par exemple, lorsque l'hydroxyde de potassium est dissous dans l'eau, de la chaleur est libérée : KOH + xN2O \uXNUMXd KOH (N2Oh; ΔH°la solution = 55 kJ/mol. Et lorsque le chlorure de sodium est dissous, la chaleur est absorbée : NaCI + xH2O = NaCl(H2Oh; ΔH°la solution = +3,8 kJ/mol. La chaleur dégagée ou absorbée lorsqu'une mole d'une substance est dissoute est appelée chaleur de solution Qla solution Selon la première loi de la thermodynamique Qla solution = AHla solution, où AHla solution est le changement d'enthalpie lors de la dissolution d'une quantité donnée d'une substance. La dissolution du sulfate de cuivre blanc anhydre dans l'eau conduit à l'apparition d'une couleur bleue intense. La formation de solvates, le changement de couleur, les effets thermiques, ainsi qu'un certain nombre d'autres facteurs, indiquent un changement dans la nature chimique des composants de la solution lors de sa formation. Ainsi, conformément aux concepts modernes, la dissolution est un processus physico-chimique dans lequel les types d'interaction physiques et chimiques jouent un rôle. 13. Thermodynamique du processus de dissolution Selon la deuxième loi de la thermodynamique, à p, T = const, les substances peuvent se dissoudre spontanément dans n'importe quel solvant si, à la suite de ce processus, l'énergie de Gibbs du système diminue, c'est-à-dire ΔG = (ΔН - TΔS) < 0. La valeur de ΔН est appelée facteur d'enthalpie et la valeur de TΔS est appelée facteur d'entropie de dissolution. Lorsque des substances liquides et solides sont dissoutes, l'entropie du système augmente généralement (ΔS > 0), car les substances dissoutes passent d'un état plus ordonné à un état moins ordonné. La contribution du facteur d'entropie, qui contribue à l'augmentation de la solubilité, est particulièrement perceptible à des températures élevées, car dans ce cas, le facteur T est grand et la valeur absolue du produit TΔS est également grande, respectivement, la diminution du Gibbs l'énergie augmente. Lors de la dissolution de gaz dans un liquide, l'entropie du système diminue généralement (ΔS < 0), car le soluté d'un état moins ordonné (grand volume) passe dans un état plus ordonné (petit volume). Une diminution de la température favorise la dissolution des gaz, car dans ce cas le facteur T est petit et la valeur absolue du produit TΔS sera d'autant plus faible, et la diminution de l'énergie de Gibbs sera d'autant plus grande que la valeur de T sera faible. Lors de la formation d'une solution, l'enthalpie du système peut également à la fois augmenter (NaCl) et diminuer (KOH). La variation de l'enthalpie du processus de dissolution doit être considérée conformément à la loi de Hess comme la somme algébrique des contributions endo et exothermiques de tous les processus accompagnant le processus de dissolution. Ce sont les effets endothermiques de la destruction du réseau cristallin des substances, la rupture des liaisons des molécules, la destruction de la structure initiale du solvant et les effets exothermiques de la formation de divers produits d'interaction, y compris les solvates. Pour simplifier la présentation, l'incrément de l'enthalpie de dissolution ΔНla solution peut être représenté par la différence d'énergie Ecr, dépensé pour la destruction du réseau cristallin de la substance dissoute, et l'énergie Esol, libéré lors de la solvatation des particules de soluté par les molécules de solvant. En d'autres termes, le changement d'enthalpie est la somme algébrique du changement d'enthalpie ΔHcr à la suite de la destruction du réseau cristallin et d'une modification de l'enthalpie ΔНsol due à la solvatation par des particules de solvant : Hla solution = AHcr + ΔHsol, où AHla solution - changement d'enthalpie lors de la dissolution. Cependant, la dissolution des gaz nobles dans les solvants organiques s'accompagne souvent de l'absorption de chaleur, par exemple, l'hélium et le néon dans l'acétone, le benzène, l'éthanol et le cyclohexane. Lors de la dissolution de solides à structure cristalline moléculaire et de liquides, les liaisons moléculaires ne sont pas très fortes, et donc généralement ΔHsol > ΔNcr Cela conduit au fait que la dissolution, par exemple, des alcools et des sucres est un processus exothermique (ΔHla solution <0). Lors de la dissolution de solides avec un réseau ionique, le rapport d'énergie Ecr et Esol peut être différent. Cependant, dans la plupart des cas, l'énergie libérée lors de la solvatation des ions ne compense pas l'énergie dépensée pour la destruction du réseau cristallin ; par conséquent, le processus de dissolution est endothermique. Ainsi, les données thermodynamiques permettent de prédire la dissolution spontanée de diverses substances sur la base des première et deuxième lois de la thermodynamique. 14. Solubilité Si un soluté est en contact avec un solvant, le processus de formation de la solution se déroule dans de nombreux cas spontanément jusqu'à ce qu'une certaine concentration limite soit atteinte (la saturation se produit). Cela se produit lorsque l'équilibre est atteint, lorsque les facteurs d'enthalpie et d'entropie sont égaux, c'est-à-dire ΔН = TΔS. Par exemple, lorsque des cristaux sont introduits dans un liquide, des molécules ou des ions passent de la surface du cristal dans la solution. En raison de la diffusion, les particules sont uniformément réparties dans tout le volume du solvant. La dissolution se poursuit jusqu'à saturation. Une solution contenant le maximum de soluté à une température donnée et en équilibre avec un excès de soluté est dite saturée. Une solution sursaturée est une solution dont la concentration est supérieure à celle d'une solution saturée. Une solution moins concentrée qu'une solution saturée est dite insaturée. La capacité d'une substance à se dissoudre dans un solvant particulier est appelée solubilité. Numériquement, la solubilité d'une substance est égale à la concentration de sa solution saturée. La solubilité peut être exprimée dans les mêmes unités que la concentration, par exemple, en termes de quantité de soluté contenue dans 1 litre d'une solution saturée, mol/l, ou en termes de masse d'un soluté dans 100 g d'une solution saturée . L'unité de solubilité est le gramme pour 100 g de solvant. La valeur correspondante est appelée coefficient de solubilité. La solubilité dépend de la nature du soluté et du solvant, de la température, de la pression et de la présence d'autres substances dans la solution. Influence sur la solubilité de la nature des composants La capacité des substances à se dissoudre est déterminée par la nature des forces d'interaction entre les molécules des composants de la solution X1 leur2 : solvant - solvant (X1 - X1 ), soluté - soluté (X2 - X2 ), solvant - soluté (X1 - X2 ) (les points indiquent une liaison moléculaire). La solubilité des substances varie considérablement. Les exemples montrent la solubilité de différents sels dans le même solvant (eau) et la solubilité de la même substance (AgNO3 ) dans divers solvants. Les substances avec un type de liaison ionique et les substances constituées de molécules polaires se dissolvent mieux dans les solvants polaires, tels que l'eau, les alcools. Ces solvants se caractérisent par une constante diélectrique élevée. La haute solubilité des substances est assez souvent due à la formation de liaisons intermoléculaires, notamment hydrogène. Ainsi, la solubilité mutuelle illimitée de l'eau et de l'alcool s'explique par la formation de liaisons hydrogène entre les molécules d'eau et d'alcool, et la dissolution des cristaux AgcI dans une solution aqueuse d'ammoniaque s'explique par la formation d'une liaison chimique donneur-accepteur de l'argent. ion avec des molécules d'ammoniac (AgCI est pratiquement insoluble dans l'eau). Pour la même raison, la pyridine, solvant à faible constante diélectrique, présente une très grande solubilité. La solubilité caractérisant le véritable équilibre, l'influence des conditions extérieures sur cet état (pression, température) peut être estimée qualitativement par le principe de Le Chatelier. De telles évaluations sont nécessaires dans la pratique de la plongée profonde, lorsque l'on travaille dans des ateliers chauds, etc. 15. Solubilité des gaz dans les liquides. Lois de Henry-Dalton et Sechenov La dissolution des gaz dans les liquides s'accompagne presque toujours d'un dégagement de chaleur. Par conséquent, la solubilité des gaz diminue avec l'augmentation de la température selon le principe de Le Chatelier. Ce modèle est souvent utilisé pour éliminer les gaz dissous de l'eau (par exemple le CO02) par ébullition. Parfois, la dissolution d'un gaz s'accompagne d'une absorption de chaleur (par exemple, la dissolution de gaz nobles dans certains solvants organiques). Dans ce cas, l'augmentation de la température augmente la solubilité du gaz. Un gaz ne se dissout pas indéfiniment dans un liquide. A une certaine concentration de gaz X, un équilibre s'établit :  Lorsqu'un gaz se dissout dans un liquide, une diminution significative du volume du système se produit. Par conséquent, une augmentation de la pression, selon le principe de Le Chatelier, devrait conduire à un déplacement de l'équilibre vers la droite, c'est-à-dire à une augmentation de la solubilité du gaz. Si le gaz est peu soluble dans un liquide donné et que la pression est faible, alors la solubilité du gaz est proportionnelle à sa pression. Cette dépendance est exprimée par la loi de Henry (1803) : la quantité de gaz dissous à une température donnée dans un volume de liquide donné à l'équilibre est directement proportionnelle à la pression du gaz. La loi d'Henry peut s'écrire sous la forme suivante : с (X) =Kr(X) ×P(X) où est la concentration de gaz dans une solution saturée, mol/l ; P(X) - pression de gaz X sur la solution, Pa ; Kr(X) - Constante de Henry pour le gaz X, mol × l1 × Pa1 . La constante de Henry dépend de la nature du gaz, du solvant et de la température. La loi d'Henry n'est valable que pour des solutions relativement diluées, à basse pression et en l'absence d'interaction chimique entre les molécules du gaz dissous et le solvant. La loi de Henry est un cas particulier de la loi générale de Dalton. Si nous parlons de la dissolution non pas d'une substance gazeuse, mais d'un mélange de gaz, alors la solubilité de chaque composant obéit à la loi de Dalton : la solubilité de chacun des composants du mélange gazeux à température constante est proportionnelle à la pression partielle du composant au-dessus du liquide et ne dépend pas de la pression totale du mélange et de l'individualité des autres composants. Autrement dit, dans le cas de la dissolution d'un mélange de gaz dans un liquide, la pression partielle p! ce composant. La pression partielle d'un composant s'entend comme la proportion de la pression du composant par rapport à la pression totale du mélange gazeux : Рi/Rcommun La pression partielle du composant est calculée par la formule Étudiant la solubilité des gaz dans les liquides en présence d'électrolytes, le physiologiste russe I. M. Sechenov (1829-1905) a établi le schéma suivant (loi de Sechenov) : la solubilité des gaz dans les liquides en présence d'électrolytes diminue ; des gaz sont libérés. Рi = Pcommun ×(Xi) où pi - pression partielle du composant Xi; Рcommun pression totale du mélange gazeux ; x(Xi) est la fraction molaire du ième composant. Étudiant la solubilité des gaz dans les liquides en présence d'électrolytes, le physiologiste russe I. M. Sechenov (1829-1905) a établi le schéma suivant (loi de Sechenov) : la solubilité des gaz dans les liquides en présence d'électrolytes diminue ; des gaz sont libérés. 16. Le rôle de la diffusion dans les processus de transfert de substances dans les systèmes biologiques La diffusion joue un rôle important dans les systèmes biologiques. Tout d'abord, le mouvement des nutriments et des produits métaboliques dans les fluides tissulaires se fait par diffusion. De plus, dans de nombreux cas, la vitesse des processus physicochimiques dans les organismes vivants est déterminée par la vitesse de diffusion des réactifs, car la diffusion des réactifs est généralement l'étape la plus lente du processus, tandis que les réactions biochimiques impliquant des enzymes se déroulent très rapidement. Chaque cellule vivante est entourée d'une membrane qui sert à protéger et à réguler l'environnement intracellulaire. Les substances traversent les membranes par deux mécanismes principaux : par diffusion ordinaire (transport passif) et par transfert énergétiquement activé (transport actif). La couche interne de la membrane est constituée de chaînes d'hydrocarbures. Par conséquent, de nombreuses petites molécules neutres et molécules de HMS non polaires sont solubles dans cette couche et peuvent traverser la membrane par diffusion normale le long d'un gradient de concentration. Un tel transport de substances est appelé passif. La diffusion joue un rôle important dans le processus d’oxygénation du sang dans les poumons. En raison de la grande ramification, la surface des alvéoles pulmonaires est grande (~ 80 m2), de sorte que l'oxygène est activement dissous dans le plasma et pénètre dans les érythrocytes. Le sang veineux est appauvri en oxygène - la concentration d'oxygène dans le sang veineux tend vers zéro. Par conséquent, le gradient de concentration d'oxygène entre l'atmosphère et le sang entrant dans les poumons est élevé, ce qui entraîne une absorption active (selon la loi de Fick). Le mouvement de substances d'une zone de concentration plus faible vers une zone de concentration plus élevée contre un gradient est appelé transport actif. Un tel processus ne peut pas se dérouler spontanément et nécessite des coûts énergétiques. La source d'énergie est la réaction d'hydrolyse exoergonique d'un composé bio-organique - l'adénosine triphosphate (ATP). Une distribution stationnaire stable des concentrations d'ions K à l'intérieur et à l'extérieur de la cellule est obtenue lorsque le flux d'ions K à travers la membrane dans la cellule devient égal au flux d'ions K de la cellule en raison de la diffusion passive. La distribution (homéostasie ionique) est obtenue de la même manière pour les ions Na, seuls le transport actif et la diffusion passive compensatrice des ions sont dirigés à l'opposé des flux correspondants d'ions K. Le processus de diffusion est largement utilisé en médecine. Par exemple, une méthode de dialyse basée sur la sélectivité de diffusion de substances de faible poids moléculaire à travers une membrane semi-perméable le long d'un gradient de concentration est utilisée dans la pratique clinique pour créer un dispositif de « rein artificiel ». Les particules du DIU ne traversent pas une membrane semi-perméable, de sorte que les fluides biologiques (par exemple, le plasma sanguin) peuvent être purifiés par dialyse des substances nocives de faible poids moléculaire - les « scories » (urée, acide urique, bilirubine, amines, excès d'ions K) qui s'accumulent dans diverses maladies. Pendant la purification, le sang du patient prélevé dans la veine pénètre dans des chambres spéciales dotées de membranes semi-perméables à travers lesquelles le NMS peut se diffuser et être éliminé du plasma. Dans un certain nombre de maladies inflammatoires, la destruction des protéines se produit et, dans le plasma sanguin, avec le NMS, il existe des fragments de protéines (peptides et polypeptides) qui doivent également être éliminés. 17. Abaissement du point de congélation et élévation du point d'ébullition des solutions Une conséquence directe de la diminution de la pression de vapeur sur la solution est une modification du point de congélation ΔTз et point d'ébullition des solutions ΔTк par rapport aux valeurs de ces quantités pour un solvant pur. Les relations entre ces quantités découlent également de la deuxième loi de la thermodynamique. Le point d'ébullition d'un liquide est la température à laquelle sa pression de vapeur devient égale à la pression extérieure (par exemple, à 101,3 kPa, le point d'ébullition de l'eau est de 100°C). Le point de congélation (cristallisation) d'un liquide est la température à laquelle la pression de vapeur sur le liquide est égale à la pression de vapeur sur la phase solide. Si on désigne les points de congélation et d'ébullition de la solution T3 et Tk, et les mêmes valeurs pour le solvant T°3 et T°к , alors on obtient : ΔTk = Tк - T°к > 0, AT3 = T°3 - T3 > 0. Les effets de l'augmentation du point d'ébullition et de l'abaissement du point de congélation des solutions peuvent être expliqués qualitativement en utilisant le principe de Le Chatelier. En effet, si dans un système d'équilibre "liquide - vapeur" (par exemple, H2О(H) -H2О(G)), introduisez une substance soluble non volatile, la pression de vapeur du solvant sur la solution diminuera. Pour compenser la diminution de la pression de vapeur et atteindre l'état d'équilibre précédent, la solution doit être chauffée à une température plus élevée (plus de 373°K), car le processus est endothermique. Soit un système d'équilibre "phase solide - liquide", par exemple H2О(T) >H2О(H), à 273°K. Si une certaine quantité d'une substance non volatile (insoluble dans la phase solide) est dissoute dans la phase liquide, alors la concentration de molécules d'eau dans la phase liquide diminuera. Conformément au principe du Chatelier, un processus va se déclencher pour augmenter la quantité d'eau dans la phase liquide : la fonte de la glace. Pour établir un nouvel équilibre, la solution doit être refroidie, c'est-à-dire que la température doit être abaissée, car le processus est exothermique. Selon la loi de Raoult pour les solutions diluées, la diminution de la pression de vapeur est proportionnelle à la concentration de la solution. Par conséquent, l'augmentation du point d'ébullition et la diminution du point de congélation de ces solutions devraient augmenter avec l'augmentation de leur concentration. En étudiant la congélation et l'ébullition des solutions, Raul a trouvé : une augmentation du point d'ébullition ΔTк et abaissement du point de congélation ΔТ3 solutions diluées de non-électrolytes est directement proportionnelle à la concentration molaire de la solution : ATк =Kэb(X), AT3 =Kз b(X), où b(X) - concentration molaire, mol/kg ; Кз et Kэ - coefficients de proportionnalité, kg × K × mol1 , appelées respectivement constantes ébulliométriques et cryométriques. La signification physique des constantes Kэ et Kз devient clair si on accepte b(X) = 1. Alors Kэ = ΔTк , et Kз = ΔTз . En d'autres termes, la constante ébulliométrique est numériquement égale à l'augmentation du point d'ébullition d'une solution monomolaire, et la constante cryométrique est numériquement égale à la diminution du point de congélation d'une solution monomolaire. Les constantes ébuliométriques et cryométriques ne dépendent que de la nature du solvant et ne dépendent pas de la nature du soluté (solutions idéales). 18. Pression osmotique L'osmose est la pénétration principalement unilatérale de molécules de solvant (diffusion) à travers une membrane semi-perméable d'un solvant dans une solution ou d'une solution à plus faible concentration dans une solution à plus forte concentration. Une condition nécessaire à l'apparition de l'osmose est la présence d'un solvant et d'une solution ou de deux solutions de concentrations différentes, séparées par une membrane semi-perméable. Du point de vue de la thermodynamique, la force motrice de l'osmose est la volonté du système d'égaliser les concentrations, puisque dans ce cas l'entropie du système augmente, puisque le système passe dans un état moins ordonné, l'énergie de Gibbs du système diminue en conséquence et les potentiels chimiques sont égalisés. L’osmose est donc un processus spontané. Une expérience simple peut servir d'illustration expliquant le lien entre le mécanisme de l'osmose et un changement de pression de vapeur sur une solution. Si un verre avec un solvant pur et un verre avec une solution d'une substance non volatile (les niveaux de liquides dans les récipients sont les mêmes) sont placés dans un récipient en verre fermé, alors après un certain temps, le niveau du liquide dans le premier verre diminuera et le niveau de la solution dans le second verre augmentera. Dans ce cas, le solvant passe du premier bécher au deuxième bécher, ce qui est dû (selon la loi de Raoult) à une pression de vapeur du solvant plus faible sur la solution que sur le solvant pur. Ainsi, l'espace d'air entre le solvant et la solution agit comme une membrane semi-perméable. Remplissons un récipient à parois semi-perméables avec une solution aqueuse de glucose et plaçons-le dans un autre récipient avec de l'eau de manière à ce que les niveaux des liquides dans ces récipients coïncident. Du fait de l'osmose, le volume de la solution dans le premier récipient augmente et le niveau de liquide dans ce récipient augmente progressivement. Cela crée une pression hydrostatique supplémentaire qui empêche l'osmose. La pression hydrostatique de la colonne de liquide à l'équilibre osmotique détermine la pression osmotique de la solution. Pression osmotique appelée la valeur mesurée par la pression hydraulique minimale qui doit être appliquée à la solution pour arrêter l'osmose. Lois de la pression osmotique. Van't Hoff a proposé une équation empirique pour calculer la pression osmotique de solutions diluées de non-électrolytes : π = C(X)rt, où π - pression osmotique, kPa; С(X) - concentration molaire, mol/l ; R est la constante universelle des gaz égale à 8,31 kPa - l / (mole - K); T est la température absolue, K. Bien que la loi de van't Hoff ait été établie sur la base de données expérimentales, elle peut être déduite des conditions d'équilibre thermodynamique à ΔG = 0. Par conséquent, cette loi doit être considérée comme une conséquence de la deuxième loi de la thermodynamique. L'expression sous la forme ci-dessus est similaire à l'équation de Clapeyron-Mendeleev pour les gaz parfaits, cependant, ces équations décrivent des processus différents. 19. Le rôle de l'osmose et de la pression osmotique dans les systèmes biologiques Le phénomène d'osmose joue un rôle important dans de nombreux systèmes chimiques et biologiques. L'osmose régule le flux d'eau dans les cellules et les structures intercellulaires. L'élasticité des cellules (turgescence), qui assure l'élasticité des tissus et le maintien d'une certaine forme des organes, est due à la pression osmotique. Les cellules animales et végétales ont des coquilles ou une couche superficielle de protoplasme qui a les propriétés de membranes semi-perméables. Lorsque ces cellules sont placées dans des solutions à différentes concentrations, on observe une osmose. Les solutions qui ont la même pression osmotique sont dites isotoniques. Si deux solutions ont une pression osmotique différente, alors la solution avec une pression osmotique élevée est hypertonique par rapport à la seconde, et la seconde est hypotonique par rapport à la première. Lorsque les cellules sont placées dans une solution isotonique, elles conservent leur taille et fonctionnent normalement. Lorsque les cellules sont placées dans une solution hypotonique, l'eau d'une solution externe moins concentrée passe dans les cellules, ce qui entraîne leur gonflement, puis la rupture des membranes et l'écoulement du contenu cellulaire. Cette destruction des cellules s'appelle la lyse, dans le cas des globules rouges ce processus s'appelle l'hémolyse. Le sang dont le contenu cellulaire sort pendant l'hémolyse est appelé sang vernis en raison de sa couleur. Lorsque les cellules sont placées dans une solution hypertonique, l'eau quitte les cellules dans une solution plus concentrée et un plissement (séchage) des cellules est observé. Ce phénomène est appelé plasmolyse. Les fluides biologiques humains (sang, lymphe, fluides tissulaires) sont des solutions aqueuses de composés de faible poids moléculaire - NaCl, KCl, CaCl, de composés de haut poids moléculaire - protéines, polysaccharides, acides nucléiques et éléments formés - érythrocytes, leucocytes, plaquettes. Leur effet total détermine la pression osmotique des fluides biologiques. La pression osmotique du sang humain à 310°K (37°C) est de 780 kPa (7,7 atm). La même pression est créée par une solution aqueuse de NaCl à 0,9 % (0,15 mol/l), qui est donc isotonique au sang (solution saline). Cependant, en plus des ions Na et C1, il existe d'autres ions dans le sang, ainsi que des DIU et des éléments formés. Par conséquent, à des fins médicales, il est plus correct d'utiliser des solutions contenant les mêmes composants et en même quantité que ceux qui composent le sang. Ces solutions sont utilisées comme substituts sanguins en chirurgie. Le corps humain, en plus de la pression osmotique, est caractérisé par la constance (homéostasie) et d'autres indicateurs physicochimiques du sang, tels que l'acidité. Les fluctuations admissibles de la pression osmotique du sang sont très faibles et même en cas de pathologie grave, elles ne dépassent pas plusieurs dizaines de kPa. Dans diverses procédures, seules des solutions isotoniques peuvent être injectées dans le sang des humains et des animaux en grande quantité. Avec des pertes de sang importantes (par exemple, après des opérations majeures, des blessures), les patients reçoivent plusieurs litres de solution isotonique pour compenser la perte de liquide avec du sang. Le phénomène d'osmose est largement utilisé dans la pratique médicale. Ainsi, en chirurgie, on utilise des pansements hypertoniques (gaze imbibée d'une solution hypertonique de NaCl à 10%), qui sont injectés dans les plaies purulentes. Selon la loi de l'osmose, le courant du fluide de la plaie à travers la gaze est dirigé vers l'extérieur, à la suite de quoi la plaie est constamment nettoyée du pus, des micro-organismes et des produits de décomposition. 20. Degré de dissociation (ionisation). La force des électrolytes Les électrolytes qui se dissocient presque complètement en ions (s'ionisent) sont appelés forts, et les électrolytes qui ne s'ionisent pas complètement sont appelés faibles. Dans une solution d'électrolytes faibles, avec des ions, il y a des molécules non ionisées. C'est par une ionisation incomplète que S. Arrhenius a expliqué pourquoi le coefficient isotonique des solutions d'électrolytes faibles n'est pas égal à un nombre entier. Pour caractériser quantitativement l'intégralité de la dissociation, le concept de degré de dissociation (ionisation) est introduit. Le degré de dissociation (ionisation) d'un électrolyte est le rapport du nombre de molécules décomposées en ions au nombre total de ses molécules introduites dans la solution. En d'autres termes, an est la proportion de molécules d'électrolyte décomposées en ions. Le degré de dissociation an s'exprime en pourcentage ou en fractions d'unité : αн = Nн/ Np, où N est le nombre de molécules d'électrolyte décomposées en ions ; Np le nombre de molécules d'électrolyte introduites dans la solution (dissoutes). Donc pour C(CHXNUMXCOOH) = 0,1 mol/l, degré de dissociation αн = 0,013 (ou 1,3%). Selon le degré de dissociation, les électrolytes sont classiquement divisés en forts (αн > 30 %) et faible (αн < 3%). Dans l'intervalle, les électrolytes sont considérés comme de force moyenne. Presque tous les sels sont considérés comme des électrolytes forts. Parmi les acides et les bases les plus importants, H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . Les électrolytes faibles comprennent la plupart des acides organiques, ainsi que certains composés inorganiques - H2S, HCN, N2CO3 , ALORS3 , HCl0, N2SUR3IN3 ,Hg2CI2 ,Fe(SCN)3 . An est déterminé expérimentalement en mesurant l'écart des propriétés collatives des solutions d'électrolyte par rapport aux dépendances théoriques des solutions idéales. Par exemple, le coefficient isotonique i est déterminé par la méthode cryoscopique, puis le degré de dissociation est calculé.Pour les électrolytes forts, le degré de dissociation est apparent, car ils se dissocient presque complètement en ions. L'écart du coefficient isotonique i par rapport à la connaissance entière s'explique pour eux non par la présence de molécules non associées dans la solution, mais par d'autres raisons. La dissociation s'accompagne d'un dégagement ou d'une absorption de chaleur. Par conséquent, le degré de dissociation doit dépendre de la température. L'influence de la température peut être estimée selon le principe de Le Chatelier. Si la dissociation électrolytique se produit avec l'absorption de chaleur, alors avec l'augmentation de la température, a augmente, si avec le dégagement de chaleur, an diminue. Le degré de dissociation électrolytique est affecté par la concentration de la solution. Lorsque la solution est diluée, le degré de dissociation augmente de manière significative. À cet égard, la classification indiquée de la force des électrolytes en fonction du degré de dissociation αн valable uniquement pour les solutions ayant une concentration d'environ 0,1 mol/l. Si l'on considère la dissociation électrolytique comme un processus réversible à l'équilibre, alors, conformément au principe de Le Chatelier, la dilution avec de l'eau augmente le nombre de molécules distillées, c'est-à-dire que le degré de dissociation augmente. Le degré de dissociation des électrolytes faibles est également affecté par l'ajout d'ions du même nom. Ainsi, l'introduction d'un électrolyte faible dans le système d'équilibre augmente la concentration d'ions, ce qui, conformément au principe de Le Chatelier, entraîne un déplacement significatif de l'équilibre de dissociation vers la gauche, c'est-à-dire une diminution du degré de dissociation . Ainsi, l'ajout d'ions du même nom à une solution d'électrolyte faible réduit le degré de sa dissociation. 21. Constante de dissociation. Loi d'élevage d'Ostwald. Théorie des solutions d'électrolytes forts Quantitativement, la dissociation électrolytique en tant que processus réversible à l'équilibre peut être caractérisée par une constante de dissociation (ionisation) déterminée par la loi d'action de masse. La loi d'action de masse, à proprement parler, s'applique aux réactions réversibles, c'est-à-dire aux solutions d'électrolytes faibles. Par exemple, la dissociation de l'électrolyte KtnAnm peut être représentée comme un processus d'équilibre : Ktn Anm × nKtm+ +mAn . D'après la loi d'action des masses, la constante d'équilibre s'écrit : КД = (Ktm+)n+(Unn)m + (KtnAnm) où (Ktm+) Et unn ) - concentrations d'équilibre molaire des ions électrolytes ; (KtnAnm) est la concentration molaire à l'équilibre des molécules d'électrolyte non dissociées ; КД est la constante d'équilibre, appelée constante de dissociation. Cette équation n'est valable que pour les solutions diluées d'électrolytes faibles. Lors de son application à des solutions concentrées et à des solutions d'électrolytes forts, l'équation doit être modifiée. Plus la constante de dissociation K est grandeД , plus l'électrolyte se dissocie. Contrairement au degré de dissociation KД dépend uniquement de la nature du solvant, de l'électrolyte et de la température, mais ne dépend pas de la concentration de la solution. Ainsi, la constante et le degré de dissociation électrolytique sont des caractéristiques quantitatives de la dissociation. Naturellement, il existe un lien entre eux. Les acides polybasiques et les bases polyacides se dissocient par étapes. Par exemple, la dissociation de l’acide phosphorique se déroule en trois étapes :  De même pour les bases polyacides (par exemple, Ca (OH)2) - la dissociation s'effectue en deux étapes. La dissociation par étapes est caractérisée par le fait que la décomposition de l'électrolyte à chaque étape ultérieure se produit dans une moindre mesure qu'à la précédente. Ce caractère du changement des constantes de dissociation peut s'expliquer par l'attraction électrostatique sur la base de la loi de Coulomb. L'énergie d'ionisation est minimale lorsqu'un ion se détache d'une molécule d'électrolyte neutre. Le détachement d'un ion à chaque étape suivante de dissociation nécessite une énergie croissante, puisque l'élimination d'un ion se produit à partir d'une particule dont la charge devient plus grande aux étapes suivantes. La dissociation presque complète des électrolytes forts en ions, quelle que soit la concentration de leurs solutions, est confirmée par des méthodes de recherche physiques et physico-chimiques. Ainsi, les valeurs de la chaleur de neutralisation de tous les acides forts par des bases fortes dans des solutions diluées sont presque les mêmes. Quelle que soit la nature de l'acide et de la base, on obtient la même valeur de AH = 56,5 kJ/mol. Ce fait est une preuve évidente de la dissociation complète des solutions diluées d'acides et de bases. Dans tous les cas, le processus courant se produisant lors de la neutralisation est la combinaison d'ions dans une molécule 22. Théorie des acides et des bases De nombreux électrolytes, notamment les hydroxydes de divers éléments E, présentent les propriétés des acides ou des bases. La dissociation de l'hydroxyde d'EON peut se dérouler de deux manières : 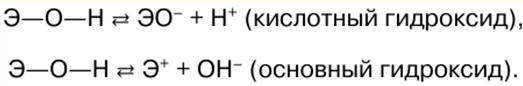 L'écart peut se produire le long des deux liaisons du groupe E-O-N. Comme on le sait, la polarité et la force des liaisons dépendent de la différence d'électronégativité des éléments, de la taille et de la charge effective des atomes. Si l'énergie de rupture de la liaison O-H est bien inférieure à l'énergie de rupture de la liaison E-O, alors la dissociation de l'hydroxyde se déroule selon le type d'acide. Si, au contraire, l'énergie de rupture de la liaison O-H est bien supérieure à l'énergie de rupture de la liaison E-O, alors la dissociation se déroule selon le type principal. Dans les hydroxydes de métaux alcalins et alcalino-terreux, ainsi que les métaux de transition dans des états d'oxydation faibles, la force de liaison E-O est relativement faible, l'oxygène est plus fortement lié à l'hydrogène et la dissociation E-O-H se déroule principalement selon le type de base, c'est-à-dire avec le élimination de l'hydroxyde dione . Cela est dû au fait que les ions de ces éléments sont plutôt gros et ont une petite charge effective, c'est-à-dire qu'ils ont une faible capacité de polarisation. Avec une augmentation du degré d'oxydation, l'effet polarisant de l'atome E augmente (une augmentation de la charge spécifique), l'oxygène est plus fermement lié à l'élément E et la dissociation de E-O-H se déroule principalement selon le type d'acide, c'est-à-dire , l’ion hydrogène est séparé. Cette dernière est liée à la redistribution de la densité électronique au niveau de l’atome d’oxygène. En conséquence, la liaison E-O devient plus forte et la liaison O-H s'affaiblit. Actuellement, il n'existe pas de définition univoque des concepts d'acide et de base, qui pourrait également être utilisée pour caractériser les interactions acide-base dans n'importe quel solvant. Pour caractériser de nombreux électrolytes dans des solutions aqueuses, il est encore possible d'utiliser les notions d'acide et de base données par Arrhenius : 1) un acide est un électrolyte qui se dissocie dans des solutions pour former des ions hydrogène H ; 2) la base est un électrolyte qui se dissocie en solution avec formation d'ions hydroxyde OH ; 3) l'ampholyte (hydroxyde amphotère) est un électrolyte qui se dissocie en solution pour former à la fois des ions hydrogène et des ions hydroxyde. Les ampholytes comprennent les hydroxydes de zinc, d'aluminium, de chrome et d'autres éléments amphotères, ainsi que les acides aminés, les protéines, les acides nucléiques. L'application du principe de Le Chatelier à la chaîne des équilibres acido-basiques montre qu'avec une augmentation de la concentration en ions hydroxyde OH dans le système, la probabilité de dissociation de type acide augmente. Une augmentation de la concentration en ions hydrogène H+ dans le système conduit à une dissociation prédominante selon le type principal. Cela signifie que dans un environnement acide, l’ampholite présente un caractère basique et que dans un environnement alcalin, elle présente un caractère acide. Par exemple, l'hydroxyde de zinc se comporte comme une base lorsqu'il interagit avec des acides : Zn (OH)2 + 2HCI - ZnCI2 + 2Н2Oh et lors de l'interaction avec des alcalis - en tant qu'acide : Zn(OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. Systèmes tampons sanguins Plasma sanguin Les systèmes tampons sont d'une grande importance dans le maintien de l'équilibre acido-basique des organismes. Les fluides intracellulaires et extracellulaires de tous les organismes vivants se caractérisent par une valeur de pH constante, qui est maintenue à l'aide de systèmes tampons. La valeur du pH de la plupart des fluides intracellulaires se situe entre 6,8 et 7,8. L'équilibre acido-basique de l'équilibre KO dans le sang humain est assuré par des systèmes tampons d'hydrogénocarbonate, de phosphate et de protéines. La valeur normale du pH du plasma sanguin est de 7,40 ± 0. Cela correspond à la plage des valeurs d'acidité active de 05 à 3,7x4,0 mol/l. Puisqu'il existe différents électrolytes dans le sang (HC1083 H2CO3 H2RO4 , NRO42 ), protéines, acides aminés, ce qui signifie qu'ils se dissocient à un point tel que l'activité d'un (H +) se situe dans la plage indiquée. Étant donné que la teneur en substances inorganiques et organiques dans le plasma et les cellules sanguines n'est pas la même, il est conseillé de considérer ces composants sanguins séparément. Plasma sanguin Système tampon HCO3 / N2CO3 est composé d'acide carbonique2CO3 et base conjuguée HCO3 . C’est le système tampon le plus important du sang. L'un des composants est l'acide carbonique H2CO3 - formé par l'interaction du CO dissous dans le plasma2 avec de l'eau: CO2(r) + N2Poule2CO3. où CO2(r) - concentration de CO dissous2 . La constante d'équilibre de cette réaction est : K = [N2CO3] / [CO2] Entre CO2 dans les alvéoles et le tampon hydrogénocarbonate du plasma sanguin circulant dans les capillaires des poumons, une chaîne d'équilibres s'établit. Le système de tampon hydrogénocarbonate agit comme un tampon physiologique efficace à un pH proche de 7,4. Lors de l'entrée dans le sang d'acides - donneurs de H+ l'équilibre dans la chaîne selon le principe de Le Chatelier se déplace vers la gauche du fait que les ions HCO3 lier les ions H en molécules H2CO3 . Dans le même temps, la concentration de H2CO3 augmente et la concentration en ions HCO3 diminue. Augmenter la concentration de H2CO3 conduit à un déplacement de l'équilibre vers la gauche, (principe de Le Chatelier). Il provoque la pourriture2CO3 et une augmentation de la concentration de CO2 dissous dans le plasma. En conséquence, l'équilibre se déplace vers la gauche et la pression de CO augmente.2 dans les poumons. Excès de CO2 excrété par le corps. En conséquence, le système hydrogénocarbonate du sang s'équilibre rapidement avec le CO2 dans les alvéoles et maintient efficacement la constance du pH du plasma sanguin. 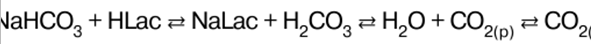 Ainsi, une valeur de pH sanguin normale est maintenue avec un changement de pH légèrement prononcé dû à l'acidose. Dans les espaces clos, ils souffrent souvent d'étouffement (manque d'oxygène), d'une respiration accrue. Cependant, la suffocation n'est pas tant associée à un manque d'oxygène qu'à un excès de CO2. Excès de CO2 dans l'atmosphère, selon la loi de Henry, entraîne une dissolution supplémentaire de CO2 en sang. Et cela conduit à une diminution du pH sanguin, c'est-à-dire à une acidose. Le système tampon hydrogénocarbonate répond le plus rapidement aux changements de pH sanguin. Son pouvoir tampon acide est Vк \u40d XNUMX mmol / l de plasma sanguin, et la capacité tampon pour les alcalis est bien inférieure et est approximativement égale à Vщ = 1-2 mmol/l de plasma sanguin. 24. Réactions de neutralisation Les réactions de neutralisation sont appelées réactions d'échange de l'interaction des acides et des bases, à la suite desquelles du sel et de l'eau se forment. Envisagez différents types de réactions de neutralisation. 1. Neutralisation d'une base forte par un acide fort : KOH + HNO3 - SAVOIR3 + N2O. L'équation ionique moléculaire pour une telle réaction H+ + OH → N2O et la valeur négative de l'énergie de Gibbs ΔG° montrent que l'équilibre est pratiquement déplacé vers la formation d'eau. Un cas courant de réaction de neutralisation est l'interaction d'acides et de bases dont la force diffère (le degré de dissociation). Ces réactions ne se terminent pas en raison de la réaction inverse de l'hydrolyse du sel. 2. Neutralisation d'un acide faible par une base forte :  ou sous forme moléculaire :  Dans ce cas, la réaction de neutralisation est réversible. La réaction de neutralisation d'une base faible avec un acide fort est également réversible :  ou sous forme moléculaire : 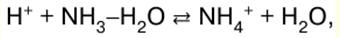 et aussi - une base faible avec un acide faible : 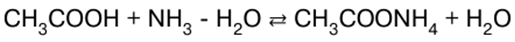 ou sous forme moléculaire :  Dans ces systèmes, l'équilibre est fortement décalé vers la droite, car l'eau est un électrolyte beaucoup plus faible que l'acide cyanhydrique, l'ammoniac et l'acide acétique. Les réactions de neutralisation constituent la base de la méthode de neutralisation. Cette méthode est utilisée dans les laboratoires cliniques pour déterminer l'acidité du suc gastrique, la capacité tampon du plasma sanguin. En pharmacologie, il est utilisé pour l'analyse quantitative des acides inorganiques (chlorhydrique, sulfurique, borique) et organiques (acétique, benzoïque, tartrique, citrique, salicylique). Dans les études biopharmaceutiques, le pKa des acides et le pKa des bases sont déterminés par la méthode de neutralisation, car la valeur de ces valeurs peut prédire la capacité des médicaments à traverser les membranes biologiques. Le titrage acide-base est utilisé pour déterminer le pKа acides aminés et pKа groupes de dissociation dans les protéines. Les courbes de titrage des protéines obtenues à deux températures différentes peuvent être utilisées pour déterminer le nombre de groupes carboxyle, imidazole et autres. Le titrage des acides aminés et des protéines permet de déterminer leurs points isoélectriques. L'hydrolyse est la décomposition d'une substance par l'eau. Des composés chimiques de différentes classes peuvent subir une hydrolyse : protéines, lipides, glucides, esters, sels, etc. En chimie inorganique, on les rencontre le plus souvent avec l'hydrolyse des sels. 25. Hydrolyse du sel Hydrolyse du sel - c'est l'interaction du sel avec les molécules d'eau, conduisant à la formation de composés à faible dissociation. Le processus d'hydrolyse consiste en la transition d'un proton d'une molécule d'eau à un ion donné (CO32 + HOH * HCO3+ OH ) ou d'un ion donné, y compris d'un cation métallique hydraté, à une molécule d'eau. Selon la nature du sel, l'eau agit soit comme un acide, soit comme une base, et le sel est respectivement la base conjuguée ou l'acide conjugué. Quatre variantes d'hydrolyse sont possibles selon le type de sel. 1. Sels formés par un acide fort et une base faible :  2. Sels formés par une base forte et un acide faible : CH3COONa + HOH → CH3COOH + NaOH. 3. Sels formés par un acide faible et une base faible. Le cyanure d'ammonium est hydrolysé par la réaction : 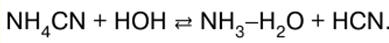 4. Sels formés par un acide fort et une base forte. NaCl, KNO3 ne subissent pas d'hydrolyse. Le mécanisme de l'hydrolyse du sel consiste en l'interaction de polarisation des ions de sel avec leur enveloppe d'hydratation. Plus cette interaction est forte, plus l'hydrolyse est intense. Tous les cas d'hydrolyse considérés concernaient des sels formés par des bases monoacides et des acides monobasiques. Les sels d'acides polybasiques et de bases polyacides sont hydrolysés par étapes, formant des sels acides et basiques. Quantitativement, l'hydrolyse en tant qu'équilibre de CO est caractérisée par le degré d'hydrolyse et la constante d'hydrolyse. Le degré d'hydrolyse est mesuré par le rapport de la quantité de substance hydrolysée à la quantité totale de soluté. Le degré d'hydrolyse dépend de la nature du sel, de sa concentration et de sa température. Selon la loi d'action de masse, le degré d'hydrolyse augmente avec la dilution de la solution. Ainsi, à une concentration Na2CO3 0,001 mol/l, le degré d'hydrolyse est de 34 %. Dans le cas général, les régularités suivantes sont vraies. 1. L'hydrolyse du sel devrait augmenter avec l'augmentation de la température et de la dilution de la solution. 2. Dans l'hydrolyse réversible, conformément au principe de Le Chatelier, le processus doit être supprimé par acidification (si ce sel est formé par un acide fort et une base faible, les ions H s'accumulent) ou par alcalinisation (si le sel est formé par un acide faible et une base forte, les ions OH s'accumulent). 3. L'hydrolyse des sels, à la suite de laquelle se forment des produits peu solubles ou gazeux, qui sont retirés de la sphère de réaction (principe du déplacement de l'équilibre), est irréversible. Par exemple, l'hydrolyse de Pb(SO4)2 procède entièrement en raison de la formation d'un précipité de PbO2: Pb(ALORS4)2 + 2Н2O→PbO2 + 2H2SO4. L'hydrolyse est caractéristique de nombreuses classes de composés inorganiques et organiques. L'hydrolyse des composés inorganiques est importante pour évaluer leur toxicité. L'hydrolyse des composés organiques est utilisée pour obtenir des produits de valeur à partir du bois, des graisses, des esters et d'autres choses, mais l'hydrolyse joue un rôle particulièrement important dans la vie des organismes vivants. 26. Réaction de précipitation et de dissolution Les réactions d'échange se produisant dans la solution d'électrolyte comprennent les réactions de précipitation et de dissolution. Les réactions de précipitation s'accompagnent de précipitations. Les réactions accompagnées de la dissolution des précipités sont appelées réactions de dissolution. Les systèmes consistant en un dépôt d'un électrolyte peu soluble et d'une solution saturée au-dessus sont largement utilisés. Dans de tels systèmes, un équilibre dynamique s'établit entre la solution saturée et le précipité. En raison de la faible solubilité, la concentration de l'électrolyte peu soluble dans la solution est très faible, on peut donc considérer qu'il est complètement dissocié dans la solution. En d'autres termes, l'équilibre dynamique dans une solution saturée s'établit entre la phase solide de la substance et les ions qui sont passés dans la solution. Par exemple, dans une solution saturée d'AgCl, l'équilibre suivant a lieu : AgCl(T) → Ag+(P) + Cl(R). La concentration de la phase solide AgCl en tant que valeur constante est exclue de l'expression de la constante d'équilibre. En conséquence, la constante d'équilibre est déterminée uniquement par le produit des concentrations d'ions dans la solution et est appelée la constante ou le produit de solubilité. Dans le cas général, pour l'électrolyte Ktn Anm, la constante de solubilité est déterminée par le produit stoechiométrique des concentrations en ions : Кпр= [Ktm+ ]n[Unn]m Cette valeur caractérise la solubilité de l'électrolyte à température constante en l'absence de corps étrangers. Constance Kпр ne signifie pas la constance des concentrations des ions individuels en solution. Ainsi, il est possible d'augmenter la concentration en ions Ag dans une solution saturée d'AgCl en ajoutant, par exemple, AgNO3 , tandis que l'équilibre selon le principe de Le Chatelier se déplacera vers la gauche, ce qui conduira à une augmentation du taux de dépôt d'ions. Après un certain temps, les taux de dissolution d'AgCl et de précipitation des ions Ag et Cl deviendront égaux. L'équilibre nouvellement établi sera, comme précédemment, caractérisé par la valeur Kпр(AgCl), mais les concentrations d'équilibre des ions Ag et Cl changeront. Ainsi, sur la base de Kпр il est possible de prédire la formation et la dissolution des précipités d'électrolyte sur la base de deux règles. 1. Un électrolyte précipite lorsque le produit stoechiométrique des concentrations de ses ions en solution est supérieur à la constante de solubilité. 2. Le précipité d'électrolyte se dissout lorsque le produit stoechiométrique des concentrations de ses ions constitutifs en solution devient inférieur à la constante de solubilité. Les réactions de précipitation constituent la base de la méthode de précipitation utilisée dans l'analyse quantitative des produits pharmaceutiques. La méthode de précipitation est utilisée dans l'analyse clinique des chlorures dans l'urine, le suc gastrique, le sang et dans la pratique sanitaire et hygiénique - dans l'analyse de l'eau potable. Les scientifiques pensent que la grande solubilité des composés naturels des éléments dans l'eau a eu une grande influence sur leur contenu dans les organismes vivants. Il existe une relation étroite entre la solubilité des composés dans l'eau et l'effet toxique des ions d'un certain nombre d'éléments. Par exemple, l'introduction d'Al3 + dans le corps en raison de la formation de phosphate d'aluminium peu soluble AlPO4 27. Réactions redox L'un des concepts de base de la chimie inorganique est le concept d'état d'oxydation (CO). L'état d'oxydation d'un élément dans un composé est la charge formelle de l'atome de l'élément, calculée à partir de l'hypothèse que les électrons de valence passent aux atomes avec une électronégativité relative (REO) plus élevée et que toutes les liaisons de la molécule du composé sont ioniques. L'état d'oxydation de l'élément E est indiqué en haut du symbole de l'élément avec un signe « + » ou « - » avant le chiffre. Le degré d'oxydation des ions qui existent réellement dans une solution ou des cristaux coïncide avec leur numéro de charge et est indiqué de la même manière par le signe "+" ou "-" après le nombre, par exemple Cl.,Californie2+. La méthode Stock est également utilisée pour indiquer le degré d'oxydation en chiffres romains après le symbole de l'élément : Mn (VII), Fe (III). La question du signe de l'état d'oxydation des atomes dans une molécule est résolue sur la base d'une comparaison des électronégativités des atomes interconnectés qui forment la molécule. Dans ce cas, un atome avec une électronégativité inférieure a un état d'oxydation positif et avec une électronégativité plus élevée - un état d'oxydation négatif. Il convient de noter que l’état d’oxydation ne peut être identifié avec la valence d’un élément. La valence, définie comme le nombre de liaisons chimiques par lesquelles un atome donné est connecté à d'autres atomes, ne peut pas être égale à zéro et n'a pas de signe « + » ou « - ». L'état d'oxydation peut avoir une valeur à la fois positive et négative, et peut également prendre une valeur nulle ou même fractionnaire. Ainsi, dans une molécule de CO2 l'état d'oxydation de C est +4, et dans la molécule CH4 l'état d'oxydation de C est 4. La valence du carbone4 a dans les deux composés est IV. Malgré les inconvénients ci-dessus, l'utilisation du concept de degré d'oxydation est pratique dans la classification des composés chimiques et la formulation d'équations pour les réactions redox. Lorsqu'un élément est oxydé, l'état d'oxydation augmente, en d'autres termes, l'agent réducteur au cours de la réaction augmente l'état d'oxydation. Au contraire, lorsque l'élément est réduit, l'état d'oxydation diminue, c'est-à-dire que pendant la réaction, l'agent oxydant réduit l'état d'oxydation. Ainsi, il est possible de donner la formulation suivante des réactions redox : les réactions redox sont des réactions qui se produisent avec un changement de l'état d'oxydation des atomes des éléments qui composent les substances en réaction. 28. Agents oxydants et réducteurs Pour prédire les produits et le sens des réactions redox, il est utile de rappeler que les agents oxydants typiques sont des substances simples dont les atomes ont un EER important > 3,0 (éléments des groupes VIA et VIIA). Parmi ceux-ci, les agents oxydants les plus puissants sont le fluor (OEO = 4,0), l'oxygène (OEO = 3,0), le chlore (OEO = 3,5). Les oxydants importants comprennent le PbO2 , SAVOIR4 , Ca(SO4)2 , À2Cr2O7 , HClO, HClO3, KSIO4, NaBio3H2SO4(fin), H.N.O.3(fin) , N / A2O2 , (NH4)2S2O8 , KSIO3 H2O2 et d'autres substances contenant des atomes de CO supérieurs ou supérieurs. Les agents réducteurs typiques comprennent des substances simples dont les atomes ont un petit EER < 1,5 (métaux des groupes IA et IIA et certains autres métaux). Les agents réducteurs importants comprennent H2S, N.H.3, HI, KI, SnCl2 , FeSO4 ,C,H2 , CO, H2SO3 , cr2(SO4)3 , CuCl, Na2S2O3 et d'autres substances qui contiennent de faibles atomes de CO. Les substances contenant des atomes dans les états d'oxydation maximum et minimum, respectivement, ne peuvent être que des agents oxydants, par exemple, K2sg2O7 , KMPO4 , PbO2 , HClO4 ou uniquement des agents réducteurs, tels que NH3 H2SHI. Les substances contenant des atomes dans des états d'oxydation intermédiaires sont capables à la fois d'élever et d'abaisser l'état d'oxydation, c'est-à-dire qu'elles peuvent être à la fois des agents réducteurs (sous l'action d'un agent oxydant plus actif qu'eux) et des agents oxydants (sous l'action d'un agent plus actif qu'eux, agent réducteur). De telles substances présentent une dualité redox. Lors de l'élaboration des équations des réactions redox, deux méthodes peuvent être utilisées : la méthode de la balance électronique et la méthode ion-électron (méthode de la demi-réaction). Une idée plus correcte des processus redox dans les solutions est donnée par la méthode ion-électron. À l’aide de cette méthode, on prédit les changements que subissent les ions et les molécules réellement présents dans une solution. En plus de prédire les produits de réaction, les équations de demi-réaction ionique sont nécessaires pour comprendre les processus redox se produisant pendant l'électrolyse et dans les cellules galvaniques. Cette méthode reflète le rôle de l'environnement en tant que participant au processus. Et enfin, lors de l'utilisation de cette méthode, il n'est pas nécessaire de connaître à l'avance toutes les substances formées, car nombre d'entre elles sont obtenues en compilant l'équation des réactions redox. Il convient de garder à l'esprit que bien que les demi-réactions reflètent les processus réels se produisant lors des réactions redox, elles ne peuvent pas être identifiées avec les étapes réelles (mécanisme) des réactions redox. De nombreux facteurs influencent la nature et le sens des réactions redox : la nature des réactifs, la réaction du milieu, la concentration, la température, les catalyseurs. Il convient de garder à l'esprit qu'une valeur négative ne conduit pas toujours à une décision sans ambiguïté sur le déroulement réel de la réaction dans une direction donnée, car il est en outre nécessaire de prendre en compte le facteur cinétique. 29. Signification biologique des processus redox Les réactions redox sont des processus chimiques accompagnés du transfert d'électrons d'une molécule ou d'un ion à un autre. Dans les réactions redox, deux processus interdépendants se produisent : l'oxydation et la réduction. L'oxydation est le processus de perte d'électrons. La récupération est le processus d'ajout d'électrons. Les substances dont les atomes ou les ions cèdent des électrons sont appelées agents réducteurs. Les substances dont les atomes ou les ions ajoutent des électrons (ou tirent une paire commune d'électrons vers eux-mêmes) sont appelées agents oxydants. Dans la réaction du zinc avec CuSO4 Cu2 + ajouter des électrons : eux-mêmes2+ + 2e־ -Si0 . Les atomes de zinc donnent des électrons : Zn0 -Zn2 + 2e־. En conséquence, CuSO4 - agent oxydant, Zn - agent réducteur. Les processus importants dans les organismes animaux sont les réactions d'oxydation enzymatique des substances substrats : glucides, graisses, acides aminés. Grâce à ces processus, les organismes reçoivent une grande quantité d’énergie. Environ 90 % des besoins énergétiques totaux d'un homme adulte sont couverts par l'énergie produite dans les tissus lors de l'oxydation des glucides et des graisses. Le reste de l’énergie – environ 10 % – est fourni par la dégradation oxydative des acides aminés. L'oxydation biologique procède par des mécanismes complexes avec la participation d'un grand nombre d'enzymes. Dans les mitochondries, l'oxydation se produit à la suite du transfert d'électrons à partir de substrats organiques. En tant que transporteurs d'électrons, la chaîne respiratoire des mitochondries comprend diverses protéines contenant divers groupes fonctionnels conçus pour transporter des électrons. En se déplaçant le long de la chaîne d'un intermédiaire à un autre, les électrons perdent leur énergie libre. Pour chaque paire d'électrons transférés à travers la chaîne respiratoire à l'oxygène, 3 molécules d'ATP sont synthétisées. L'énergie libre libérée lors du transfert de 2 électrons vers l'oxygène est de 220 kJ/mol. La synthèse d'une molécule d'ATP dans des conditions standard consomme 1 kJ. Il en ressort clairement qu'une partie assez importante de l'énergie libre libérée lors du transfert d'une paire d'électrons est stockée dans les molécules d'ATP. A partir de ces données, le rôle du transfert d'électrons en plusieurs étapes de l'agent réducteur initial à l'oxygène devient également clair. La grande énergie (30,5 kJ) libérée lors du transfert d'une paire d'électrons à l'oxygène est divisée en un certain nombre de portions correspondant aux étapes individuelles de l'oxydation. À trois de ces étapes, la quantité d'énergie libérée correspond approximativement à l'énergie nécessaire à la synthèse d'une molécule d'ATP. Les réactions redox sont à la base des méthodes d'oxydimétrie, qui sont utilisées en analyse clinique pour déterminer les ions Ca, l'acide urique, les enzymes catalase et peroxydase, le sucre dans le sang, et en analyse sanitaire et hygiénique pour déterminer l'oxydabilité de l'eau, la teneur en chlore actif dans l'eau de Javel, le chlore résiduel dans l'eau domestique et l'eau potable. 30. La liaison chimique et ses caractéristiques expérimentales Le développement d'un modèle atomique moderne et la prédiction des propriétés des atomes individuels sur cette base constituent une réalisation très importante de la mécanique quantique. Cependant, les atomes isolés sont rarement trouvés dans des conditions terrestres. Les corps de la nature inanimée et vivante qui nous entoure sont constitués d’une variété de molécules. A. M. Butlerov (1828-1886) a créé la théorie de la structure chimique des substances organiques (1861). Depuis cette époque, les concepts de "valence" et de "liaison chimique" ont progressivement commencé à entrer dans la chimie. La valence est la capacité d'un atome à s'attacher à un certain nombre d'autres atomes pour former une molécule. La valence est indiquée par des tirets à côté du symbole de l'élément. L'hydrogène (H) est monovalent, l'oxygène (0= ) est divalent. Le nombre de lignes de valence détermine le nombre de liaisons chimiques qu'un atome donné peut former avec d'autres atomes. Une liaison chimique est un ensemble d'interactions entre des électrons et des noyaux, conduisant à la combinaison d'atomes en une molécule. Les propriétés d'une liaison chimique sont étudiées par diverses méthodes. À l'aide de méthodes chimiques, le nombre de liaisons d'atomes (valence) et leur réactivité sont déterminés. À l'aide de méthodes physiques, la longueur, la force, l'orientation et la polarité des liaisons chimiques sont déterminées. Longueur de la liaison chimique rс appelée la valeur mesurée par la distance entre les noyaux des atomes liés. En tant qu'unité de longueur de liaison chimique gс picomètre pratique à utiliser (pm) : 1 pm = 1012 m Force de liaison chimique Eс - valeur mesurée par l'enthalpie ΔЕс formation de connexion. En tant qu'unité de force de liaison chimique Eс kJ/mol est utilisé. Orientation de la liaison chimique aс - la valeur mesurée par l'angle entre les directions des liaisons d'un atome donné avec les atomes voisins de la molécule. L'angle ac est appelé angle de valence. Unité d'angle de liaison aс - diplôme. Polarité de la liaison chimique μс - la valeur mesurée par le moment électrique de cette liaison. Le moment électrique pour deux charges électriques +q et ־q, égales en valeur absolue et opposées en signe, est égale à μ = qr, où r est la distance entre les charges. Ces deux charges forment un dipôle électrique. Une liaison chimique se polarise lorsque 2 atomes ayant une électronégativité différente (EEO) se lient. En conséquence, une charge négative en excès δ apparaît sur un atome avec une valeur d'ESR élevée, et une charge positive en excès + δ apparaît sur un autre atome avec une valeur d'ESR plus petite. La polarité de la connexion est calculée à l'aide de la formule : μс = δrс. En tant qu'unité de mesure de la polarité d'une liaison chimique, il est pratique d'utiliser l'unité Debye hors système (D) - 1 D = 3,3 x 1030 C/m. La polarité de la liaison O-H dans la molécule d'eau est μil = 1,5D. L'étude de la liaison chimique a montré que dans la plupart des cas, la longueur, la force, l'orientation, la polarité d'une même liaison chimique dans différents composés ont approximativement les mêmes valeurs. Il s'ensuit donc que les interactions conduisant à la formation d'une liaison donnée entre atomes sont de même nature dans des molécules différentes. Les théories mécaniques quantiques de la liaison chimique fournissent une explication à ce fait. 31. Liaison hydrogène. Liaison hydrogène intermoléculaire et intramoléculaire Les liaisons chimiques dans les molécules sont généralement très fortes, leur énergie est comprise entre 100 et 150 kJ/mol. De plus, il existe des liaisons dites hydrogène, dont la force est de 10 à 40 kJ/mol. La longueur de ces liaisons est de 270-230 pm, respectivement. Liaison hydrogène entre les atomes EА et EВ appelée interaction réalisée par un atome d'hydrogène relié à EА ou EВ liaison chimique. L'image d'une liaison hydrogène dans le cas général a la forme : ЭА-N...Eв.. Évidemment, la liaison hydrogène est à trois centres, puisque 3 atomes participent à sa formation. Pour l'apparition d'une telle liaison, il faut que les atomes EА et EВ ont une électronégativité élevée. Ce sont les atomes des éléments les plus négatifs : azote (REO = 3,0), oxygène (REO = 3,5), fluor (REO = 4,0) et chlore (REO = 3,0). Une liaison hydrogène est formée à la suite d'une combinaison d'hydrogène ls-AO et de deux atomes 2pAO EА et EВ; 2rorbitals sont orientés le long d'une ligne droite. Par conséquent, la liaison hydrogène est linéaire. La liaison hydrogène est appelée : 1) intramoléculaire, si les atomes EА et EВ , reliés par cette liaison, appartiennent à la même molécule ; 2) intermoléculaire, si les atomes EА et EВ sont dans des molécules différentes. Les liaisons hydrogène intramoléculaires jouent un rôle biologique important, puisqu'elles déterminent, par exemple, la structure hélicoïdale des molécules protéiques polymères. Dans les protéines, ce sont des liaisons N-H... O entre les résidus d'acides aminés. Les liaisons hydrogène intermoléculaires sont tout aussi importantes. Avec leur aide, les chaînes d'acides nucléiques sont reliées, formant une double hélice. Il existe deux types de liaisons entre les bases nucléiques : NHN et N-H-O. L'énergie cinétique moyenne du mouvement thermique des molécules est de l'ordre de 3/2RT. A une température du corps humain de 37°C (310°K), cela équivaut à environ 4 kJ/mol. La force des liaisons hydrogène est comprise entre 10 et 40 kJ / mol, elles sont donc suffisamment solides pour résister aux impacts constants des molécules environnantes et assurer la constance de la forme des structures biologiques polymères. Dans le même temps, lors de l'impact des molécules actives, les liaisons hydrogène sont périodiquement rompues, puis restaurées à nouveau, assurant le flux de divers processus vitaux. Les exemples considérés illustrent clairement une gamme d'applications plus large de la méthode MO LCAO que la méthode VS. Néanmoins, la méthode VS peut être utilisée avec succès pour prédire les propriétés et la structure de nombreuses substances, y compris des composés complexes. 32. Macro et microéléments dans l'environnement et dans le corps humain Il existe différentes classifications des éléments chimiques contenus dans le corps humain. Ainsi, V. I. Vernadsky, en fonction de la teneur moyenne (fraction massique w, %) dans les organismes vivants, a divisé les éléments selon le système de dix jours. Selon cette classification, les éléments contenus dans les organismes vivants sont divisés en trois groupes : macro, micro et ultramicroéléments. Macronutriments Ce sont des éléments dont le contenu dans le corps est supérieur à 102%. Ceux-ci comprennent l'oxygène, le carbone, l'hydrogène, l'azote, le phosphore, le soufre, le calcium, le magnésium, le sodium et le chlore. Éléments de traçage Ce sont des éléments dont le contenu dans le corps est de l'ordre de 103 à 105%. Ceux-ci comprennent l'iode, le cuivre, l'arsenic, le fluor, le brome, le strontium, le baryum, le cobalt. Ultramicroéléments Ce sont des éléments dont le contenu dans le corps est inférieur à 105%. Ceux-ci incluent le mercure, l'or, l'uranium, le thorium, le radium, etc. Actuellement, les ultramicroéléments sont combinés avec des microéléments en un seul groupe. Cette classification ne reflète que le contenu des éléments dans les organismes vivants, mais n'indique pas le rôle biologique et la signification physiologique de tel ou tel élément. V. V. Kovalsky, en raison de leur importance pour la vie, a divisé les éléments chimiques en trois groupes. Éléments vitaux (irremplaçables) Ils sont constamment contenus dans le corps humain, font partie des enzymes, des hormones et des vitamines : H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Leur carence entraîne une perturbation de la vie humaine normale. éléments d'impureté Ces éléments sont constamment présents dans le corps des animaux et des humains : Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Leur rôle biologique est peu connu ou méconnu. éléments d'impureté Sc, Tl, In, La, Pr, Sm, W, Re, Tb, etc. Trouvé chez les humains et les animaux. Les données sur le nombre et le rôle biologique n'ont pas encore été clarifiées. Les éléments nécessaires à la construction et à l'activité vitale de diverses cellules et organismes sont appelés éléments biogéniques. Il est encore impossible de répertorier avec précision tous les éléments biogéniques en raison de la difficulté de déterminer de très faibles concentrations d'éléments traces et d'établir leurs fonctions biologiques. Pour 24 éléments, la biogénicité a été établie de manière fiable. Ce sont des éléments du premier et certains éléments du deuxième groupe (selon Kowalski). 33. Topographie des éléments biogéniques les plus importants du corps humain Les organes humains concentrent différemment divers éléments chimiques en eux-mêmes, c'est-à-dire que les micro et macro-éléments sont inégalement répartis entre les différents organes et tissus. La plupart des oligo-éléments s'accumulent dans le foie, les os et les tissus musculaires. Ces tissus sont les principaux dépôts (magasins) de nombreux oligo-éléments. Les éléments peuvent présenter une affinité spécifique pour certains organes et y être contenus en concentrations élevées. Il est bien connu que le zinc est concentré dans le pancréas, l'iode - dans la glande thyroïde, le fluor - dans l'émail des dents, l'aluminium, l'arsenic, le vanadium s'accumulent dans les cheveux et les ongles, le cadmium, le mercure, le molybdène - dans les reins, l'étain - dans le tissus intestinaux, strontium - dans la prostate, tissu osseux, baryum - dans la rétine pigmentée de l'œil, brome, manganèse, chrome - dans l'hypophyse, etc. Dans les organismes, les microéléments peuvent être à l'état lié et sous forme de formes ioniques libres. On sait que le silicium, l'aluminium, le cuivre et le titane présents dans les tissus cérébraux se présentent sous forme de complexes avec des protéines, tandis que le manganèse est sous forme ionique. L'hydrogène et l'oxygène sont des macronutriments. Ils font partie de l'eau qui, dans le corps d'un adulte, en contient en moyenne environ 65 %. L'eau est inégalement répartie dans les organes, tissus et fluides biologiques humains. Ainsi, dans le suc gastrique, la salive, le plasma sanguin, la lymphe, l'eau est de 89,5 à 90 %, dans l'urine, la matière grise du cerveau, les reins - 80 %, dans la substance blanche du cerveau, du foie, de la peau, de la moelle épinière, muscles, poumons, cœur - 70-80%. Le moins de tous - 40% de l'eau - est contenu dans le squelette. Les macronutriments - carbone, hydrogène, oxygène, azote, soufre, phosphore - font partie des protéines, des acides nucléiques et d'autres composés biologiquement actifs du corps. La teneur en carbone des protéines est de 51 à 55 %, l'oxygène de 22 à 24 %, l'azote de 15 à 18 %, l'hydrogène de 6,5 à 7 %, le soufre de 0,3 à 2,5 %, le phosphore d'environ 0,5 %. Le carbone, l'hydrogène et l'oxygène entrent également dans la composition des glucides, dont la teneur dans les tissus animaux est faible - environ 2 %. Ces éléments font partie des lipides (graisses). De plus, la composition des phospholipides comprend du phosphore sous forme de groupes phosphate. Les lipides sont concentrés le plus dans le cerveau (12 %), puis dans le foie (5 %), le lait (2-3 %) et le sérum sanguin (0,6 %). Cependant, l’essentiel du phosphore (600 g) se trouve dans le tissu osseux. Cela représente 85 % de la masse de tout le phosphore du corps humain. Le phosphore est également concentré dans les tissus durs des dents, dans lesquels il est inclus avec le calcium, le chlore, le fluor sous forme d'hydroxyle, le chlore, les fluorapatites de formule générale Ca.5 (PO4)3X, où X = OH, CI, F, respectivement. Le calcium est principalement concentré dans les os ainsi que dans les tissus dentaires. Le sodium et le chlore se trouvent principalement dans les fluides extracellulaires, tandis que le potassium et le magnésium se trouvent dans les fluides intracellulaires. Sous forme de fluorures, le sodium et le potassium font partie des tissus osseux et dentaires. Magnésium sous forme de phosphate de magnésium3 (PO4)2 contenue dans les tissus durs de la dent. Les hormones sont impliquées dans le maintien d'un certain contenu de macro et microéléments dans le corps. 34. Le rôle biologique des éléments chimiques dans le corps Le rôle biologique des éléments chimiques dans le corps humain est extrêmement diversifié. La fonction principale des macronutriments est de construire des tissus, de maintenir une pression osmotique constante, une composition ionique et acido-basique. Les oligo-éléments, faisant partie des enzymes, des hormones, des vitamines, des substances biologiquement actives en tant qu'agents complexants ou activateurs, sont impliqués dans le métabolisme, les processus de reproduction, la respiration des tissus et la neutralisation des substances toxiques. Les oligo-éléments influencent activement les processus d'hématopoïèse, d'oxydation, de réduction, de perméabilité des vaisseaux sanguins et des tissus. Les macro et microéléments - calcium, phosphore, fluor, iode, aluminium, silicium - déterminent la formation des tissus osseux et dentaires. De nombreuses maladies associées à une carence ou à une accumulation excessive de divers microéléments ont été identifiées. Une carence en fluor provoque des caries dentaires, une carence en iode provoque un goitre endémique et un excès de molybdène provoque la goutte endémique. Ces types de schémas sont associés au fait que le corps humain maintient un équilibre de concentrations optimales d’éléments biogéniques – l’homéostasie chimique. La perturbation de cet équilibre due à une carence ou à un excès de l'élément peut entraîner diverses maladies. En plus des six principaux macronutriments - les organogènes (carbone, hydrogène, azote, oxygène, soufre et phosphore), qui composent les glucides, les graisses, les protéines et les acides nucléiques, des macronutriments inorganiques - calcium, chlore, magnésium, potassium, sodium - et des microéléments - le cuivre, le fluor, l'iode, le fer, le molybdène, le zinc, et aussi, éventuellement (cela a été prouvé pour les animaux), - le sélénium, l'arsenic, le chrome, le nickel, le silicium, l'étain, le vanadium. L'analyse du contenu et du rapport des micro-éléments dans le corps humain est également utilisée dans les examens médico-légaux. Par exemple, en cas d'intoxication alcoolique, sous l'influence de l'alcool éthylique, la teneur en calcium du foie augmente et le sodium et le potassium diminuent. Dans le même temps, dans le cœur et les reins, au contraire, la teneur en calcium diminue. Le manque d'éléments tels que le fer, le cuivre, le fluor, le zinc, l'iode, le calcium, le phosphore, le magnésium et certains autres dans l'alimentation entraîne de graves conséquences pour la santé humaine. Cependant, il faut se rappeler que non seulement une carence, mais aussi un excès d'éléments biogènes est nocif pour l'organisme, car cela perturbe l'homéostasie chimique. Les composants minéraux, qui sont vitaux en quantités négligeables, deviennent toxiques à des concentrations plus élevées. Un certain nombre d'éléments (argent, mercure, plomb, cadmium, etc.) sont considérés comme toxiques, car leur entrée dans l'organisme, même à l'état de traces, entraîne des phénomènes pathologiques graves. Divers éléments et leurs composés sont largement utilisés comme médicaments. Ainsi, l'étude du rôle biologique des éléments chimiques, l'élucidation de la relation entre l'échange de ces éléments et d'autres substances biologiquement actives (enzymes, hormones, vitamines) contribue à la création de nouveaux médicaments et au développement de schémas posologiques optimaux pour fins thérapeutiques et prophylactiques. 35. Éléments S et leurs composés L'eau est l'un des composés d'hydrogène les plus importants et les plus répandus sur Terre. L'espace aquatique occupe près de 75 % de la surface du globe. Le corps d'un adulte contient en moyenne 65 à 67 % d'eau, un fœtus (4 mois) - 94 % et un nouveau-né - 74 %. Toutes les réactions chimiques dans le corps ne se produisent que dans le milieu aquatique. La vie sans eau est impossible. L'eau distillée est une préparation de la pharmacopée. Dans la pratique médicale, un autre composé d'hydrogène est utilisé - le peroxyde d'hydrogène H2 02. Ce composé est un sous-produit important du métabolisme. Le peroxyde d'hydrogène est un liquide incolore et transparent. Provoque des brûlures au contact de la peau et des muqueuses. Molécule H2О2 polaire. La présence de paires libres d'électrons au niveau des atomes d'oxygène permet de former des liaisons donneur-accepteur de peroxyde d'hydrogène avec des ligands - accepteurs d'électrons. L'état d'oxydation de l'oxygène dans H2О2 est égal à 1, c'est-à-dire qu'il a une valeur intermédiaire entre l'état d'oxydation de l'oxygène dans l'eau (2) et dans l'oxygène élémentaire O2 . Il en résulte que le peroxyde d'hydrogène peut présenter à la fois les propriétés d'un agent oxydant et les propriétés d'un agent réducteur (dualité redox). Cependant, à en juger par les potentiels de demi-réaction redox standard, le peroxyde d'hydrogène est davantage caractérisé par des propriétés oxydantes. Le peroxyde d'hydrogène pur est thermodynamiquement instable et, au repos, se décompose de manière explosive en eau et en oxygène, libérant une grande quantité de chaleur. Les solutions aqueuses de peroxyde d'hydrogène sont plus stables et peuvent être conservées longtemps dans un endroit frais. Le peroxyde d'hydrogène est généralement vendu sous la forme d'une solution aqueuse à 30 % - perhydrol. Le co-processus de décomposition du peroxyde d'hydrogène est considérablement accéléré en présence de sels de métaux lourds. La décomposition du peroxyde d'hydrogène catalysée par des ions métalliques peut conduire à la formation de radicaux, dont les plus importants sont l'hydroxyde HO et l'hydroperoxyde. La toxicité est due au fait que2О2 et O2 interagissent avec la couche lipidique des membranes cellulaires et les endommagent. Dans la pratique médicale, le peroxyde d'hydrogène est principalement utilisé comme agent bactéricide externe. Geste H2О2 basé sur la capacité oxydante du peroxyde d'hydrogène et l'innocuité de son produit de réduction - l'eau. Lors du traitement des plaies, l'oxygène libéré joue un double rôle : 1) a un effet antimicrobien, désodorisant et dépigmentant, tuant les corps microbiens; 2) forme de la mousse, contribuant à la transition des particules de décomposition tissulaire vers un état en suspension et au nettoyage des plaies. En tant que préparation de pharmacopée, une solution aqueuse à 3% de peroxyde d'hydrogène est utilisée, une solution à 6% de peroxyde d'hydrogène est utilisée pour décolorer les cheveux. Sous forme de solution à 30 %, le peroxyde d'hydrogène est utilisé dans le traitement de la forme verruqueuse du lichen plan et pour éliminer les verrues juvéniles. 36. Le rôle biologique des éléments s du groupe IA (lithium, rubidium, césium, francium) En termes de teneur dans le corps humain, le sodium (0,08 %) et le potassium (0,23 %) sont des macroéléments, et les métaux alcalins restants sont le lithium (104%), rubidium (105%), césium (104%) - aux oligo-éléments. Lithium La teneur en lithium dans le corps humain est d'environ 70 mg (10 mmol) - 104%. Les composés de lithium chez les animaux supérieurs sont concentrés dans le foie, les reins, la rate, les poumons, le sang et le lait. La quantité maximale de lithium se trouve dans les muscles humains. Le rôle biologique du lithium en tant qu'oligo-élément n'est pas encore totalement élucidé. Il a été prouvé qu'au niveau des membranes cellulaires, les ions Li (à une concentration suffisante) entrent en compétition avec les ions sodium lors de la pénétration dans les cellules. De toute évidence, le remplacement des ions Na dans les cellules par des ions Li est associé à une plus grande covalence des composés du lithium, ce qui leur permet de mieux se dissoudre dans les phospholipides. Il a été établi que certains composés de lithium ont un effet positif sur les patients souffrant de dépression maniaco-dépressive. Absorbés par le tractus gastro-intestinal, les ions Li s'accumulent dans le sang. Lorsque la concentration en ions Li atteint 0,6 mmol/l et plus, on observe une diminution de la tension émotionnelle et un affaiblissement de l'excitation maniaque. Dans le même temps, la teneur en ions Li dans le plasma sanguin doit être strictement contrôlée. Dans les cas où la concentration en ions Li dépasse 1,6 mmol/l, des phénomènes négatifs sont possibles. rubidium et césium Selon la teneur en rubidium dans le corps humain (105%) et césium (104%) appartiennent aux oligo-éléments. Ils sont constamment contenus dans l'organisme, mais leur rôle biologique n'est pas encore élucidé. Étant un analogue complet du potassium, le rubidium s'accumule également dans le liquide intracellulaire et peut remplacer une quantité équivalente de potassium dans divers processus. Isotopes radioactifs 13rCs et 87Le Rb est utilisé en radiothérapie des tumeurs malignes, ainsi que dans l'étude du métabolisme du potassium. En raison de leur décomposition rapide, ils peuvent même être introduits dans le corps sans crainte d'effets nocifs à long terme. France Il s'agit d'un élément chimique radioactif obtenu par des moyens artificiels. Il existe des preuves que le francium peut s'accumuler sélectivement dans les tumeurs aux premiers stades de leur développement. Ces observations peuvent être utiles dans le diagnostic du cancer. Ainsi, parmi les éléments du groupe IA, Li, Rb, Cs sont physiologiquement actifs, tandis que Na et K sont vitaux. La proximité des propriétés physico-chimiques du Li et du Na, du fait de la similitude de la structure électronique de leurs atomes, se manifeste également dans l'action biologique des cations (accumulation dans le fluide extracellulaire, interchangeabilité). Une nature similaire de l'action biologique des cations d'éléments de grandes périodes - K+, Rb+, Cs+ (accumulation dans le liquide intracellulaire, interchangeabilité) tient également à la similarité de leur structure électronique et de leurs propriétés physico-chimiques. C'est la base de l'utilisation de préparations de sodium et de potassium en cas d'intoxication aux sels de lithium et de rubidium. 37. Le rôle biologique des éléments s du groupe IA (sodium, potassium) La teneur en sodium dans le corps humain pesant 70 kg est d'environ 60 g (2610 mmol) - 0,08 %. De cette quantité, 44 % du sodium se trouve dans le liquide extracellulaire et 9 % dans le liquide intracellulaire. La quantité restante de sodium se trouve dans le tissu osseux, qui est le site de dépôt d’ions Na dans le corps. Environ 40 % du sodium contenu dans le tissu osseux est impliqué dans les processus métaboliques, et grâce à cela, le squelette est soit un donneur, soit un accepteur d'ions Na, ce qui contribue à maintenir une concentration constante d'ions Na dans le liquide extracellulaire. Le sodium est le principal ion extracellulaire. Dans le corps humain, le sodium se trouve sous forme de sels solubles, principalement du chlorure, du phosphate et de l'hydrogénocarbonate. Le sodium est distribué dans tout le corps : dans le sérum sanguin, le liquide céphalo-rachidien, le liquide oculaire, les sucs digestifs, la bile, les reins, la peau, le tissu osseux, les poumons, le cerveau. Les ions Na jouent un rôle important pour assurer la constance de l'environnement interne du corps humain, participent au maintien d'une pression osmotique constante du biofluide (homéostasie osmotique). Les ions Na sont impliqués dans la régulation du métabolisme de l'eau et affectent le fonctionnement des enzymes. Avec les ions K, Mg, Ca, Cl, l'ion Na participe à la transmission de l'influx nerveux et maintient l'excitabilité normale des cellules musculaires. Lorsque la teneur en sodium du corps change, des dysfonctionnements des systèmes nerveux, cardiovasculaire et autres, des muscles lisses et squelettiques se produisent. Le chlorure de sodium NaCl est la principale source d'acide chlorhydrique pour le suc gastrique. Le sodium pénètre dans le corps humain principalement sous forme de sel de table. Le véritable besoin quotidien du corps en sodium est de 1 g, bien que l'apport moyen de cet élément atteigne 4 à 7 g. Un apport excessif continu de NaCl contribue à l'hypertension. Sous l'influence des alcalis sur les cellules microbiennes, les protéines cellulaires se précipitent et, par conséquent, la mort des micro-organismes. Sulfate de sodium (sel de Glauber) Na2SO4 × 10H2O est utilisé comme laxatif. Tétraborate de sodium Na2B4О7 × 10H2O est utilisé en externe comme antiseptique pour le rinçage, les douches vaginales, la lubrification. L'hydroxyde de sodium sous forme de solution à 10 % fait partie de la siline utilisée en pratique orthopédique pour couler des modèles réfractaires dans la fabrication de prothèses coulées monobloc en alliage cobalt-chrome. La teneur en potassium d'un corps humain pesant 70 kg est d'environ 160 g (4090 0,23 mmol) - 2 %. Le potassium est le principal cation intracellulaire, représentant les 3/XNUMX du nombre total de cations cellulaires actifs. De la quantité totale de potassium contenue dans l’organisme, 98 % se trouve à l’intérieur des cellules et seulement 2 % environ se trouvent dans le liquide extracellulaire. Le potassium est distribué dans tout le corps. Sa topographie : foie, reins, cœur, tissu osseux, muscles, sang, cerveau, etc. Les ions K jouent un rôle important dans les processus physiologiques - contraction musculaire, fonctionnement normal du cœur, conduction de l'influx nerveux, réactions métaboliques. Les ions K sont d’importants activateurs d’enzymes situées à l’intérieur de la cellule. 38. Rôle biologique des éléments s du groupe IIA. Leur utilisation en médecine (béryllium, magnésium, calcium) Le béryllium se trouve dans les plantes ainsi que dans les organismes animaux. La teneur en béryllium dans les organismes vivants est de 107%, c'est-à-dire qu'il s'agit d'un ultramicroélément d'impureté. Le rôle biologique du béryllium n'a pas été suffisamment étudié. Les composés du béryllium sont toxiques et provoquent de nombreuses maladies (rachitisme du béryllium, bérylliose, etc.). Les composés volatils du béryllium sont particulièrement toxiques. L'effet négatif du Be2+ sur les processus physiologiques s'explique par ses propriétés chimiques. Le magnésium est formellement classé parmi les macronutriments. Sa teneur totale dans l'organisme est de 0,027 % (environ 20 g). La topographie du magnésium dans le corps humain est la suivante : le magnésium est concentré en grande partie dans la dentine et l'émail des dents et du tissu osseux. Il s'accumule également dans le pancréas, les muscles squelettiques, les reins, le cerveau, le foie et le cœur. Chez un adulte, les besoins quotidiens en magnésium sont d'environ 0,7 g. L'ion Mg, comme l'ion K, est un cation intracellulaire. Dans les fluides biologiques et les tissus du corps, le magnésium se trouve à la fois sous la forme d'un ion aqua et à l'état lié aux protéines en une quantité < 102%, c'est-à-dire qu'il s'agit essentiellement d'un microélément. La concentration d'ions Mg à l'intérieur des cellules est environ 2,5 à 3 fois plus élevée que dans les fluides extracellulaires. Les ions magnésium jouent un rôle biologique important dans le corps humain. En raison du rayon ionique plus petit et de l'énergie d'ionisation plus élevée de Mg2+ forme des liaisons plus fortes que l’ion Ca et constitue donc un catalyseur plus actif pour les processus enzymatiques. Faisant partie de divers systèmes enzymatiques, l'ion Mg en est le composant essentiel et l'activateur (des enzymes telles que la carboxypeptidase, la cholinestérase et quelques autres sont spécifiques à l'ion Mg). L'hydrolyse de l'ATP, associée à un certain nombre de réactions enzymatiques, à la suite desquelles se forme de l'hydrophosphathione HPO2 et libère une grande quantité d'énergie, se produit avec un excès de Mg2+. Le calcium est un macronutriment. Son contenu total dans le corps est de 1,4%. Le calcium se trouve dans chaque cellule du corps humain. La majeure partie du calcium se trouve dans les tissus osseux et dentaires. En moyenne, un adulte devrait consommer 1 g de calcium par jour, bien que le besoin en calcium ne soit que de 0,5 g.Le calcium administré avec de la nourriture n'est absorbé qu'à 50 % dans les intestins. Une absorption relativement faible est une conséquence de la formation dans le tractus gastro-intestinal de phosphate de calcium Ca peu soluble3(PO4)2 et les sels de calcium d'acides gras. Dans le corps, la concentration des ions Ca est régulée par les hormones. Dans les os et les dents d'un adulte, on trouve environ 1 kg de calcium sous la forme d'un minéral cristallin insoluble - l'hydroxyapatite Ca.10(RO4)6(OH)2 , dont la formation se produit lors de l'interaction des ions Ca avec la phosphatation. Dans le sang et la lymphe, le calcium se trouve à la fois à l'état ionisé et non ionisé - dans des composés contenant des protéines, des glucides, etc. Le mécanisme de coagulation sanguine comprend un certain nombre d'étapes, en fonction de la présence de Ca ionisé. Les ions Ca sont impliqués dans la transmission de l'influx nerveux, la contraction musculaire et la régulation du muscle cardiaque. La concentration d'ions Ca à l'intérieur et à l'extérieur de la cellule, respectivement, est de 106 et (2,25-2,8) 103 mole/l. Étant donné que le calcium n'est pratiquement pas utilisé à l'intérieur de la cellule, il agit comme un matériau de construction dans le corps - dans les os et les dents. Le squelette est la principale réserve de calcium du corps. 39. Rôle biologique des éléments d du groupe VIB. Leur utilisation en médecine Le chrome se trouve dans les organismes végétaux et animaux. Le corps d'un adulte contient environ 6 g de Cr (0,1 %). Le chrome métallique est non toxique, tandis que les composés Cr(III) et Cr(VI) sont dangereux pour la santé. Ils provoquent une irritation de la peau, ce qui conduit à une dermatite. On suppose que les dérivés du chrome (VI) ont des propriétés cancérigènes. 0,25 à 0,3 g de bichromate de potassium provoquent la mort. Les composés de chrome (VI) sont utilisés comme fongicides (agents de décapage, champignon - "champignon", caldere - "kill"). Les composés de chrome (III) ont un effet bénéfique sur la croissance des plantes. Le molybdène appartient aux "métaux de la vie", étant l'un des bioéléments les plus importants. Sa position spéciale a été notée il y a 20-25 ans par F. Krin et L. Oril. Ces scientifiques ont avancé l'idée que l'émergence de la vie sur Terre ne s'est pas produite par évolution, mais qu'elle a été apportée par une civilisation inconnue de l'espace à partir d'étoiles de molybdène, où la vie existait bien avant nous. Dans les processus biochimiques, le molybdène est impliqué dans les états d'oxydation de VI et VI. Dans ces états, il crée des formes oxo stables. Le molybdène forme des complexes oxo stables et, apparemment, il fait donc partie des enzymes qui assurent le transfert des groupements oxo. Mo (VI) prédomine dans le sang ; si le ligand est l'oxygène, des isopolymolybdations stables se forment. Une teneur excessive en molybdène dans les aliments perturbe le métabolisme du Ca2+ et RO4 , provoquant une diminution de la solidité des os - ostéoporose. Il se produit peut-être une liaison aux complexes de phosphomolybdène. De tels complexes peuvent être considérés comme des résidus acides d'acides hétéropolymolybdiques. Avec le calcium, ces résidus forment des cristaux insolubles. Il est possible que ces cristaux déclenchent le dépôt de sels d’acide urique et provoquent la goutte. La goutte déforme les articulations, justifiant sa traduction littérale - « piège à pied ». En plus des complexes d'oxygène, le molybdène forme des complexes d'halogénure (Hal), de thiocyanate (NCS) et de cyanure (CN). Le molybdène est un constituant de diverses enzymes. Dans le corps humain, il s'agit notamment des aldéhydes hydroxydases, des xanthine déshydrogénases et des xanthine oxydases. Le poids moléculaire de la xanthine oxydase (COX) est de 250 000 u.a. e. m. Il s'agit d'une enzyme de mammifères contenant du molybdène. Il peut catalyser l'oxydation de la xanthine et d'autres purines, ainsi que des aldéhydes. La conversion de l'hypoxanthine et de la xanthine en acide urique est catalysée par la xanthine oxydase. On suppose que pendant le processus catalytique, le molybdène forme une liaison avec l'azote et l'oxygène de la xanthine. Le molybdène est le microélément le plus important des plantes, car les substances biologiquement actives avec sa participation assurent une fixation douce de l'azote: elles le convertissent en ammoniac ou en produits contenant de l'azote. Comparé à d'autres métaux industriels importants, le molybdène a une faible toxicité. La consommation de molybdène avec de la nourriture est de 0,1 à 0,3 mg / jour, mais l'apport quotidien requis n'a pas été établi. Une carence en molybdène entraîne une diminution de l'activité de la xanthine oxydase dans les tissus. Une teneur excessive en molybdène provoque l'ostéoporose. Le tungstène est un oligo-élément. Son rôle dans l'organisme n'est pas bien compris. La forme anionique du tungstène est facilement absorbée dans le tractus gastro-intestinal. Le tungstène métallique et ses formes cationiques ne sont pas absorbés par l'organisme. Il n'y a aucune information sur l'homéostasie du tungstène chez les mammifères. 40. Rôle biologique des composés du manganèse. Leur utilisation en médecine Parmi les éléments du groupe VIIB, seul le manganèse est un élément biogène et l'un des dix « métaux de la vie » nécessaires au déroulement normal des processus des organismes vivants. Le corps d'un adulte en contient 12 mg. Le manganèse est concentré dans les os (43%), le reste dans les tissus mous, dont le cerveau. Dans le corps, le manganèse forme des complexes métalliques avec des protéines, des acides nucléiques, de l'ATP, de l'ADP et des acides aminés individuels. Contient des métalloenzymes de manganèse arginase, cholinestérase, phosphoglucomutase, pyruvate carboxylase. La liaison de l'ammoniac - produit toxique de la transformation des acides aminés dans l'organisme des mammifères - s'effectue grâce à l'acide aminé arginine. L'arginase est une enzyme qui catalyse l'hydrolyse de l'arginine dans le foie. En conséquence, l’arginine est décomposée en urée et en ornithine, un acide aminé cyclique. L'urée est une substance non toxique et soluble dans l'eau. Il est transporté par la circulation sanguine vers les reins et excrété dans les urines. Le rayon atomique du manganèse est de 128 pm. Cela explique le fait que le manganèse peut remplacer le magnésium (rayon atomique 160 pm) dans sa combinaison avec l'ATP, affectant de manière significative le transfert d'énergie dans le corps. Les ions Mg et Mn réalisent également l'activation d'enzymes - nucléases. Ces enzymes catalysent l'hydrolyse des acides nucléiques d'ADN et d'ARN dans le duodénum. En conséquence, ces biopolymères sont divisés en unités monomères – les nucléotides. En particulier, une telle nucléase est la désoxyribonucléase, qui catalyse l'hydrolyse de l'ADN uniquement en présence de Mg.2+ ou Mn2+. Le manganèse peut également faire partie de composés inorganiques dans le corps. Il s'agit par exemple d'un pyrophosphate de manganèse magnésium peu soluble MnMgP2O7. Les cristaux de ce sel sont localisés sur la surface interne de la membrane de la vésicule. Presque la même valeur du rayon atomique du manganèse et du fer explique la capacité du manganèse à remplacer le fer dans le complexe porphyrine érythrocytaire. Pour la même raison, le manganèse peut également remplacer le zinc dans les enzymes zinc-dépendantes, modifiant ainsi leurs propriétés catalytiques. Permanganate de potassium KMnO4 - le composé de manganèse le plus célèbre utilisé en médecine. Utiliser des solutions aqueuses contenant du KMnO4 0,01-5 %. Une solution à 5% est utilisée comme agent hémostatique. Les solutions de permanganate de potassium ont des propriétés antiseptiques, qui sont déterminées par son pouvoir oxydant élevé. Parmi les autres composés du manganèse, il convient de noter le sulfate de manganèse (II) et le chlorure de manganèse (II), qui sont utilisés dans le traitement de l'anémie. Il n'existe aucune donnée sur la présence de technétium dans les organismes vivants. Cependant, des composés de technétium avec des bisphosphonates sont utilisés pour la méthode de diagnostic radio-isotopique. 41. Le rôle biologique des composés de fer. Hémoglobine Le fer est un élément biogénique présent dans les tissus des animaux et des plantes. La masse totale de fer dans le corps d'un adulte est d'environ 5 g, soit 0,007 %. Le fer métallique est peu toxique et les composés Fe (II), Fe (III) et Fe (VI) en grande quantité sont dangereux pour la santé. La myoglobine, les cytochromes, la catalase assurent la respiration cellulaire. Toutes ces protéines sont constituées des parties protéiques réelles et des centres actifs qui leur sont associés. Le centre actif est un composé complexe macrocyclique - l'hème. Le composé porphyrine agit comme un ligand macrocyclique. Les atomes d'azote donneurs sont situés aux coins du carré, au centre duquel se trouve l'ion Fe. En général, le complexe a une configuration octaédrique. La cinquième orbitale passant par l’azote de l’acide aminé (histidine) est utilisée pour lier l’hème à la protéine. L'hémoglobine est constituée de 4 molécules protéiques (sous-unités) qui forment un seul agrégat macromoléculaire. Chaque sous-unité a une structure similaire à la molécule de myoglobine. Ainsi, l'hémoglobine peut lier simultanément quatre molécules d'O2 , et myoglobine - 1. Il existe également plusieurs complexes protéiques ne contenant pas de fer héminique dans les tissus. Il s'agit par exemple des enzymes - oxydases, ainsi que des protéines - stockage (dépôt) et transporteurs de fer. L'excès de fer est transporté dans le sang par la protéine transferrine et s'accumule sous forme de protéine ferritine dans divers tissus et organes, notamment dans le foie, la rate et la moelle osseuse. La ferritine est constituée de 24 molécules protéiques (sous-unités) qui forment une sphère d'un diamètre de 12 à 14 nm. Chaque sous-unité contient une cavité de 7 nm de diamètre contenant jusqu'à 4500 atomes de fer. Ainsi, chaque agrégat de ferritine peut stocker environ 100 000 atomes de fer, permettant de nombreuses réactions métaboliques impliquant cet élément. Sur la base des lois de l'équilibre chimique, il n'est pas difficile de comprendre le fonctionnement de l'hémoglobine en tant que transporteur d'oxygène des poumons vers les tissus. L'hémoglobine sans oxygène (désoxyhémoglobine) est un acide faible et sa formule chimique peut être représentée par HHb+. L'apport d'oxygène s'accompagne de l'élimination d'un proton et de l'oxyhémoglobine HbO se forme.2 . Dans ce cas, il existe un équilibre : HHb+ + O2 → HbO2 + N+. Lorsque du sang veineux pauvre en oxygène pénètre dans les poumons, où la pression partielle d'oxygène est élevée (jusqu'à 20 kPa), sa solubilité augmente selon la loi de Henry. Ceci conduit, conformément au principe de Le Chatelier, à un déplacement de l'équilibre vers la droite et à la formation d'oxyhémoglobine. Un déplacement supplémentaire de l'équilibre vers la droite est dû au fait que dans les poumons, la valeur du pH est augmentée (jusqu'à 7,5). En conséquence, dans les poumons, la désoxyhémoglobine est presque complètement (jusqu'à 97%) saturée en oxygène et passe dans l'oxyhémoglobine. Dans les capillaires pénétrant dans les tissus périphériques, la pression partielle d'oxygène diminue à 5 kPa et la valeur du pH à 7,2. En conséquence, l'équilibre se déplace vers la gauche. Dans le sang provenant de la périphérie, l'hémoglobine n'est saturée en oxygène qu'à 65%. 42. Le rôle biologique des composés de fer. CO monoxyde de carbone. Les propriétés complexes métalliques des protéines contenant de l'hème se manifestent sous l'action de substances toxiques telles que le CO (monoxyde de carbone) et le MCN (cyanures - sels d'acide cyanhydrique). Les plus importantes d'un point de vue physiologique sont les protéines contenant du fer : hémoglobine, myoglobine, cytochromes, peroxydases, catalase. L'hémoglobine est le composant principal des globules rouges, assure la respiration externe, étant un transporteur d'oxygène des poumons vers les tissus. Le fer Fe et le cobalt Co sont des oligo-éléments essentiels des organismes vivants. Le monoxyde de carbone CO est l'un des produits de la combustion incomplète du carburant. Des quantités importantes de ce gaz sont émises lors du fonctionnement des chaudières, des moteurs à combustion interne et du fumage. Lorsque le CO est inhalé avec de l'air dans les poumons en parallèle avec l'oxyhémoglobine HbO2 un composé complexe métallique se forme - la carbonylhémoglobine HbCO. La constante de stabilité de HbCO est environ 200 fois supérieure à celle de HbO2 . Par conséquent, même de petites quantités de CO « interceptent » une proportion importante de désoxyhémoglobine, ce qui entraîne une diminution de l'apport d'oxygène aux organes. Des signes d’hypoxie – un manque d’oxygène – apparaissent. Les tissus nerveux sont les premiers touchés. Pour détoxifier (éliminer l'effet toxique) du monoxyde de carbone, il suffit dans de nombreux cas d'arrêter son apport et d'augmenter la ventilation en oxygène - emmener la victime à l'air frais. Dans ce cas, le principe de Le Chatelier fonctionne à nouveau : l’équilibre se déplace vers la formation d’oxyhémoglobine. À des concentrations élevées, le monoxyde de carbone bloque les protéines contenant de l'hème de la respiration cellulaire, et il est difficile d'éviter une issue mortelle. Le mécanisme d'action des cyanures est similaire, mais leur toxicité est supérieure à celle du CO. L'entrée dans le sang de quantités même infimes de ces substances entraîne un arrêt respiratoire et la mort. La forte toxicité des cyanures s'explique par la haute résistance de la liaison Fe-CN-, qui détermine la plus grande stabilité de l'hémoglobine cyanurée. La respiration d'oxygène conduit à la formation de peroxyde d'hydrogène H2O2 . Cette substance a un pouvoir oxydant élevé. Lorsqu'il interagit avec les composés bioorganiques des cellules, des radicaux se forment - des particules moléculaires très actives à valence insaturée - et l'oxydation du peroxyde est initiée. Sous l'action des radicaux, les composants les plus importants de la cellule - les membranes et l'ADN - sont détruits. Au cours de l'évolution biologique, la nature a développé une protéine spéciale : l'enzyme catalase, qui détruit le peroxyde d'hydrogène. Cela limite l’accumulation excessive de cette substance, et évite la destruction de la cellule. L'action de la catalase (CatFe2+ ) peut être représenté comme un cycle catalytique de deux réactions successives : chat2+ + N2O2 - Chat Fé2+ ×H2O2 , chat2+ ×H2O2 + N2O2 → Cat Fe2+ + 2Н2O2 + O2 . En conséquence, 2 molécules de peroxyde d'hydrogène sont détruites et la molécule de biocatalyseur CatFe2+ est libérée et peut entrer dans le cycle catalytique suivant. Ce processus est très rapide. En une seconde, 1 molécule de catalase peut effectuer jusqu'à 20 000 cycles. 43. Le rôle biologique des composés de fer et de cobalt Avec un manque de fer dans le corps, une maladie peut se développer - l'anémie ferriprive (anémie). Il existe un déficit tissulaire en oxygène associé à un manque de fer pour la synthèse de l'hémoglobine. En conséquence, l'apport d'oxygène aux organes périphériques diminue et, par conséquent, le niveau de respiration cellulaire diminue et le métabolisme ralentit. L'introduction de chlorure de fer (II) ou de sulfate de fer (II) comme médicaments réduit la gravité de la maladie. Aux mêmes fins, on utilise une fine poudre de fer métallique (fer réduit, jusqu'à 1 g par dose), facilement soluble dans l'acide chlorhydrique du suc gastrique. Par conséquent, l'action de ce médicament est similaire à celle du chlorure de fer (II). Cependant, les médicaments qui sont des complexes bioinorganiques de fer avec des sucres, du nicotinamide et d'autres substances organiques sont plus efficaces. De tels complexes sont bien absorbés dans le sang, ce qui explique leur efficacité pharmacologique. Il est intéressant de noter que depuis l'Antiquité jusqu'à nos jours, le vin de fer est utilisé pour traiter l'anémie ferriprive - une boisson obtenue en infusant du vin de raisin sur de la limaille de fer. Évidemment, le fer se dissout dans le vin (milieu acide) et forme des complexes avec des substances organiques naturelles, qui y sont contenues en grande quantité. Il est clair que le mécanisme d'action de la boisson ancienne est à peu près le même que celui des médicaments modernes. Comme le fer, le cobalt est également l'un des éléments biogéniques les plus importants. La masse totale de cobalt dans le corps d'un adulte est d'environ 1,2 mg, soit moins de 10 %. Environ 100 mg de cette masse est sous forme de cyanocobalamine (vitamine B liposoluble12 ) et ses analogues. Cette substance, comme l'hème, est un composé complexe macrocyclique. Un composé tétradenté, la porphine, agit comme un ligand macrocyclique. R est un substituant organique complexe. Dans les analogues de la cyanocobalamine, divers substituants organiques agissent à la place de l'anion CN. Le rôle le plus important de la vitamine B12 joue dans le développement et la formation des globules rouges (érythropoïèse). Carence en vitamine B12 (apport inférieur à 3 mcg par jour) entraîne une maladie grave - l'anémie pernicieuse (anémie). Il a été établi que les analogues de la cyanocobalamine sont des activateurs - cofacteurs de diverses enzymes impliquées dans l'érythropoïèse. Le manque de cofacteurs se manifeste par une déficience en hémoglobine et en érythrocytes. Les plantes et les animaux ne peuvent pas synthétiser la vitamine B12. Il n'est produit que par certains types de bactéries. Ces bactéries sont présentes dans le tractus gastro-intestinal humain. Ils synthétisent suffisamment de vitamine B12. L'anémie pernicieuse est associée à une mauvaise absorption de cette vitamine dans le sang. Par conséquent, la prise de pilules est inefficace. Une injection de vitamine (100-200 mcg pendant 2 jours) dans le sang améliore considérablement l'état du patient atteint d'anémie maligne. 44. Le rôle des éléments d du groupe IB. L'utilisation de leurs composés en médecine Le Cuivre Cu est un microélément essentiel des organismes vivants. L'argent Ag et l'or Au sont des oligo-éléments d'impuretés. Leurs composés sont utilisés en médecine. Le cuivre est un élément biogène présent dans les tissus des animaux et des plantes. La masse totale de cuivre dans le corps humain adulte est d'environ 100 mg, soit environ 0,0001 %. Environ 30 % de cette quantité se trouve dans les muscles. Le foie et le cerveau sont également riches en cuivre. Le cuivre métallique et ses composés sont toxiques. Les plus importantes d'un point de vue physiologique sont les protéines contenant du cuivre - la cytochrome oxydase et la superoxyde dismutase. La cytochrome oxydase est l'un des composants de la chaîne respiratoire localisée dans les membranes mitochondriales. Fournit la respiration cellulaire en réduisant l'oxygène en eau à la fin de la chaîne respiratoire. Le corps a besoin de 2,5 à 5,0 mg de cuivre par jour. S'il y a un manque de cuivre dans le corps, une maladie peut se développer - l'anémie par carence en cuivre. Le cuivre est nécessaire à l’absorption du fer, notamment à la synthèse de la cytochrome oxydase, qui contient à la fois du fer et du cuivre. En cas de carence en cuivre, le développement normal des tissus conjonctifs et des vaisseaux sanguins est perturbé. L'empoisonnement est généralement associé à une surdose accidentelle d'insecticides, à l'inhalation de poudre métallique, à l'ingestion de solutions de sel de cuivre. Les boissons stockées dans des récipients en cuivre sans revêtement protecteur des parois présentent un grand danger. En tant qu'agent externe, une solution aqueuse à 0,25% de sulfate de cuivre CuSO est utilisée.4 avec inflammation des muqueuses et conjonctivite. De petites doses de ce médicament peuvent être prises avec de la nourriture pour augmenter l'érythropoïèse dans l'anémie. Argent et or Dans le corps d'un adulte, on trouve environ 1 mg d'argent, soit environ 10 % (1 partie par million), et jusqu'à 10 mg d'or, soit environ 10 % (10 parties par million). Les propriétés antiseptiques des sels d'argent solubles sont connues depuis l'Antiquité. Les prêtres savent depuis longtemps que l'eau ("sainte"), lorsqu'elle est stockée dans des récipients en argent, ne se détériore pas pendant longtemps, c'est-à-dire qu'elle n'est pas sujette à la contamination microbienne. Actuellement, cette propriété de l'eau "argentée" est utilisée par les marins lors de voyages au long cours. De fortes manifestations toxiques chez un adulte sont observées lorsque 7 g d'AgNO sont ingérés.3. En médecine, des médicaments tels que le nitrate d'argent cristallin AgNO03 (lapis) et ses solutions aqueuses sont utilisés depuis longtemps. Les préparations d'argent métallique colloïdal protargol (8% Ag) et collargol (70% Ag) sont connues depuis longtemps, qui sont de fines poudres avec un éclat métallique. Chaque particule de ces poudres est un cristal d'argent métallique réduit de taille inférieure à 1 µm avec une enveloppe protéique d'albumine (protargol) ou de collagène (collargol). La coque protéique protège les cristaux d'argent du collage et assure leur transition dans le milieu aqueux (solubilise). Les préparations d'argent sont utilisées comme agents anti-inflammatoires, antiseptiques et astringents. Les préparations d'or sont également utilisées comme anti-inflammatoires efficaces. Les plus connus sont le krizanol avec une teneur de 30% du métal noble et l'or colloïdal. 45. Rôle biologique des éléments d du groupe IIB. L'utilisation de leurs composés en médecine Le zinc Zn, le cadmium Cd, le mercure Hg sont des oligo-éléments. Le corps d'un adulte contient 1,8 g de Zn, 50 mg de Cd, 13 mg de Hg. Le cadmium et le mercure sont des éléments d'impuretés. Environ 70 % du mercure est concentré dans les tissus adipeux et musculaires. Le cadmium est localisé à 30% dans les reins, le reste dans le foie, les poumons et le pancréas. Le zinc est un élément essentiel pour toutes les plantes et tous les animaux. Dans le corps d'un adulte, l'essentiel du zinc se trouve dans les muscles (65%) et les os (20%). Le reste de la quantité tombe sur le plasma sanguin, le foie, les érythrocytes. La plus forte concentration de zinc dans la prostate. Le zinc ne présente pas de valence variable. Apparemment, par conséquent, ses biocomplexes participent à de nombreuses réactions d'hydrolyse biochimique qui se produisent sans transfert d'électrons. L'ion Zn fait partie de plus de 40 métalloenzymes qui catalysent l'hydrolyse des esters et des protéines. L'un des plus étudiés est le complexe de zinc bioinorganique - l'enzyme anhydrase carbonique (Mg = 30 000), composé d'environ 260 résidus d'acides aminés. Le zinc ne fait pas partie des dipeptidases - enzymes qui catalysent l'hydrolyse des dipeptides (substances constituées de 2 acides aminés). Le zinc forme un complexe bio-organique avec l'insuline, une hormone qui régule la glycémie. Les besoins humains en zinc sont pleinement satisfaits par les produits alimentaires : viande, produits laitiers, œufs. Avec un manque de zinc dans les plantes, le métabolisme des protéines et des glucides est perturbé et la synthèse de la chlorophylle et des vitamines est inhibée. La carence en zinc est éliminée en utilisant des engrais contenant du zinc. La toxicité des composés du groupe IIB augmente du zinc au mercure. Les composés hydrosolubles sont irritants pour la peau et provoquent une intoxication en cas d'ingestion. Les métaux eux-mêmes sont également toxiques - lors de l'inhalation de vapeurs de zinc (air provenant de la production de zinc), une fièvre « métallique » apparaît. Au Moyen Âge, l’empoisonnement aux vapeurs de mercure était appelé la « maladie du chapelier fou ». Les niveaux de mercure dans les aliments (fruits de mer, comme au Japon) conduisent à la maladie des minomata. La toxicité du mercure est associée à l'agglutination (collage) des globules rouges et à l'inhibition des enzymes. Par exemple, le sublimé provoque un changement de taille, une fragilité osmotique et une diminution de la déformabilité des globules rouges, nécessaires à leur déplacement dans les capillaires. La toxicité du cadmium est liée à son affinité pour les acides nucléiques. Du fait de son attachement à l’ADN, son fonctionnement est perturbé. La toxicité chronique du cadmium et du mercure peut altérer la minéralisation osseuse. Des éléments toxiques peuvent remplacer le calcium. Cela conduit à la formation d'apatite avec une structure imparfaite en raison de la distorsion des paramètres du composant cristallin du tissu osseux. En conséquence, la résistance osseuse diminue. 46. Propriétés toxiques des composés du groupe IIB (Zn, Cd, Hg) Les composés Zn, Cd, Hg peuvent provoquer une violation du métabolisme des protéines, qui se manifeste par la libération de protéines plasmatiques par les reins (protéinurie). L'effet toxique des composés du groupe IIB sur l'organisme est également dû au fait que ces ions métalliques interagissent avec les groupes sulfhydryle SH des protéines, des enzymes et des acides aminés. Lorsque les ions métalliques interagissent avec les groupes SH, des composés faiblement dissociés et, en règle générale, insolubles se forment. Par conséquent, le blocage des groupes sulfhydryle conduit à la suppression de l’activité enzymatique et du repliement des protéines. Les ions métalliques divalents bloquent simultanément deux groupes SH. Dans des réactions de ce type, les ions métalliques agissent comme accepteurs et le soufre agit comme donneur d'électrons. L'affinité chimique la plus prononcée pour les groupes SH dans le mercure. Évidemment, cela est dû au fait que les propriétés complexantes du mercure sont plus élevées et qu'il forme des liaisons plus fortes avec le soufre. Les groupes SH font partie de plus de 100 enzymes, dont l'activité peut être supprimée en raison du blocage de ces groupes. Par conséquent, il est évident à quel point il est important de connaître le mécanisme de blocage et les méthodes de traitement pour empoisonner le corps avec des métaux. On sait que les propriétés toxiques des éléments dépendent de la forme chimique sous laquelle ils pénètrent dans l'organisme. Les formes les plus toxiques sont celles qui se dissolvent dans les lipides et pénètrent facilement à travers la membrane dans la cellule. La littérature décrit un cas d'intoxication massive au mercure au Japon. Les composés inorganiques du mercure ont été convertis en méthylmercure sous l'action d'enzymes microbiennes. Le méthylmercure s'est accumulé dans les poissons et est ensuite entré dans le corps humain avec de la nourriture. En se concentrant progressivement, le méthylmercure provoque une destruction irréversible dans l'organisme et la mort. L'utilisation des composés de zinc et de mercure en médecine est basée sur leurs effets astringents, cautérisants et antiseptiques. Comme collyre, une solution aqueuse à 0,25% de sulfate de zinc ZnSO est utilisée.4. En dentisterie, le chlorure de zinc est utilisé pour cautériser les papillomes, pour traiter les muqueuses enflammées. L'oxyde de zinc ZnO est également utilisé. Le chlorure de mercure (II) (chlorure mercurique) est très toxique et ses solutions aqueuses à hautes dilutions (1: 1000) sont utilisées pour la désinfection. Pour le traitement des maladies de la peau et sexuellement transmissibles, des onguents contenant de l'oxyde de mercure (II) HgO et du sulfure de mercure (II) HgS sont utilisés. Le chlorure de mercure(I) (calomel) est peu soluble dans l'eau et donc légèrement toxique. Ce sel est utilisé en médecine vétérinaire comme laxatif. Dans des conditions normales, le mercure est un métal liquide qui peut dissoudre d'autres métaux. Dans ce cas, des alliages durs - des amalgames - se forment. En dentisterie, les amalgames d’argent et de cadmium sont utilisés depuis longtemps pour obturer les dents. Ils sont chimiquement inertes, se ramollissent facilement lorsqu’ils sont chauffés et sont donc faciles à former. Les sources de lumière ultraviolette - lampes au mercure-quartz à usage médical - contiennent du mercure gazeux (vapeur). Lorsqu'ils sont irradiés par la lumière de ces lampes dans les locaux hospitaliers, les micro-organismes contenus dans l'air sont détruits. Diverses maladies de la peau sont traitées à l'aide des rayons ultraviolets. Ainsi, selon la nature du fonctionnement et de l'impact sur le corps, les métaux du groupe IIB peuvent être divisés en élément vital Zn et en éléments d'impuretés toxiques Cd et Hg. 47. Rôle biologique des p-éléments du groupe IIIA. L'utilisation de leurs composés en médecine Le bore est un oligo-élément d'impureté, sa fraction massique dans le corps humain est de 105%. Le bore est concentré principalement dans les poumons (0,34 mg), la glande thyroïde (0,30 mg), la rate (0,26 mg), le foie, le cerveau (0,22 mg), les reins, le muscle cardiaque (0,21 mg). L'effet biologique du bore n'a pas encore été suffisamment étudié. Le bore est connu pour être présent dans les dents et les os, apparemment sous la forme de sels peu solubles d'acide borique avec des cations métalliques. L'excès de bore est nocif pour le corps humain. Il est prouvé qu'un excès de bore inhibe les amylases, les protéinases et réduit l'activité de l'adrénaline. Selon le contenu dans le corps humain (105%), l'aluminium appartient aux microéléments d'impureté. L'aluminium est concentré principalement dans le sérum sanguin, les poumons, le foie, les os, les reins, les ongles, les cheveux, pénètre dans la structure des gaines nerveuses du cerveau humain. L'apport quotidien d'aluminium par un humain est de 47 mg. L'aluminium affecte le développement des tissus épithéliaux et conjonctifs, la régénération du tissu osseux, affecte l'échange de phosphore. L'aluminium a un effet sur les processus enzymatiques. Un excès d'aluminium dans l'organisme inhibe la synthèse de l'hémoglobine, car en raison de sa capacité de complexation assez élevée, l'aluminium bloque les centres actifs des enzymes impliquées dans l'hématopoïèse. Il est prouvé que l'aluminium peut catalyser la réaction de transamination. Le gallium est un oligo-élément d'impureté (le contenu dans le corps humain est de 10-6- 10-5%). Le rôle biologique du gallium dans les organismes vivants n'est presque pas clair. Le thallium est un élément hautement toxique. L'ion T1 a tendance, comme Ag+, à former des composés forts avec des ligands soufrés. En conséquence, il est très toxique, car il inhibe l'activité des enzymes contenant des groupes thio - SH. Même de très petites quantités de composés T1+, lorsqu’elles sont ingérées, provoquent la chute des cheveux. Du fait de la proximité des rayons K+ et T1+ ils ont des propriétés similaires et sont capables de se remplacer dans les enzymes. Les ions T1 et K sont des synergistes. Ceci explique le fait que les enzymes pyruvate kinase et diol déshydratase sont activées non seulement par les ions K, mais également par les ions T1 (l'ion T1 remplace l'ion K dans le centre catalytique des enzymes). La synergie du thallium et du potassium se manifeste également par le fait que, comme les ions K, les ions T1 s'accumulent dans les érythrocytes. Comme antidote à l'empoisonnement aux ions T1, un ligand contenant du soufre, l'acide aminé cystine, est utilisé. En conclusion, il convient de noter que le rôle biologique des éléments p du groupe IIIA n'a pas été suffisamment étudié. On sait maintenant que le bore et le gallium interagissent dans les plantes avec les polyphénols, inhibiteurs de leur développement, réduisant la toxicité de ces derniers. Le rôle incontestable de l'aluminium dans la construction des tissus épithéliaux et conjonctifs et, en outre, sa participation aux processus enzymatiques, à la fois en tant qu'activateur et en tant qu'inhibiteur, a également été établi. L'ion T1 a la capacité d'inhiber de nombreuses enzymes contenant du soufre. L'activité biologique des éléments du groupe IIIA est principalement liée à leur capacité à former des composés complexes avec des ligands contenant de l'oxygène et des phosphates insolubles. 48. Rôle biologique des p-éléments du groupe IVA. L'utilisation de leurs composés en médecine Selon le contenu dans le corps humain (21,15%), le carbone appartient aux macronutriments. Il fait partie de tous les tissus et cellules sous forme de protéines, lipides, glucides, vitamines, hormones. D'un point de vue biologique, le carbone est l'organogène numéro 1. Selon le contenu dans le corps humain (103% ־), le silicium appartient aux micro-éléments d'impureté. La plupart du silicium dans le foie, les glandes surrénales, les cheveux, le cristallin. Étant donné que le dioxyde de silicium naturel est peu soluble dans l'eau, il pénètre dans le corps humain non pas tant par le tube digestif que par l'air à travers les poumons sous forme de SiO poussiéreux.2. Avec une violation du métabolisme du silicium, l'apparition d'hypertension, de rhumatismes, d'ulcères, d'anémie est associée. Dans la pratique médicale, le carbure de silicium (IV) SiC est utilisé - le carborundum pour le meulage des obturations et des prothèses en plastique. Dioxyde de silicium SiO2 partie des ciments de silicate. Il convient de noter que la poussière constituée de particules de charbon, de dioxyde de silicium et d'aluminium, lorsqu'elle est systématiquement exposée aux poumons, provoque une maladie - la pneumoconiose. Lorsqu'il est exposé à la poussière de charbon, c'est l'anthracose, une maladie professionnelle des mineurs. Inhalation de poussières contenant du S1O2 , la silicose se produit, sous l'action de la poussière d'aluminium - aluminose. Selon le contenu dans le corps humain (10-6- 10-5%) le germanium est un microélément. Le rôle biologique n'a pas été entièrement élucidé. Les composés de germanium améliorent les processus d'hématopoïèse dans la moelle osseuse. Il est également connu que les composés de germanium ont une faible toxicité. Selon le contenu dans le corps humain (104 %) l'étain fait référence aux oligo-éléments. L'étain pénètre dans le corps humain avec des aliments acides conservés dans des boîtes de conserve recouvertes d'une couche d'étain. Dans un environnement acide, l'étain se dissout et pénètre dans le sang sous forme de sel, présentant un effet toxique. Cependant, lors d'expériences sur des rats, il a été constaté que l'étain en petites quantités avait un effet stimulant sur la croissance des rats. Cela donne à penser qu'il est nécessaire pour l'homme. Sans aucun doute, l'élucidation du rôle biologique de ce microélément nécessite une étude plus approfondie. Dans la pratique médicale, divers matériaux sont utilisés, en particulier des matériaux de remplissage contenant de l'étain. Ainsi, l'étain fait partie de l'amalgame d'argent (28%) pour la fabrication des obturations. Le plomb et ses composés, notamment organiques, sont très toxiques. Les composés du plomb affectent la synthèse des protéines, l'équilibre énergétique de la cellule et son appareil génétique. De nombreux facteurs plaident en faveur d’un mécanisme de dénaturation. Il a été établi que le plomb fait partie des éléments dont la présence dans les aliments affecte le développement des caries. Avec la nourriture, l'eau et l'air atmosphérique, une personne absorbe quotidiennement jusqu'à 100 microgrammes de plomb. Le plomb se dépose principalement dans le squelette (jusqu'à 90 %) sous forme de phosphate peu soluble. La fraction massique de plomb dans le corps humain est de 106 %־. Un apport quotidien de 0,2 à 2 mg de plomb est considéré comme sans danger pour les humains. Dans la pratique médicale, l'acétate de plomb (lotions) et l'oxyde de plomb (II) PbO (partie du patch de plomb simple) ont trouvé une application comme antiseptiques astringents externes. 49. Rôle biologique des éléments p du groupe VA. L'utilisation de leurs composés en médecine (azote, phosphore) La teneur en azote du corps humain (3,1 %) appartient aux macroéléments. Si l'on prend en compte uniquement la masse de matière sèche du corps (sans eau), alors la teneur en azote dans les cellules est de 8 à 10 %. Cet élément est un composant des acides aminés, des protéines, des vitamines et des hormones. L'azote forme des liaisons polaires avec les atomes d'hydrogène et de carbone dans les biomolécules. Dans de nombreux complexes bioinorganiques (métalloenzymes), les atomes d’azote se lient aux parties inorganiques et organiques de la molécule via un mécanisme donneur-accepteur. Avec l'oxygène et le carbone, l'azote forme des composés vitaux - des acides aminés contenant à la fois un groupe amino aux propriétés basiques et un groupe carboxyle (-COOH) aux propriétés acides. Le groupe amino remplit également une fonction très importante dans les molécules d’acide nucléique. L'importance physiologique des bioligands contenant de l'azote - les porphyrines, comme l'hémoglobine, est énorme. Le cycle de l'azote se déroule dans la biosphère. Le cycle de l'azote est vital pour l'agriculture. Il est nécessaire de noter une autre propriété biologiquement importante de l'azote - sa solubilité dans l'eau est presque la même que celle de l'oxygène. La présence d'un excès d'azote dans le sang peut être à l'origine du développement d'un accident de décompression. Avec la montée rapide des plongeurs, une forte baisse de pression se produit, la solubilité de l'azote dans le sang diminue en conséquence (loi de Henry) et des bulles d'azote élémentaire quittant le sang obstruent les petits vaisseaux, ce qui peut entraîner la paralysie et la mort. Selon la teneur dans le corps humain (0,95 %), le phosphore appartient aux macronutriments. Le phosphore est un élément organogène et joue un rôle extrêmement important dans le métabolisme. Sous forme de phosphate, le phosphore est un composant essentiel de l'ATP intracellulaire. Il fait partie des protéines (0,5-0,6 %), des acides nucléiques, des nucléotides et d'autres composés biologiquement actifs. Le phosphore est à la base du squelette des animaux et des humains (orthophosphate de calcium, hydroxyapatite), des dents (hydroxyapatite, fluorapatite). De nombreuses réactions de biosynthèse sont réalisées en raison du transfert de groupes phosphate d'un accepteur à haute énergie vers un accepteur à basse énergie. Le système de tampon phosphate est l'un des principaux systèmes de tampon dans le sang. Les organismes vivants ne peuvent pas se passer de phosphore. L'importance du phosphore réside dans le fait que les sucres et les acides gras ne peuvent pas être utilisés par les cellules comme sources d'énergie sans phosphorylation préalable. L'échange de phosphore dans le corps est étroitement lié à l'échange de calcium. Ceci est confirmé par une diminution de la quantité de phosphore inorganique avec une augmentation de la teneur en calcium dans le sang (antagonisme). Les besoins humains quotidiens en phosphore sont de 1,3 g. Le phosphore est si répandu dans les produits alimentaires que les cas de carence évidente (manque de phosphate) sont pratiquement inconnus. Cependant, tout le phosphore contenu dans les produits alimentaires ne peut pas être absorbé, car son absorption dépend de nombreux facteurs : le pH, le rapport entre la teneur en calcium et en phosphore des aliments, la présence d'acides gras dans les aliments, mais surtout la teneur en vitamine D. Un certain nombre de composés du phosphore sont utilisés comme médicaments. Il convient de noter que les composés organophosphorés contenant la liaison C-P sont de puissants poisons nerveux et font partie des agents de guerre chimique. 50. Rôle biologique des éléments p du groupe VA (arsenic, antimoine, bismuth). Leur utilisation en médecine Selon le contenu dans le corps humain, l'arsenic appartient aux oligo-éléments. Il se concentre dans le foie, les reins, la rate, les poumons, les os, les cheveux. La majeure partie de l'arsenic se trouve dans les tissus cérébraux et les muscles. L'arsenic s'accumule dans les os et les cheveux et n'en est pas complètement éliminé pendant plusieurs années. Cette fonction est utilisée dans les examens médico-légaux pour clarifier la question de savoir s'il y a eu empoisonnement avec des composés d'arsenic. Le dosage de l'arsenic dans le matériel biologique s'effectue dans un dispositif simple selon la réaction de Marsh : du zinc et de l'acide chlorhydrique sont ajoutés à l'objet biologique. L'hydrogène libéré au cours de la réaction réduit tout composé d'arsenic en arsine. Si l'hydrogène libéré contient un mélange d'arsine, alors AsH se décompose lorsque le mélange gazeux est chauffé3 : 2Ash3 = 2As° + 3H2. et sur les parois du tube de dégagement gazeux, une couche noire brillante d'arsenic se forme - un "miroir d'arsenic". La réaction de Marsh est très sensible et peut détecter 7 à 107 g d'arsenic. A des doses relativement importantes, les composés d'arsenic sont très toxiques. Comme déjà mentionné, l'effet toxique des composés d'arsenic est dû au blocage des groupes sulfhydryle des enzymes et d'autres substances biologiquement actives. Selon leur teneur dans le corps humain (10%), l'antimoine et le bismuth sont des microéléments. Selon la classification de V. V. Kovalsky, l'antimoine et le bismuth appartiennent au groupe de microéléments que l'on trouve constamment dans les organismes vivants, mais dont le rôle physiologique et biochimique n'est pratiquement pas clair. Le rôle physiologique de l'antimoine est évidemment similaire à celui de l'arsenic. Les ions d'arsenic As et d'antimoine Sb et, dans une moindre mesure, de bismuth Bi sont des synergistes. Ainsi, on sait que dans les provinces biogéochimiques avec un excès d'arsenic dans les organismes, la teneur non seulement en arsenic, mais aussi en antimoine augmente. Dans le même temps, les deux éléments s'accumulent dans la glande thyroïde des habitants, inhibent sa fonction et provoquent un goitre endémique. La synergie de l'arsenic et de l'antimoine est associée à leur capacité à former des composés avec des ligands soufrés. Le bismuth est plus enclin à se lier avec des ligands contenant des groupes amino. Ainsi, la pénétration de composés de bismuth solubles dans le corps entraîne une inhibition des enzymes amino et carboxypolypeptidase. L'ingestion de composés d'antimoine solubles dans l'eau, tels que la stibine SbH3, a un effet toxique similaire aux composés d'arsenic. Les composés de bismuth sont également toxiques lorsqu'ils sont injectés. Par exemple, pour les chiens, la dose létale est de 6 mg/kg de poids corporel. Cependant, lorsque la plupart des composés d'antimoine et de bismuth pénètrent dans le tube digestif, ils n'ont pratiquement pas d'effet toxique. La faible toxicité de ces composés est due au fait que les sels de Sb(III), Bi(III) dans le tube digestif subissent une hydrolyse avec formation de produits peu solubles qui ne sont pas absorbés par les parois du tractus gastro-intestinal. C'est la base de l'utilisation de médicaments à base d'antimoine et de bismuth, par exemple le nitrate de bismuth basique. 51. Rôle biologique des p-éléments du groupe VIA. L'utilisation de leurs composés en médecine Selon le contenu dans le corps humain (62%), l'oxygène appartient aux macronutriments. Il est indispensable et est l'un des éléments les plus importants qui forment la base des systèmes vivants, c'est-à-dire qu'il s'agit d'un organogène. L'oxygène fait partie d'un grand nombre de molécules, allant des plus simples aux biopolymères. Le rôle de l'oxygène dans les processus vitaux est important, car l'oxydation des nutriments (glucides, protéines, graisses) avec l'oxygène sert de source d'énergie nécessaire au fonctionnement des organes et des tissus des organismes vivants. La plupart des réactions redox dans le corps se déroulent avec la participation de l'oxygène et de ses formes actives. Les fonctions phagocytaires (protectrices) du corps sont également associées à la présence d'oxygène, et une diminution de la teneur en oxygène dans le corps diminue ses propriétés protectrices. Dans les phagocytes (cellules capables de capter et de digérer les corps étrangers), l'oxygène 02 est réduit en superoxyde. Dans la pratique médicale, l'oxygène est utilisé pour l'inhalation dans des conditions douloureuses accompagnées d'un manque d'oxygène (hypoxie), de maladies des voies respiratoires, du système cardiovasculaire, d'empoisonnement au monoxyde de carbone (II) CO, d'acide cyanhydrique HCN, ainsi que de maladies avec des fonctions respiratoires altérées . L'oxygénation hyperbare est largement utilisée dans la pratique clinique - l'utilisation d'oxygène sous haute pression. La modification allotropique de l'oxygène - ozone O3 en tant qu'agent oxydant très puissant est utilisée pour la désinfection des locaux, la désinfection de l'air et la purification de l'eau potable. En termes de teneur dans le corps humain (0,16 %), le soufre est classé parmi les macronutriments. Comme l’oxygène, il est vital. Les besoins quotidiens d'un adulte en soufre sont d'environ 4 à 5 g. Le soufre fait partie de nombreuses biomolécules - protéines, acides aminés (cystine, cystéine, méthionine, etc.), hormones (insuline), vitamines (vitamine B1). Le carotène contenu dans les cheveux, les os et les tissus nerveux contient beaucoup de soufre. Dans les organismes vivants, le soufre, qui fait partie des acides aminés, est oxydé. Les produits finaux de ce procédé sont principalement des sulfates. De plus, des thiosulfates, du soufre de ciment et des acides polythioniques se forment. Selon le contenu dans le corps (10-5- 10-7%) le sélénium est un microélément. Certains chercheurs le considèrent comme un élément vital. Le sélénium provient de la nourriture - 55-110 mg par an. Le sélénium est principalement concentré dans le foie et les reins. La concentration de sélénium dans le sang est de 0,001 à 0,004 mmol / l. Le lien entre le sélénium et le soufre dans les organismes vivants est incontestable. À fortes doses, le sélénium s'accumule principalement dans les ongles et les cheveux, qui sont à base d'acides aminés soufrés. La capacité du sélénium à protéger l'organisme contre l'empoisonnement au mercure Hg et au cadmium Cd est également connue. Le sélénium favorise la liaison de ces métaux toxiques à d'autres centres actifs, à ceux qui ne sont pas affectés par leur effet toxique. Un fait intéressant est la relation entre une teneur élevée en sélénium dans l'alimentation et une faible mortalité par cancer. Le sélénium est toxique à fortes doses. La dégradation des composés de sélénium chez les animaux entraîne la libération de diméthylsélénium hautement toxique, qui a une odeur d'ail. 52. Rôle biologique des p-éléments du groupe VIIA. L'utilisation de leurs composés en médecine (fluor et chlore) En termes de teneur dans le corps humain, le chlore (0,15 %) appartient aux macroéléments, tandis que les éléments restants de ce groupe sont des microéléments (teneur - 105 %). Les halogènes sous forme de divers composés font partie des tissus humains et animaux. Le chlore et l'iode sont des éléments irremplaçables, tandis que les autres sont des constituants permanents des tissus. La masse de fluor dans le corps humain est d'environ 7 mg (~105 %). Les composés fluorés sont concentrés dans le tissu osseux, les ongles, les dents. La composition des dents comprend environ 0,01% de fluor, et la plus grande partie tombe sur l'émail, qui est associé à la présence de fluorapatite peu soluble dans celui-ci. Le manque de fluorure dans le corps entraîne des caries dentaires. L'intérêt pour l'action biologique du fluor est principalement lié au problème des maladies dentaires, car le fluor protège les dents des caries. La base minérale des tissus dentaires (dentine) est l'hydroxyapatite, la chlorapatite et la fluorapatite. Très souvent, ce n'est pas la surface externe de la dent, recouverte d'une couche d'émail, qui est détruite, mais les parties internes de la dentine, exposées lorsque l'émail est endommagé. Il y a des suggestions que même si l'émail est légèrement endommagé, l'introduction de fluorure de sodium favorise la formation de fluorapatite, facilitant la reminéralisation des dommages qui ont commencé. Le fluorure de sodium NaF est utilisé dans la pratique médicale comme agent externe topique. L'utilisation de NaF est basée sur la formation de fluorapatite. Dans le même temps, l'alcalinisation de l'environnement de la cavité buccale se produit également, ce qui contribue à la neutralisation des acides produits par les bactéries. Non seulement un manque, mais aussi un excès de fluor est nocif. Lorsque la teneur en fluor de l'eau potable dépasse le taux maximum autorisé (1,2 mg/l), l'émail des dents devient cassant, se détruit facilement et d'autres symptômes d'intoxication chronique au fluor apparaissent - fragilité osseuse accrue, déformations osseuses et épuisement général du corps. . La maladie qui survient dans ce cas est appelée fluorose (fluorose). Le corps humain contient environ 100 g (2790 mmol) de chlore. Les chlorures jouent un rôle biologique important. Ils activent certaines enzymes, créent un environnement favorable à l'action des enzymes protolytiques du suc gastrique, fournissent des flux ioniques à travers les membranes cellulaires et participent au maintien de l'équilibre osmotique. Le chlorure d'ion a un rayon optimal de pénétration à travers la membrane cellulaire. Ceci explique sa participation conjointe avec les ions Na et K à la création d'une certaine pression osmotique et à la régulation du métabolisme eau-sel. Les besoins quotidiens en chlorure de sodium sont de 5 à 10 g.Comme déjà indiqué, le NaCl est nécessaire à la production d'acide chlorhydrique dans l'estomac. Outre le rôle important de l'acide chlorhydrique dans le processus de digestion, il détruit diverses bactéries pathogènes (choléra, typhoïde). Si les bactéries pénètrent dans l'estomac avec une grande quantité d'eau, alors en raison de la dilution de HCl, cela n'a pas d'effet antibactérien et les bactéries survivent. Cela conduit à la maladie dans le corps. Par conséquent, lors d'épidémies, l'eau brute est particulièrement dangereuse. Avec une quantité insuffisante d'acide chlorhydrique dans l'estomac, le pH augmente et la digestion normale est perturbée, ce qui affecte gravement la santé humaine. Avec une acidité réduite du suc gastrique, une solution diluée d'acide chlorhydrique est utilisée dans la pratique médicale. Avec l'inflammation de l'estomac (gastrite), l'ulcère peptique, la sécrétion du suc gastrique augmente, son acidité augmente. 53. Rôle biologique des p-éléments du groupe VIIA. L'utilisation de leurs composés en médecine (brome, iode) La masse de brome dans le corps humain est d'environ 7 mg. Il est localisé principalement dans les glandes endocrines, principalement dans l'hypophyse. Le rôle biologique des composés bromés dans le fonctionnement normal de l'organisme n'est pas encore suffisamment élucidé. Les composés de brome inhibent la fonction de la glande thyroïde et augmentent l'activité du cortex surrénalien. Lorsque les bromidions sont introduits dans le corps, le système nerveux central est le plus sensible. Les bromidions s'accumulent uniformément dans diverses parties du cerveau et agissent de manière apaisante avec une excitabilité accrue. Ils contribuent au rétablissement de l'équilibre perturbé entre les processus d'excitation et d'inhibition. Les bromidions sont facilement absorbés dans le tractus gastro-intestinal. La toxicité des bromidions est faible. En raison de la lente excrétion du corps (dans les 30 à 60 jours), ils peuvent s'accumuler (se cumuler), ce qui conduit au développement d'un empoisonnement chronique, appelé bromisme. Si des signes d'empoisonnement chronique au brome apparaissent, les préparations de bromure doivent être immédiatement interrompues. De plus, une grande quantité de chlorure de sodium est administrée (jusqu'à 25 g par jour) pour augmenter la vitesse de libération des bromidions (principe de Le Chatelier), et une boisson abondante est prescrite. En raison de sensibilités individuelles différentes, le dosage des préparations de brome varie de 0,05 à 2,0 g. L'iode est l'un des éléments biogènes essentiels et ses composés jouent un rôle important dans les processus métaboliques. L'iode affecte la synthèse de certaines protéines, graisses et hormones. Le corps humain contient environ 25 mg d'iode. De la quantité totale d’iode présente dans l’organisme, plus de la moitié se trouve dans la glande thyroïde. Presque tout l’iode contenu dans cette glande est à l’état lié (sous forme d’hormones) et seulement 1 % environ est sous forme d’iodidione. La glande thyroïde est capable de concentrer l'I-25 fois - par rapport à son contenu dans le plasma. La glande thyroïde sécrète les hormones thyroxine et triiodothyronine. Une glande thyroïde sous-active (hypothyroïdie) peut être associée à une diminution de sa capacité à accumuler des ions iodure, ainsi qu'à un manque d'iode dans l'alimentation (goitre endémique). En cas de goitre endémique, des préparations iodées sont prescrites : (iodure de potassium KI ou iodure de sodium NaI) à des doses correspondant aux besoins humains quotidiens en iode (0,001 g d'iodure de potassium). Dans les régions où il y a une carence en iode, NaI ou K est ajouté au sel de table pour prévenir le goitre endémique ! (1-2,5 g pour 100 kg). Avec une activité accrue de la glande thyroïde (hyperthyroïdie), due à une synthèse excessive d'hormones thyroïdiennes, un taux anormalement élevé de processus métaboliques est observé. Avec l'inefficacité de ces médicaments pour le traitement de l'hyperthyroïdie, une préparation d'iode radioactif 131 I est utilisée, dont le rayonnement détruit les follicules de la glande thyroïde et réduit ainsi la synthèse excessive d'hormones. Tous les éléments du groupe VIIA sont physiologiquement actifs, et le chlore et l'iode sont indispensables à l'activité vitale de l'organisme. Le fluor est considéré comme un élément nécessaire au fonctionnement normal des organismes vivants. Dans le corps, les halogènes sont interchangeables, des cas de synergie et d'antagonisme étant observés. 54. Aérosols Les aérosols sont des systèmes dispersés avec un milieu de dispersion gazeux. Selon l'état d'agrégation de la phase dispersée, on distingue les brouillards - aérosols à phase dispersée liquide ; fumée, poussière - aérosols avec une phase solide dispersée ; smog - aérosols avec une phase dispersée mixte. La taille des particules de la phase dispersée des aérosols, conformément à la classification des systèmes dispersés, varie de 107 à 109 m Comme les autres systèmes dispersés, les aérosols sont obtenus par deux méthodes : la condensation et la dispersion. méthode de condensation La phase dispersée est obtenue à partir de la phase vapeur par le processus physique de condensation de molécules en particules de taille colloïdale. Méthodes de dispersion Des particules de tailles colloïdales sont obtenues en broyant des agrégats plus gros. Les aérosols ont la capacité de diffuser la lumière. Les particules de la phase dispersée des aérosols ne possèdent pas de double couche électrique, mais les particules de la phase dispersée portent très souvent une charge électrique. La charge résulte du frottement ou de l'adsorption d'ions gazeux. Il convient de noter que très souvent les particules d'aérosol (petites et grosses) portent une charge de signe opposé. La séparation des particules par taille dans de grands volumes d'aérosols en hauteur peut conduire à l'apparition d'un champ électrique de forte intensité. Ainsi, une décharge électrique se produit dans les nuages : la foudre. Les aérosols sont des systèmes cinétiquement et aggrégativement instables, car il n'y a pas de double couche électrique à la frontière de phase. Par conséquent, les aérosols coagulent plus rapidement que les lyosols. En médecine, les aérosols sont utilisés en thérapie par inhalation, pour protéger la peau endommagée, la désinfection. Parfois, la formation d’aérosols est hautement indésirable. Des aérosols dangereux pour la santé humaine se forment dans les fonderies, les industries céramiques, lors de l'extraction et du traitement de divers minéraux (minerai, charbon, amiante, etc.). Les aérosols contenant des particules de charbon provoquent des maladies pulmonaires - anthracose, oxyde de silicium (IV) - silicose, amiante - asbestose. Les maladies allergiques sont provoquées par des aérosols formés par le pollen des plantes, les poussières générées lors de la transformation du coton, du lin, du chanvre, etc. Les suspensions de bactéries, moisissures et virus - aérosols microbiologiques ou bactériens - sont un des modes de transmission des maladies infectieuses : tuberculose pulmonaire , grippe, maladies respiratoires aiguës. Les effets nocifs sur le corps humain sont produits par les aérosols formés lors de la combustion de carburant, dont la phase dispersée est constituée de suie, de goudron, de cendres et d'hydrocarbures cancérigènes. Les smogs sont particulièrement dangereux pour la santé. C’est pourquoi la lutte contre la poussière et la pollution de l’atmosphère devient de plus en plus importante. La purification de l'air des aérosols est obtenue en introduisant des technologies sans déchets : piégeant les particules de la phase dispersée à l'aide de filtres, de cyclones (dépoussiéreurs centrifuges) et d'un champ électrique à haute tension. 55. Émulsions Les émulsions sont des systèmes microhétérogènes dans lesquels la phase dispersée et le milieu de dispersion sont des liquides non miscibles. La taille des particules de la phase dispersée - les gouttelettes liquides - varie de 104 à 106 µm. Selon la concentration de la phase dispersée, on distingue les émulsions : diluées, concentrées et très concentrées. Selon la nature de la phase dispersée et du milieu de dispersion, on distingue : 1) émulsions d'un liquide non polaire (DF) dans un liquide polaire (DS) - émulsions directes, dites émulsions de première espèce ou émulsions de type « huile/eau » (H/E) ; 2) les émulsions d'un liquide polaire (DF) dans un liquide non polaire (DS) - les émulsions inverses, dites émulsions de deuxième espèce ou émulsions de type « eau/huile » (E/H). Ici, DF et DS sont respectivement la phase dispersée et le milieu de dispersion, « l'eau » est n'importe quel liquide polaire, « l'huile » est non polaire. Le type d'émulsion peut être défini : 1) mesure de la conductivité électrique ; 2) mélange avec un excès d'un liquide polaire ou non polaire ; 3) coloration avec des colorants solubles dans l'eau ou dans l'huile ; 4) par mouillage et étalement d'une goutte d'émulsion sur une surface hydrophobe ou hydrophile. Les émulsions, comme les autres systèmes dispersés, peuvent être obtenu par des méthodes de condensation et de dispersion. Les émulsions en tant que dispersions grossières sont des systèmes cinétiquement et aggrégativement instables. Lorsque les gouttelettes de la phase dispersée entrent en collision, elles fusionnent (coalescence). Par coalescence, l'émulsion se sépare en deux phases liquides continues. Les émulsifiants sont utilisés pour augmenter la stabilité des émulsions. Ce sont des tensioactifs qui, suite à l'adsorption à l'interface, réduisent la tension interfaciale et forment un film d'adsorption mécaniquement résistant. Si l'émulsifiant est un tensioactif ionique, alors il confère une charge électrique du même signe aux gouttelettes de la phase dispersée, et les gouttelettes se repoussent. Le type d'émulsion formée dépend des propriétés de l'émulsifiant. Le milieu de dispersion est toujours le liquide qui dissout ou mouille le mieux l'émulsifiant. Les sels d'acides gras supérieurs, les esters d'acides gras supérieurs et les alcools polyhydriques, les amines à longue chaîne sont utilisés comme émulsifiants. Les émulsions sont largement présentes dans la nature. Les émulsions sont le lait, la crème, la crème sure, le beurre, le jaune d'œuf, le jus de plante laiteuse, le pétrole brut. Les émulsions contenant des substances médicamenteuses sont largement utilisées en médecine : le premier type (H/E) à usage interne, le deuxième type (E/H) à usage externe. On sait que les graisses végétales et animales sont mieux absorbées par l'organisme sous une forme émulsionnée (lait). Dans ce cas, les dérivés des acides cholique et désoxycholique agissent comme émulsifiants. Parfois, il est nécessaire de détruire l'émulsion résultante. La rupture de l'émulsion est appelée désémulsification. La désémulsification est réalisée par augmentation et diminution de la température, exposition à un champ électrique, centrifugation, ajout d'électrolytes et de substances spéciales - désémulsifiants. Les désémulsifiants sont des tensioactifs ayant une activité de surface supérieure à celle des émulsifiants, mais n'ont pas la capacité de former une couche d'adsorption mécaniquement résistante. 56. Tensioactifs colloïdaux Les tensioactifs colloïdaux sont des substances qui, avec le même solvant, selon les conditions, forment une solution vraie et colloïdale. Comme déjà mentionné, les molécules tensioactives sont amphiphiles. Ils sont constitués de groupes non polaires et polaires. Les radicaux non polaires, par exemple les chaînes hydrocarbonées, n'ont aucune affinité pour le solvant polaire - l'eau, pour les groupes polaires, elle est assez élevée. Il existe une interaction hydrophobe (van der Waals) entre les groupes non polaires. Avec une longueur de chaîne d'environ 1022 atomes de carbone en raison des interactions hydrophobes des radicaux hydrocarbonés et de la forte interaction des groupes polaires avec l'eau, des molécules de tensioactif sont associées et des micelles se forment. La concentration minimale d'un tensioactif colloïdal, à partir de laquelle des micelles se forment dans sa solution, est appelée concentration micellaire critique (CMC). La forme des micelles résultantes dépend de la concentration de la solution. A de faibles concentrations de tensioactif colloïdal, des micelles sphériques se forment. Une augmentation de la concentration d'une solution de tensioactif colloïdal entraîne d'abord une augmentation de leur nombre, puis un changement de forme. À des concentrations plus élevées, au lieu de micelles sphériques, des micelles cylindriques et lamellaires se forment. La valeur de la CMC dépend de divers facteurs : la nature du tensioactif colloïdal, la température et la présence d'impuretés de substances étrangères, notamment d'électrolytes. La CMC peut être déterminée par les propriétés de la solution, en fonction du nombre et de la taille des particules cinétiquement actives, notamment par les changements de pression osmotique, de tension superficielle, de conductivité électrique et de caractéristiques optiques. Puisque lors de la transition « solution vraie - solution colloïdale » la taille des particules cinétiquement actives (ions, molécules, micelles) et leur nombre changent, un point d'inflexion correspondant à la CMC apparaît sur le graphique « propriété - concentration ». L'une des propriétés les plus importantes des solutions de tensioactifs colloïdaux, grâce auxquelles elles sont largement utilisées dans divers secteurs de l'économie nationale et en médecine, est la solubilisation. Le mécanisme de solubilisation consiste en la dissolution de substances non polaires dans le noyau hydrophobe des micelles. Le phénomène de solubilisation est largement utilisé dans divers secteurs de l'économie nationale : dans l'industrie alimentaire, dans l'industrie pharmaceutique (pour l'obtention de formes liquides de substances médicinales). Dans le système eau-phospholipide, l'agitation et l'agitation forment des micelles sphériques - des liposomes. Les molécules de phospholipides forment une membrane bicouche dans les liposomes, dans laquelle les groupes polaires font face à l'eau et les groupes non polaires se font face. Les liposomes peuvent être considérés comme un modèle de membranes biologiques. Avec leur aide, il est possible d'étudier la perméabilité des membranes et l'influence de divers facteurs sur celle-ci pour divers composés. Les liposomes sont largement utilisés pour l'administration ciblée de médicaments à certains organes ou zones affectées. Les liposomes peuvent transporter des médicaments dans les cellules. Les membranes liposomales sont utilisées dans les études immunologiques pour étudier l'interaction entre les anticorps et les antigènes. Auteurs : Drozdova M.V., Drozdov
▪ Psychologie générale. Notes de lecture ▪ Droit du travail de la Fédération de Russie. Lit de bébé ▪ Argent. Le crédit. Banques. Notes de lecture
Cuir artificiel pour émulation tactile
15.04.2024 Litière pour chat Petgugu Global
15.04.2024 L’attractivité des hommes attentionnés
14.04.2024
▪ section du site Manuel de l'électricien. Sélection d'articles ▪ article Étudier, étudier et étudier. Expression populaire ▪ article Embout buccal et cigarette. Concentrer le secret
Page principale | bibliothèque | Articles | Plan du site | Avis sur le site www.diagramme.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Voir d'autres articles section
Voir d'autres articles section 