
|
Notes de cours, aide-mémoire
Thérapie hospitalière. Notes de cours : brièvement, le plus important
Annuaire / Notes de cours, aide-mémoire table des matières
CONFÉRENCE N ° 1. Maladies du système cardiovasculaire. Rhumatisme Rheumatism (maladie de Sokolsky-Buyo) est une maladie inflammatoire systémique du tissu conjonctif avec une localisation prédominante du processus dans le système cardiovasculaire, qui se développe chez les personnes prédisposées (en règle générale, ce sont des jeunes) en raison d'une infection aiguë par streptocoque β-hémolytique du groupe A. Cette définition de la maladie a été donnée en 1989 par V. A. Nasonov. Il reflète tous les traits caractéristiques de la maladie: 1) dommages prédominants au système cardiovasculaire; 2) le rôle de l'hérédité pathologique ; 3) l'importance de l'infection streptococcique. L'essence de la maladie réside dans la défaite de toutes les membranes du cœur, mais principalement du myocarde et de l'endocarde avec l'apparition d'une déformation de l'appareil valvulaire - une maladie cardiaque et le développement ultérieur d'une insuffisance cardiaque. La défaite d'autres organes et systèmes dans le rhumatisme est d'importance secondaire et ne détermine pas sa gravité et son pronostic ultérieur. Étiologie. Les streptocoques bêta-hémolytiques du groupe A provoquent des lésions des voies respiratoires supérieures. C'est pourquoi l'apparition des rhumatismes est généralement précédée d'un mal de gorge, d'une exacerbation de l'amygdalite chronique et d'une quantité accrue d'antigène streptococcique et d'anticorps anti-streptococciques (ASL-O, ASG, ASA, antidésoxyribonucléase B (anti -DNase B)) sont détectés dans le sang des malades. Un tel lien avec une infection streptococcique antérieure est particulièrement prononcé dans l'évolution aiguë du rhumatisme, accompagné de polyarthrite. Dans le développement des rhumatismes, l'âge et les facteurs sociaux (conditions de vie défavorables, malnutrition) jouent un rôle, et la prédisposition génétique compte également (le rhumatisme est une maladie héréditaire polygénique, l'existence de familles "rhumatismales" est bien connue), qui consiste en une réponse hyperimmune aux antigènes de streptocoque, la propension des patients aux processus auto-immuns et immunocomplexes. pathogénèse. Avec les rhumatismes, une réponse immunitaire complexe et diversifiée se produit (réactions d'hypersensibilité immédiate et retardée) à de nombreux antigènes streptococciques. Lorsqu'une infection pénètre dans l'organisme, des anticorps anti-streptococciques sont produits et des complexes immuns se forment (antigènes streptococciques + anticorps dirigés contre eux + complément), qui circulent dans le sang et se déposent dans le lit microcirculatoire. Les toxines et enzymes streptococciques ont également un effet néfaste sur le myocarde et le tissu conjonctif. En raison d'un défaut génétiquement déterminé du système immunitaire, les antigènes streptococciques et les complexes immuns ne sont pas complètement et rapidement éliminés du corps des patients. Les tissus de ces patients ont une tendance accrue à fixer ces complexes immuns. Les anticorps à réaction croisée jouent également un rôle ici, qui, étant formés sur les antigènes streptococciques, sont capables de réagir avec les antigènes tissulaires, y compris cardiaques, du corps. En réponse, l'inflammation se développe sur une base immunitaire (selon le type d'hypersensibilité immédiate), tandis que les facteurs qui mettent en œuvre le processus inflammatoire sont les enzymes lysosomales des neutrophiles qui phagocytent les complexes immuns et sont détruits en même temps. Ce processus inflammatoire est localisé dans le tissu conjonctif, principalement du système cardiovasculaire, et modifie les propriétés antigéniques de celui-ci et du myocarde. En conséquence, des processus auto-immuns se développent en fonction du type d'hypersensibilité de type retardé et des lymphocytes réagissant avec le tissu cardiaque se retrouvent dans le sang des patients. Ces cellules sont d'une grande importance dans l'origine des lésions organiques (principalement le cœur). Dans le tissu conjonctif avec rhumatismes, des changements de phase se produisent: gonflement mucoïde - changements fibrinoïdes - nécrose fibrinoïde. L'expression morphologique des troubles immunitaires sont des réactions cellulaires - infiltration par des lymphocytes et des plasmocytes, formation de granulome rhumatismal ou Ashoff-Talalayevsky. Le processus pathologique se termine par la sclérose. Un autre substrat morphologique des lésions cardiaques dans les cardiopathies rhumatismales est une réaction inflammatoire non spécifique similaire à celle des articulations et des séreuses : gonflement du tissu conjonctif intermusculaire, transpiration de fibrine, infiltration par des neutrophiles et des lymphocytes. La maladie circule par vagues, aggravées sous l'influence d'une infection ou de facteurs non spécifiques (hypothermie, stress physique, stress, etc.), ce qui est associé au caractère auto-immun du processus pathologique. Lorsque le cœur est atteint, le processus inflammatoire peut se propager à toutes les membranes du cœur (pancardite) ou isolément à chacune des membranes. Les modifications morphologiques des rhumatismes se trouvent principalement dans le myocarde, c'est donc la myocardite aux premiers stades qui détermine le tableau clinique. Des modifications inflammatoires de l'endocarde (valvulite, endocardite verruqueuse), des lésions des filaments tendineux et de l'anneau fibreux sont cliniquement détectées 6 à 8 semaines après la crise de rhumatisme. La valve mitrale est la plus souvent touchée, suivie des valves aortique et tricuspide. La valve pulmonaire dans les rhumatismes n'est presque jamais atteinte. Classification des rhumatismes. Actuellement, la classification et la nomenclature des rhumatismes, approuvées en 1990 par la Société scientifique de rhumatologie de toute l'Union, ont été adoptées, reflétant la phase du processus, les caractéristiques cliniques et anatomiques des dommages aux organes et systèmes, la nature de l'évolution et l'état fonctionnel du système cardiovasculaire (voir tableau 1). Image clinique. Toutes les manifestations de la maladie peuvent être divisées en cardiaques et extracardiaques. Le tableau clinique de la maladie peut être décrit à partir de ces positions. Stade I: le lien de la maladie avec l'infection transmise est révélé. Dans les cas typiques, 1 à 2 semaines après un mal de gorge ou une maladie respiratoire aiguë, la température corporelle augmente, parfois jusqu'à 38-40 ° C, avec des fluctuations au cours de la journée de 1 à 2 ° C et une forte transpiration (généralement sans frissons). Avec des attaques répétées de rhumatismes, une récidive de la maladie se développe souvent sous l'influence de facteurs non spécifiques (tels que l'hypothermie, la surcharge physique, la chirurgie). Tableau 1 Classification des rhumatismes
La manifestation la plus courante du rhumatisme est une atteinte cardiaque - cardiopathie rhumatismale: atteinte simultanée du myocarde et de l'endocarde. Chez l'adulte, la cardiopathie rhumatismale n'est pas grave. Les patients se plaignent de douleurs légères ou d'inconfort dans la région du cœur, un léger essoufflement pendant l'exercice, les interruptions ou les palpitations sont beaucoup moins fréquentes. Ces symptômes ne sont pas spécifiques aux cardiopathies rhumatismales et peuvent être observés dans d'autres affections cardiaques. La nature de ces plaintes est précisée lors des étapes ultérieures de la recherche diagnostique. En règle générale, les cardiopathies rhumatismales chez les jeunes patients sont graves: dès le début de la maladie, on note un essoufflement grave pendant l'exercice et au repos, des douleurs cardiaques constantes et des palpitations. Il peut y avoir des symptômes d'insuffisance circulatoire dans un grand cercle sous forme d'œdème et de lourdeur dans l'hypochondre droit (en raison d'une augmentation du foie). Tous ces symptômes indiquent une myocardite diffuse sévère. La péricardite, ainsi que les manifestations extracardiaques du rhumatisme, sont rares. Avec le développement de la péricardite sèche, les patients ne remarquent qu'une douleur constante dans la région du cœur. Avec la péricardite exsudative, caractérisée par l'accumulation d'exsudat séreux-fibrineux dans le sac cardiaque, la douleur disparaît, car les feuilles péricardiques enflammées sont séparées par l'exsudat accumulé. Un essoufflement apparaît, qui augmente avec la position horizontale du patient. En raison de la difficulté de circulation sanguine vers le cœur droit, une congestion apparaît dans un grand cercle (œdème, lourdeur dans l'hypochondre droit due à une augmentation du foie). Le rhumatisme le plus caractéristique est la défaite du système musculo-squelettique sous la forme d'une polyarthrite rhumatismale. Les patients notent une augmentation rapide des douleurs dans les grosses articulations (genou, coude, épaule, cheville, poignet), l'impossibilité de mouvements actifs, une augmentation du volume des articulations. Il y a un effet rapide après l'utilisation de l'acide acétylsalicylique et d'autres anti-inflammatoires non stéroïdiens avec soulagement pendant plusieurs jours, souvent plusieurs heures de toutes les manifestations articulaires. Les lésions rhumatismales des reins sont également extrêmement rares, détectées uniquement dans l'étude de l'urine. Les lésions du système nerveux dans les rhumatismes sont rares, principalement chez les enfants. Les plaintes sont similaires à celles de l'encéphalite, de la méningo-encéphalite, de la vascularite cérébrale d'étiologie différente. Seule la "petite chorée" mérite l'attention, qui survient chez les enfants (plus souvent les filles) et se manifeste par une combinaison de labilité émotionnelle et d'hyperkinésie violente du tronc, des membres et des muscles mimiques. Le syndrome abdominal (péritonite) survient presque exclusivement chez les enfants et les adolescents atteints de rhumatisme primitif aigu. Elle se caractérise par une apparition brutale, de la fièvre et des signes de dysphagie (crampes diffuses ou localisées, nausées, vomissements, rétention ou selles fréquentes). Au stade II de la recherche diagnostique, la détection des signes d'atteinte cardiaque importe peu. Dans les cardiopathies rhumatismales primaires, le cœur n'est généralement pas hypertrophié. L'auscultation révèle un ton I étouffé, parfois l'apparition d'un ton III, un doux souffle systolique à l'apex. Cette symptomatologie est due à des modifications du myocarde. Cependant, une augmentation de l'intensité, de la durée et de la persistance du bruit peut indiquer la formation d'une insuffisance de la valve mitrale. Il est possible de juger en toute confiance de la formation du défaut 6 mois après le début de l'attaque, tout en conservant l'image auscultatoire ci-dessus. En cas de lésion de la valve aortique, un souffle proto-diastolique au point de Botkin peut être entendu et la sonorité du ton II peut être conservée. Ce n'est que plusieurs années plus tard, après la formation d'une insuffisance valvulaire aortique sévère, que l'affaiblissement (ou l'absence) du ton II dans l'espace intercostal II à droite rejoint ce signe auscultatoire. Chez les patients atteints de polyarthrite, on note une déformation articulaire due à une inflammation de la membrane synoviale et des tissus périarticulaires, une douleur à la palpation de l'articulation. Dans la zone des articulations touchées, des nodules rhumatismaux peuvent apparaître, situés sur les avant-bras et les tibias, au-dessus des proéminences osseuses. Ce sont de petites formations denses et indolores qui disparaissent sous l'influence du traitement. Les érythèmes annulaires (signe presque pathognomonique des rhumatismes) sont des éléments annulaires roses, non prurigineux, situés sur la peau de la face interne des bras et des jambes, de l'abdomen, du cou et du tronc. Ce symptôme est extrêmement rare (chez 1 à 2 % des patients). La pneumonie rhumatismale et la pleurésie ont les mêmes signes physiques que des maladies similaires d'étiologie banale. En général, les lésions non cardiaques sont actuellement observées extrêmement rarement, chez les jeunes souffrant d'un rhumatisme aigu (en présence d'une activité élevée - degré III). Ils sont exprimés de manière peu nette, rapidement susceptibles d'inverser le développement pendant le traitement antirhumatismal. Au stade III de la recherche diagnostique, les données des études de laboratoire et instrumentales nous permettent d'établir l'activité du processus pathologique et de clarifier les dommages au cœur et aux autres organes. Avec un processus rhumatismal actif, les tests de laboratoire révèlent une phase aiguë non spécifique et des paramètres immunologiques altérés. Indicateurs de phase aiguë: neutrophilie avec déplacement de la formule sanguine leucocytaire vers la gauche; une augmentation de la teneur en 2-globulines, suivie d'une augmentation du niveau de - globulines; augmentation de la teneur en fibrinogène ; l'apparition de la protéine C-réactive; L'ESR augmente. En ce qui concerne les paramètres immunologiques, les titres d'anticorps anti-streptococciques augmentent (anti-hyaluronidase et antistreptokinase plus de 1 : 300, anti-O-streptolysine plus de 1 : 250). L'ECG révèle parfois des troubles du rythme et de la conduction : bloc auriculo-ventriculaire transitoire (plus souvent I degré - allongement de l'intervalle P-Q, moins souvent - II degré), extrasystole, rythme auriculo-ventriculaire. Chez un certain nombre de patients, une diminution de l'amplitude de l'onde T est enregistrée jusqu'à l'apparition de dents négatives. Ces troubles du rythme et de la conduction sont instables et disparaissent rapidement au cours d'un traitement antirhumatismal. Si les modifications de l'ECG persistent et persistent après l'élimination d'une attaque rhumatismale, il faut alors penser à des dommages organiques au myocarde. Lors de l'examen phonocardiographique, les données d'auscultation sont précisées : affaiblissement du XNUMXer ton, apparition du XNUMXe ton, souffle systolique. Dans le cas de la formation d'une maladie cardiaque, des changements apparaissent sur le PCG qui correspondent à la nature de la lésion valvulaire. Radiographie à la première attaque de rhumatisme, aucun changement n'est détecté. Ce n'est qu'en cas de cardiopathie rhumatismale sévère chez les enfants et les jeunes qu'une augmentation du cœur peut être détectée en raison de la dilatation du ventricule gauche. Avec le développement d'une cardiopathie rhumatismale dans le contexte d'une maladie cardiaque existante, l'image radiographique correspondra à un défaut spécifique. Une étude échocardiographique dans la cardiopathie rhumatismale primitive ne révèle aucun changement caractéristique. Seules les cardiopathies rhumatismales sévères avec des signes d'insuffisance cardiaque sur l'échocardiogramme montrent des signes indiquant une diminution de la fonction contractile du myocarde et une expansion des cavités cardiaques. diagnostics. Il est très difficile de reconnaître un rhumatisme primaire, car ses manifestations les plus courantes, telles que la polyarthrite et les lésions cardiaques, ne sont pas spécifiques. Actuellement, les critères majeurs et mineurs de rhumatisme de l’American Heart Association sont les plus largement utilisés. La combinaison de deux critères majeurs ou d'un critère majeur et de deux critères mineurs indique une plus grande probabilité de rhumatisme uniquement en cas d'infection streptococcique antérieure. Avec l'apparition progressive des rhumatismes, le diagnostic syndromique proposé par AI Nesterov en 1973 (voir tableau 2) importe : syndrome clinique et épidémiologique (lien avec l'infection streptococcique) ; syndrome clinique et immunologique (signes de convalescence incomplète, arthralgie, augmentation des titres d'anticorps antistreptococciques, ainsi que détection de dysprotéinémie et d'indicateurs de phase aiguë); syndrome cardiovasculaire (détection de cardite, ainsi que de lésions extracardiaques) (voir tableau 3). Tableau 2 Critères de rhumatisme
Tableau 3 Degrés de rhumatismes
Diagnostic différentiel. Les polyarthrites rhumatismales doivent être différenciées des polyarthrites non rhumatismales (voir tableau 4). Tableau 4 Polyarthrite rhumatismale et non rhumatismale
Les maladies et symptômes suivants sont suspects en relation avec les rhumatismes : 1) endocardite ; 2) myocardite ; 3) péricardite ; 4) malformations cardiaques ; 5) troubles du rythme et de la conduction ; 6) insuffisance cardiaque aiguë et chronique ; 7) état subfébrile prolongé; 8) érythème noueux ; 9) érythème annulaire ; 10) nodules sous-cutanés ; 11) polyarthrite allergique aiguë ; 12) chorée. Aucun des syndromes cliniques listés ci-dessus n'est spécifique à cette maladie. Seule l'association d'une pathologie cardiaque avec au moins un symptôme principal extracardiaque de rhumatisme permet de suspecter un rhumatisme. La reconnaissance de la cardiopathie rhumatismale elle-même s'effectue sur la base de symptômes tels que l'essoufflement et les palpitations, la fatigue, les douleurs cardiaques et les troubles du rythme cardiaque, les bruits, parfois un rythme de galop et un affaiblissement du ton I. L'identification de la pathologie sur l'ECG est d'une grande importance dans le diagnostic des cardiopathies rhumatismales. Dans les rhumatismes, elle est causée par une myocardite, une péricardite et des malformations cardiaques. L'observation dynamique permet de distinguer les changements irréversibles caractéristiques de l'hypertrophie de diverses parties du cœur en cas de défauts, des changements transitoires, indiquant le processus inflammatoire en cours. traitement. Un effet positif du traitement, ainsi que la prévention du développement des maladies cardiaques, sont facilités par un diagnostic précoce et un traitement individuel, basés sur une évaluation du type d'évolution, de l'activité du processus pathologique, de la gravité de la cardite, et la variante de la cardiopathie valvulaire. L’état du myocarde, des autres tissus et organes, la profession du patient, etc. sont importants. Ainsi, l'ensemble du traitement des rhumatismes consiste en une thérapie antimicrobienne et anti-inflammatoire, des mesures visant à rétablir l'homéostasie immunologique. Il est recommandé d'utiliser une alimentation rationnelle et équilibrée, de se concentrer sur l'adaptation à l'activité physique, la préparation au travail, le traitement chirurgical rapide des patients atteints de malformations cardiaques complexes. Tous les patients pendant la phase active du rhumatisme reçoivent de la pénicilline (1 200 000-1 500 000 UI pour 6 doses par jour, toutes les 4 heures), qui a un effet bactéricide sur tous les types de streptocoques A. La durée du traitement est de 2 semaines pendant la phase active du rhumatisme, à l'avenir, un transfert vers le médicament prolongé bicilline-5 (1 500 000 unités) est nécessaire. En cas d'intolérance à la pénicilline, l'érythromycine 250 mg 4 fois par jour peut être prescrite. Les médicaments à effet anti-inflammatoire, utilisés dans le traitement moderne de la phase active des rhumatismes, sont les glucocorticostéroïdes, les dérivés salicyliques, indoliques, les dérivés de l'acide phénylacétique, etc. La prednisolone est utilisée à raison de 20 à 30 mg par jour (pendant 2 semaines, puis la dose est réduite de 2,5 à 5 mg tous les 5 à 7 jours, au total pour une cure de 1,5 à 2 mois) pour les primaires et récurrentes avec III et II degré d'activité du processus de cardiopathie rhumatismale, avec polysérite et chorée, avec développement d'une insuffisance cardiaque due à une cardite active. Dans ce dernier cas, la triamcinolone à une dose de 12-16 mg par jour est préférée, car elle a peu de capacité à perturber l'équilibre électrolytique. Les médicaments corticoïdes affectent le métabolisme des sels d'eau, par conséquent, le chlorure de potassium 3-4 g / jour, la panangine et d'autres doivent être utilisés dans le traitement, avec rétention d'eau - antagonistes de l'aldostérone (véroshpiron jusqu'à 6-8 comprimés par jour), diurétiques (lasix 40-80 mg/jour, furosémide 40-80 mg/jour, etc.), avec euphorie - tranquillisants, etc. Les anti-inflammatoires non stéroïdiens sont également largement utilisés pour les rhumatismes : les doses moyennes d'acide acétylsalicylique sont de 3 à 4 g par jour, moins souvent de 5 g par jour ou plus. Indications d'utilisation des salicylates : 1) degré d'activité minimal, légère gravité de la cardite, principalement myocardite ; 2) traitement à long terme des rhumatismes, suspicion d'évolution latente ; 3) traitement prolongé avec une diminution de l'activité du déroulement du processus et l'arrêt de l'utilisation de corticostéroïdes, ainsi qu'après la fin du traitement dans un hôpital; 4) cardiopathie rhumatismale récurrente survenant dans le contexte de malformations cardiaques graves et d'insuffisance circulatoire, car les salicylates ne sont pas capables de retenir les liquides, d'empêcher la formation de caillots sanguins et sont des stimulants du centre respiratoire; 5) réduire le risque d'exacerbation des rhumatismes au printemps et en automne, ainsi qu'après avoir souffert d'infections intercurrentes (avec des antibiotiques). L'acide acétylsalicylique est utilisé 1 g 3 à 4 fois par jour après les repas pendant 1 à 3 mois ou plus avec une tolérance normale et sous réserve du contrôle des effets secondaires. L'utilisation réussie du dérivé de l'acide indolacétique - l'indométhacine dans les rhumatismes depuis plus de 20 ans. Il a un effet thérapeutique prononcé: les symptômes subjectifs de cardite (cardialgie, palpitations, essoufflement) disparaissent au 8-10e jour de traitement et les signes objectifs - au 14-16e jour. La disparition de la polyarthrite et de la polysérite se produit encore plus rapidement. Dans le traitement des rhumatismes, la combinaison de trois étapes principales est importante : hôpital - clinique - resort. À l'hôpital, le traitement est effectué avec les médicaments énumérés ci-dessus. Après avoir réduit l'activité des rhumatismes et normalisé l'état du patient, ils sont transférés au stade II - traitement dans un sanatorium rhumatologique. L'objectif principal de cette étape est la poursuite du traitement avec des anti-inflammatoires non stéroïdiens, qui sont sélectionnés individuellement à l'hôpital, les dérivés de l'aminoquinoline, la bicilline-5, la rééducation. Le stade III comprend l'observation au dispensaire et le traitement préventif. Il s'agit de la mise en œuvre de mesures thérapeutiques visant à éliminer définitivement le cours actif du processus rhumatismal; mener un traitement symptomatique des troubles circulatoires chez les patients souffrant de maladies cardiaques ; résoudre les problèmes de réadaptation, de capacité de travail et d'emploi; mise en œuvre de la prévention primaire des rhumatismes et de la prévention secondaire des récidives de la maladie. CONFÉRENCE N ° 2. Maladies du système cardiovasculaire. Cardiomyopathie. Cardiomyopathie dilatée 1. Cardiomyopathie Cardiomyopathie - lésions myocardiques primaires isolées de nature non inflammatoire d'étiologie inconnue (idiopathiques), elles ne sont pas associées à des défauts valvulaires ou des shunts intracardiaques, une hypertension artérielle ou pulmonaire, une maladie coronarienne ou des maladies systémiques (telles que : collagénoses, amylose, hémochromatose, etc.), et au stade final de la maladie, une insuffisance cardiaque congestive sévère et des troubles complexes du rythme cardiaque et de la perméabilité se développent. La classification des cardiomyopathies est la suivante : 1) cardiomyopathie dilatée : a) idiopathique ; b) toxique ; c) infectieux ; d) avec des collagénoses ; 2) hypertrophique ; 3) restrictif ; 4) dysplasie arythmique du ventricule droit ; 5) une association d'un des 4 types de cardiomyopathies avec l'hypertension artérielle. 2. Cardiomyopathie dilatée La cardiomyopathie dilatée (DCM) est une maladie du muscle cardiaque caractérisée par une expansion diffuse de toutes les cavités du cœur (principalement du ventricule gauche), dans laquelle la pathologie de la fonction de pompage du cœur est au premier plan et, par conséquent , insuffisance cardiaque chronique (d'où le deuxième nom est congestif, lorsque le cœur n'est pas capable de pomper complètement le sang et qu'il « stagne » dans les tissus et les organes du corps). La paroi musculaire du cœur reste soit inchangée, soit hypertrophiée à des degrés divers. Les maladies et les facteurs qui ont précédé le développement du DCM sont décrits dans le tableau ci-dessous (voir Tableau 5). Tableau 5 Maladies et facteurs qui ont précédé le développement du DCMP
Il s'agit de la forme la plus courante de lésion du muscle cardiaque. L'incidence est de 5 à 8 cas pour 100 000 personnes par an. Il n'y a pas d'antécédents familiaux clairs pour ces patients. Les hommes tombent malades 2 à 3 fois plus souvent que les femmes. pathogénèse. En raison du processus inflammatoire du muscle cardiaque (myocardite), la mort de cellules individuelles se produit dans ses différentes parties. Dans ce cas, l’inflammation est de nature virale et les cellules affectées par le virus deviennent des agents étrangers pour l’organisme. En conséquence, lorsque des antigènes apparaissent dans le corps, un complexe de réactions immunitaires se développe visant à leur destruction. Progressivement, les cellules musculaires mortes sont remplacées par du tissu conjonctif, qui n'a pas la capacité d'extensibilité et de contractilité inhérente au myocarde. En raison de la perte des fonctions myocardiques de base, le cœur perd sa capacité à fonctionner comme une pompe. En réponse à cela (en tant que réaction compensatoire), les cavités cardiaques se dilatent (c'est-à-dire qu'elles se dilatent) et dans la partie restante du myocarde, un épaississement et un compactage se produisent (c'est-à-dire que son hypertrophie se développe). Pour augmenter l'apport d'oxygène aux organes et aux tissus du corps, une augmentation persistante de la fréquence cardiaque se produit (tachycardie sinusale). Cette réponse compensatoire n'améliore que temporairement la fonction de pompage du cœur. Cependant, les possibilités de dilatation et d'hypertrophie du myocarde sont limitées par la quantité de myocarde viable et sont individuelles pour chaque cas spécifique de la maladie. Avec le passage du processus au stade de décompensation, une insuffisance cardiaque chronique se développe. Cependant, à ce stade, un autre mécanisme de compensation entre en jeu : les tissus de l'organisme augmentent l'extraction d'oxygène du sang par rapport à un corps sain. Mais ce mécanisme est insuffisant, car une diminution de la fonction de pompage du cœur entraîne une diminution de l'apport d'oxygène aux organes et aux tissus, nécessaire à leur fonctionnement normal, tandis que la quantité de dioxyde de carbone qu'ils contiennent augmente. Chez 2/3 des patients dans les cavités des ventricules aux derniers stades de la maladie, des thrombus pariétaux se forment (en raison d'une diminution de la fonction de pompage du cœur, ainsi que d'une contraction inégale du myocarde dans les cavités du cœur), suivie par le développement d'une embolie dans la circulation pulmonaire ou systémique. Modifications pathohistologiques et pathomorphologiques du cœur. La forme du cœur devient sphérique, sa masse passe de 500 à 1000 g, principalement à cause du ventricule gauche. Le myocarde devient flasque, terne, avec des couches blanchâtres notables de tissu conjonctif, il y a une alternance caractéristique de cardiomyocytes hypertrophiés et atrophiques. Au microscope, une fibrose diffuse est détectée, elle peut être associée à la fois à l'atrophie et à l'hypertrophie des cardiomyocytes, dans lesquelles il y a une augmentation significative du volume des noyaux, du nombre de mitochondries, de l'hyperplasie de l'appareil de Golgi, une augmentation du nombre de myofibrilles , libres et associés aux ribosomes du réticulum endoplasmique, une abondance de granules de glycogène. Image clinique. Il n'y a pas de signes spécifiques de la maladie. Le tableau clinique est polymorphe et est déterminé par : 1) symptômes d'insuffisance cardiaque; 2) troubles du rythme et de la conduction ; 3) syndrome thromboembolique. Tous ces phénomènes se développent au stade terminal de la maladie, et donc la reconnaissance du DCM avant l'apparition de ces symptômes présente des difficultés importantes. Dans la plupart des cas, le pronostic de la maladie est déterminé par la défaite du ventricule gauche du cœur. Avant le début de l'insuffisance cardiaque, le DCM est latent. Les plaintes les plus fréquentes d'insuffisance cardiaque déjà apparue sont des plaintes de diminution des performances, d'augmentation de la fatigue, d'essoufflement pendant l'effort, puis au repos. La nuit, il a une toux sèche (l'équivalent de l'asthme cardiaque), plus tard - des crises d'asthme typiques. Les patients présentent des douleurs angineuses caractéristiques. Avec le développement de la congestion dans la circulation systémique, une lourdeur apparaît dans l'hypochondre droit (due à l'hypertrophie du foie), un gonflement des jambes. diagnostics. Lors du diagnostic de la maladie, un signe important est une hypertrophie significative du cœur (il n'y a aucun signe de valvulopathie ou d'hypertension artérielle). La cardiomégalie se manifeste par une expansion du cœur dans les deux sens, déterminée par percussion, ainsi que par un déplacement de l'impulsion apicale vers la gauche et vers le bas. Dans les cas graves, on entend un rythme de galop, une tachycardie et des bruits d'insuffisance relative des valvules mitrale ou tricuspide. Dans 20 % des cas, une fibrillation auriculaire se développe. La tension artérielle est généralement normale ou légèrement élevée (en raison d’une insuffisance cardiaque). Les études biochimiques du sang et de l'urine peuvent détecter diverses substances toxiques, ainsi que des carences en vitamines. Les méthodes de recherche instrumentale permettent de détecter : 1) signes de cardiomégalie ; 2) changements dans les paramètres de l'hémodynamique centrale; 3) troubles du rythme et de la conduction. Il n'y a pas de changements caractéristiques sur l'ECG ou les changements ne sont pas spécifiques. Ce sont les signes d'une augmentation de la taille du cœur, de troubles de la conduction sous la forme d'un blocage de la branche antérieure de la jambe gauche du faisceau auriculo-ventriculaire (His bundle) ou d'un blocage complet de la jambe gauche (15% des cas ); ainsi qu'une tachycardie sinusale persistante (la fréquence cardiaque dépasse souvent 100 battements par minute). Le phonocardiogramme confirme les données auscultatoires sous la forme d'un rythme de galop, détection assez fréquente de souffle systolique (dû à une insuffisance relative de la valve mitrale ou tricuspide). Avec la congestion de la circulation pulmonaire, un accent du ton II est révélé. La radiographie révèle une augmentation significative des ventricules (souvent associée à une augmentation modérée de l'oreillette gauche) et une stagnation du sang dans la (petite) circulation pulmonaire. Les violations de la circulation pulmonaire se manifestent par une augmentation du schéma vasculaire pulmonaire, ainsi que par l'apparition de transsudats dans les cavités pleurales, qui se forment en raison de l'augmentation de la pression dans les vaisseaux des poumons. La méthode d'échocardiographie est l'une des principales méthodes de diagnostic de la maladie. L'échocardiographie permet de détecter une dilatation des deux ventricules, une hypokinésie de la paroi postérieure du ventricule gauche, un mouvement paradoxal du septum interventriculaire pendant la systole. De plus, l'échocardiographie vous permet de clarifier l'augmentation de l'amplitude de mouvement des folioles inchangées de la valve mitrale. Des études instrumentales supplémentaires ne sont pas obligatoires pour poser un diagnostic, mais leurs résultats permettent de détailler le degré de troubles hémodynamiques et la nature des modifications morphologiques du myocarde. Une étude radio-isotopique du cœur (scintigraphie myocardique) est réalisée pour clarifier l'état de la fonction de pompage du cœur, ainsi que pour déterminer les zones du myocarde mort. L'étude des indicateurs de l'hémodynamique centrale révèle un faible volume minute et systolique (indices minute et course), une augmentation de la pression dans l'artère pulmonaire. Angiocardiographiquement, les mêmes changements sont détectés que sur l'échocardiogramme. La biopsie myocardique en direct n'est pas informative pour déterminer l'étiologie de la cardiomyopathie. Dans certains cas, un antigène viral ou une augmentation du contenu en LDH, ainsi qu'une diminution de la production d'énergie par les mitochondries, peuvent être détectés à la biopsie. Cependant, cette méthode chirurgicale peut être utilisée pour clarifier l'étiologie de la maladie et un traitement ultérieur. La manipulation est effectuée comme suit: sous anesthésie locale, une grosse artère et une veine sont percées (perforées), puis un instrument spécial avec de petits ciseaux à la fin est passé le long de leur parcours jusqu'au cœur. Lorsque la biopsie myocardique est associée à une angiographie coronarienne (injection d'un agent de contraste dans les artères coronaires alimentant le cœur), il devient possible d'exclure la maladie coronarienne chez un patient comme l'une des maladies présentant des symptômes similaires au DCM. Ces deux études sont réalisées sous contrôle de télévision à rayons X. Diagnostic différentiel. Elle est réalisée principalement en cas de myocardite et de dystrophies du myocarde, c'est-à-dire avec des affections parfois appelées de manière déraisonnable cardiomyopathies secondaires. La biopsie myocardique apporte une aide significative dans le diagnostic différentiel de la cardiomyopathie dilatée et des maladies cardiaques, survenant avec une augmentation prononcée de celle-ci : 1) avec une myocardite diffuse sévère, une infiltration cellulaire du stroma est associée à des modifications dystrophiques et nécrotiques des cardiomyocytes; 2) avec une amylose primaire survenant avec des lésions cardiaques (la variante dite cardiopathique de l'amylose primaire), il y a un dépôt important d'amyloïde dans le tissu interstitiel du myocarde, combiné à une atrophie des fibres musculaires ; 3) avec l'hémochromatose (une maladie causée par une violation du métabolisme du fer), des dépôts de pigment contenant du fer se trouvent dans le myocarde, divers degrés de dystrophie et d'atrophie des fibres musculaires et une prolifération du tissu conjonctif sont observés. Comme variante du DCM, les cardiomyopathies médicamenteuses et toxiques peuvent être envisagées. De nombreux agents peuvent causer des dommages toxiques au myocarde : éthanol, émétine, lithium, cadmium, cobalt, arsenic, isoprotérénol et autres poisons. Les changements histopathologiques dans les tissus du muscle cardiaque apparaissent comme des dystrophies focales. À l'avenir, le développement de micro-infarctus se produit, accompagné d'une réaction inflammatoire périphérique. L'exemple le plus frappant de cardiomyopathie toxique est la cardiomyopathie, qui survient chez les personnes qui consomment trop de bière. Cela est dû à la présence de cobalt dans celle-ci, qui est ajouté à la bière pour améliorer la mousse. Le cobalt bloque l'action de la vitamine B1, et affecte également directement le changement dans les processus enzymatiques de la cellule. Au stade aigu de l'évolution de la cardiomyopathie au cobalt, on note la présence d'une dégénérescence hydropique et graisseuse, la destruction des organites intracellulaires et la nécrose focale des cardiomyocytes. À l'avenir, une fibrose interstitielle diffuse ou à petite focale se développe, le résultat final est la formation de cicatrices étendues. La cardiomyopathie cobalt est plus sévère que la cardiomyopathie alcoolique. Si le diagnostic est posé à temps, une guérison clinique des patients est observée. Cardiomyopathie alcoolique. L'éthanol a un effet toxique direct sur les cardiomyocytes. De plus, avec une intoxication chronique à l'éthyle, il y a souvent un manque de nutrition. Il a été prouvé que l'alcool entraîne la commutation des acides gras dans les cardiomyocytes, car il y a un manque d'énergie nécessaire à leur activité. L'acétaldéhyde, formé lors du métabolisme de l'alcool, peut être un facteur d'effets toxiques directs sur la synthèse des protéines. L'alcoolisme s'accompagne également de l'activation de virus latents. Macroscopiquement, le myocarde est flasque, argileux, parfois de petites cicatrices sont observées. Les artères coronaires sont intactes. L'examen microscopique montre une combinaison de dystrophie (hydropique et graisseuse), d'atrophie et d'hypertrophie des cardiomyocytes, éventuellement la présence de foyers de lyse des cardiomyocytes et de sclérose. Les zones touchées du myocarde contrastent avec les zones inchangées. L'examen au microscope électronique d'échantillons de biopsie cardiaque montre une expansion kystique du réticulum sarcoplasmique et du système T des cardiomyocytes, caractéristique de la cardiomyopathie alcoolique. Complications de la cardiomyopathie alcoolique - mort subite à la suite d'une fibrillation ventriculaire ou d'une insuffisance cardiaque chronique, syndrome thromboembolique. traitement. Le traitement des cardiomyopathies est une tâche difficile, car les causes spécifiques de leur apparition ne sont pas connues. Les principes généraux du traitement du DCM ne diffèrent pas significativement du traitement de l'insuffisance cardiaque chronique. En cas de DCM secondaire, la maladie antérieure (valvulopathie cardiaque, etc.) est traitée en plus et toutes les mesures sont prises pour éliminer les causes du DCM. En substance, nous ne pouvons parler du traitement des patients atteints de cardiomyopathie que lorsque des signes cliniques apparaissent. Dans l'insuffisance cardiaque, les glycosides cardiaques sont inefficaces. Les patients développent rapidement une intolérance aux médicaments (intoxication aux glycosides) et il est donc nécessaire d'utiliser des glycosides rapidement excrétés par l'organisme (strophanthine, isolanide). Les vasodilatateurs périphériques sont assez efficaces, en particulier avec le syndrome angineux concomitant (nitrong, sustak, nitrosorbide). Ces médicaments doivent être prescrits en cas d'insuffisance cardiaque sévère, difficile à traiter avec des glycosides et des diurétiques. Avec le syndrome angineux, il devient nécessaire d'utiliser des médicaments anti-angineux, de préférence des nitrates prolongés (sustak, nitrong, nitrosorbide). Les adrénobloquants sont efficaces (ils sont prescrits en l'absence de signes d'insuffisance cardiaque). Parmi les méthodes modernes de traitement chirurgical du DCMP, la plus efficace est la transplantation cardiaque (transplantation). Cependant, les possibilités de réaliser cette opération sont considérablement limitées. Pour cette raison, comme alternative à la transplantation cardiaque dans le traitement moderne, pour augmenter l'espérance de vie des patients atteints de DCM, des chirurgies reconstructives ont été développées et sont en cours, qui visent à éliminer l'insuffisance des valves cardiaques mitrale et tricuspide. L'élimination opératoire de l'insuffisance de ces valves permet pendant un certain temps de "ralentir" l'apparition du stade final de la maladie. Une autre alternative à la transplantation cardiaque chez les patients atteints de DCM était l'ablation partielle du ventricule gauche afin de réduire sa taille (opération Baptiste). Il n'y a pas si longtemps, pour le traitement des patients atteints de DCMP, des modèles spéciaux de stimulateurs cardiaques ont été développés, ils vous permettent de rendre le travail des ventricules du cœur synchrone. Cela conduit à une amélioration du remplissage sanguin des ventricules du cœur et à une augmentation de la fonction de pompage du cœur. Un problème distinct doit être considéré comme le DCM chez les enfants, qui est de 5 à 10 cas pour 100 000 enfants par an. Il est à noter que la maladie peut se développer dans différents groupes d'âge, y compris les nourrissons. Les données obtenues dans l'étude d'un groupe d'enfants sont les suivantes: les patients ont reçu 3 options de traitement (monothérapie avec prednisolone, monothérapie avec digoxine ou prednisolone + digoxine). L'efficacité du traitement a été évaluée selon les critères suivants : la fréquence cardiaque a été déterminée avant et après le traitement, la fréquence respiratoire, l'état de la fraction d'éjection et la fraction de contractilité. L'analyse des résultats obtenus montre que le plus grand effet dans le traitement de la cardiomyopathie dilatée chez les jeunes enfants est obtenu avec une combinaison de corticostéroïdes et de glycosides (prednisolone et digoxine). Après la fin du traitement principal (prednisolone administrée 2 mg/kg par jour pendant 28 jours, digoxine), il y a eu une diminution marquée de la fréquence cardiaque, une diminution de l'essoufflement. Dans le contexte de la monothérapie avec la prednisolone, une diminution de la fréquence cardiaque se produit. La monothérapie avec la digoxine entraîne une diminution de la tachycardie et de la dyspnée. Compte tenu de l'inopportunité de prescrire des médicaments cytostatiques chez les jeunes enfants, puisqu'un nombre important de complications de traitement a été observé, il est plus optimal en pédiatrie d'utiliser des glycosides cardiaques à longue durée d'action en association avec des hormones corticostéroïdes dans la cardiomyopathie dilatée. Prévention. La prévention du DCM consiste à éviter l’alcool, la cocaïne et à surveiller attentivement les paramètres cardiaques pendant la chimiothérapie tumorale. Il est utile pour raffermir le corps dès le plus jeune âge. L'abstinence complète d'alcool dans le DCM alcoolique améliore la contractilité cardiaque et peut éliminer le besoin d'une transplantation cardiaque. Le fait que, dans la plupart des cas, le diagnostic se produise au stade de l'insuffisance cardiaque peut également entraîner des résultats négatifs dans le traitement. Le diagnostic précoce de la cardiomyopathie dilatée peut être réalisé avec une échocardiographie aléatoire (de dépistage), qui est réalisée lors de l'examen médical annuel, ainsi que lors de l'examen de personnes héréditaires accablées par cette maladie. C'est dans ce cas qu'il est possible d'augmenter l'efficacité du traitement médicamenteux du DCM. CONFÉRENCE № 3. Maladies du système cardiovasculaire. Cardiomyopathie hypertrophique La cardiomyopathie hypertrophique (HCM) est une maladie non coronarienne du myocarde ventriculaire (principalement le gauche), caractérisée par une hypertrophie massive de leurs parois avec protrusion du septum interventriculaire (IVS) dans la cavité du ventricule droit, qui peut être considérablement épaissi , une diminution du volume interne des ventricules, une contractilité normale ou accrue du myocarde ventriculaire et une relaxation altérée (dysfonctionnement diastolique). La plus fréquente est l'hypertrophie isolée du septum interventriculaire (sténose sous-aortique hypertrophique isolée - IHSS) ou de la partie apicale des ventricules. Classification. Classification de l'HCM par localisation de l'hypertrophie (ED Wigle et al., 1985 avec ajouts). I. Hypertrophie VG. 1) Hypertrophie asymétrique, dans laquelle se produit une hypertrophie myocardique des parois individuelles ou des segments des ventricules (y compris l'hypertrophie IVS - 90 % avec ou sans obstruction des voies d'éjection du ventricule gauche, ventriculaire moyen - 1 %, hypertrophie ventriculaire gauche apicale - 3 %, hypertrophie de la paroi libre ventricule gauche et partie postérieure de l'IVS - 1 %). 2) L'hypertrophie symétrique (concentrique) du ventricule gauche, lorsque l'hypertrophie myocardique s'étend à toutes les parois des ventricules, survient dans 5 % des cas. II. Hypertrophie du pancréas. Dans le cas où l'hypertrophie du myocarde empêche l'écoulement normal du sang des ventricules du cœur, on parle d'une forme obstructive de HCM. Dans d'autres cas, HCM est non obstructif. Étiologie. La maladie peut être congénitale ou acquise. La HCM congénitale est héritée de manière autosomique dominante. Au sein d’une même famille, diverses formes et variantes de HCM peuvent être observées. Le plus souvent, l'hypertrophie asymétrique du septum interventriculaire est héréditaire. La forme acquise de CMH survient chez les patients âgés ayant des antécédents d'hypertension artérielle. La prévalence est de 0,02 à 0,05 %. Les raisons du développement de la HCM acquise ne sont pas entièrement comprises. Selon l'une des hypothèses proposées, les individus atteints de CMH acquise en période prénatale développent un défaut des récepteurs adrénergiques du cœur impliqués dans la régulation de l'activité cardiaque, en particulier du rythme cardiaque. En conséquence, la sensibilité à la norépinéphrine et aux hormones similaires, qui augmentent la fréquence cardiaque, augmente de manière significative, ce qui affecte le développement de l'hypertrophie myocardique en eux, et éventuellement HCM. Image pathohistologique. Disposition désorientée, incorrecte et chaotique des cardiomyocytes et des myofibrilles dans les cardiomyocytes, la fibrose myocardique est une violation de l'architectonique du muscle cardiaque. pathogénèse. Les troubles hémodynamiques sont dus à une altération de la fonction diastolique du cœur. Pendant la diastole, le flux sanguin dans les ventricules (surtout gauche) est insuffisant en raison de leur densité et de leur rigidité, ce qui entraîne une augmentation rapide de la pression télédiastolique. L'augmentation de la rigidité myocardique et l'augmentation de la pression intraventriculaire entraînent toutes deux une diminution de l'éjection de sang du ventricule pendant la systole. Pour un apport adéquat d'oxygène aux organes et aux tissus du corps (avec le fonctionnement normal du système cardiovasculaire), pour la mise en œuvre de toute charge, la libération de sang du cœur doit augmenter. En conséquence, en réponse à la charge, la fréquence cardiaque augmente. Avec le développement de HCM, le remplissage du cœur avec du sang souffre également au repos, et avec une augmentation de la fréquence cardiaque pendant la période d'exercice, il est encore plus affecté négativement. En conséquence, il n'y a pas d'augmentation adéquate de la fonction de pompage du cœur pendant l'exercice en HCM. L'activité physique dans HCM affecte l'augmentation de la pression intraventriculaire, ce qui entraîne une augmentation de la pression dans l'oreillette gauche située au-dessus, ainsi que dans les vaisseaux de la petite circulation (pulmonaire). Dans ces conditions, l'hyperfonctionnement et l'hypertrophie de l'oreillette gauche se développent, et plus tard - l'hypertension pulmonaire ("passive"). En conséquence, un essoufflement se produit, qui est proportionnel au degré de charge. Étant donné que pendant l'exercice, l'éjection du sang du ventricule gauche ne correspond pas à l'augmentation de la charge, le flux sanguin dans les artères coronaires qui alimentent le muscle cardiaque lui-même commence à souffrir. Il joue également un rôle important dans le fait que, dans la HCM, il existe un écart entre une masse importante de myocarde hypertrophié et la possibilité d'un apport sanguin coronaire, qui reste le même que chez les personnes en bonne santé. La diminution du flux sanguin dans les artères coronaires entraîne la survenue d'une angine de poitrine au milieu et dans la moitié gauche de la poitrine, irradiant vers le bras gauche, sous l'omoplate gauche. Comme l'essoufflement, l'angine de poitrine est provoquée par un effort physique. Dans certains cas de HCM pendant l'exercice, l'apport sanguin cérébral se détériore également, entraînant une syncope. Il convient de noter que pour réduire l'augmentation de la pression intraventriculaire pendant l'exercice, il existe un mécanisme compensatoire dont le fonctionnement est basé sur le fait que la cavité de l'oreillette gauche se dilate et que l'épaisseur de ses parois augmente. En conséquence, il y a un remplissage supplémentaire du ventricule gauche avec du sang pendant l'exercice. Cependant, il ne s'agit que d'une compensation temporaire du fait que la réserve de l'oreillette gauche en tant que "pompe" est insignifiante et qu'une expansion importante de la cavité de l'oreillette gauche conduit au développement d'une fibrillation auriculaire. Image clinique. La CMH se caractérise par une extrême variété de symptômes, ce qui entraîne des erreurs de diagnostic. La présence et le moment des plaintes dans l'HCM sont principalement déterminés par 2 facteurs : la forme de l'HCM et la localisation de la lésion. La chambre la plus puissante du cœur est le ventricule gauche. Par conséquent, en cas d'hypertrophie des parois du myocarde, les plaintes peuvent ne pas apparaître avant longtemps. Les lésions isolées du ventricule droit du cœur sont extrêmement rares. Dans la forme non obstructive de HCM, lorsque rien n'interfère avec l'écoulement du sang du ventricule, le patient peut ne présenter aucune plainte. Parfois, il peut y avoir un essoufflement (avec un effort physique important), des interruptions du travail du cœur, ainsi qu'un rythme cardiaque irrégulier. Dans la forme obstructive de HCM, l'éjection du sang du cœur pendant l'exercice est considérablement réduite en raison de la présence d'une obstruction à la sortie du sang du ventricule. Dans ce cas, les plaintes typiques sont l'essoufflement à l'effort, l'angine de poitrine et l'évanouissement. La maladie se caractérise par une lente progression des plaintes dès son apparition. En raison de la similitude des plaintes (douleur dans la région du cœur et derrière le sternum) et des données d'étude (souffle systolique intense), les cardiopathies rhumatismales et les maladies coronariennes sont le plus souvent mal diagnostiquées. Le tableau clinique de la HCM est : 1) signes d'hypertrophie myocardique ventriculaire (principalement gauche); 2) un signe de fonction ventriculaire diastolique insuffisante ; 3) signes variables d'obstruction des voies d'éjection du ventricule gauche. diagnostics. Dans le processus de recherche diagnostique, le plus important est la détection d'un souffle systolique, d'une altération du pouls et d'un influx apical déplacé. L'image auscultatoire du cœur chez les patients atteints de CMH obstructive présente un certain nombre de caractéristiques : le son maximal du souffle systolique (souffle d'éjection) est déterminé au point de Botkin et à l'apex du cœur, la sévérité du souffle est proportionnelle à le degré d'obstruction, son intensification survient lorsque le patient se lève brusquement, ainsi que lors du test de Valsalva ; Le ton II est toujours conservé; le bruit n'est pas effectué sur les vaisseaux du cou. Le pouls est généralement élevé et rapide. Cela est dû à l'absence de rétrécissement dans les voies de sortie du ventricule gauche au début de la systole, mais ensuite, avec la contraction de muscles puissants, un rétrécissement «fonctionnel» des voies de sortie apparaît, à la suite duquel le pouls vague diminue prématurément. Le battement de l'apex dans environ 1/3 des cas a un caractère "double": d'abord, à la palpation, un coup est ressenti à partir de la contraction de l'oreillette gauche, puis à partir de la contraction du ventricule gauche. Pour faciliter l'identification de cette propriété du battement de l'apex, il est préférable de palper le patient allongé sur le côté gauche. Pour le diagnostic de HCM, les données d'échocardiographie sont de la plus haute importance, permettant de clarifier les caractéristiques anatomiques de la maladie, la gravité de l'hypertrophie myocardique, l'obstruction de la voie d'éjection du ventricule gauche. Les signes suivants sont révélés : hypertrophie asymétrique de l'IVS, plus prononcée dans le tiers supérieur, son hypokinésie ; mouvement systolique du feuillet antérieur de la valve mitrale dans le sens antérieur; contact du feuillet antérieur de la valve mitrale avec l'IVS en diastole. Les signes non spécifiques sont : une hypertrophie de l'oreillette gauche, une hypertrophie de la paroi postérieure du ventricule gauche, une diminution de la vitesse moyenne de la couverture diastolique du feuillet antérieur de la valve mitrale. Sur l'ECG, des modifications spécifiques ne sont trouvées qu'avec une hypertrophie ventriculaire gauche suffisamment développée. En enregistrant un ECG pendant 24 heures (surveillance Holter), les troubles du rythme cardiaque existants sont détectés. Un test ECG avec activité physique dosée à l'aide d'un vélo ergomètre ou d'un tapis roulant permet d'évaluer la sévérité des symptômes de la maladie, son pronostic et de développer un traitement adapté. L'hypertrophie isolée de l'IVS provoque une augmentation de l'amplitude de l'onde Q dans les dérivations thoraciques gauches (V5-6), ce qui complique le diagnostic différentiel avec les modifications focales dues à l'infarctus du myocarde. Cependant, une faible largeur de l'onde Q permet d'exclure un infarctus du myocarde Au cours du développement d'une surcharge hémodynamique de l'oreillette gauche, l'ECG peut montrer des signes d'hypertrophie auriculaire gauche : élargissement de l'onde P pendant plus de 0,10 s, augmentation dans son amplitude, l'apparition d'une onde P biphasique en V1 avec la deuxième phase augmentée en amplitude et en durée. Le diagnostic par rayons X n'est important qu'au stade avancé de la maladie, lorsqu'une augmentation du ventricule gauche et de l'oreillette gauche, une expansion de la partie descendante de l'aorte peut être déterminée. Sur le phonocardiogramme, les amplitudes des tonalités I et II sont préservées, ce qui est un signe différentiel de HCM à partir d'une sténose de l'orifice aortique, et un souffle systolique de gravité variable est également détecté. Les méthodes de recherche invasives (sondage des parties gauches du cœur, angiographie de contraste) ne sont actuellement pas obligatoires, car l'échocardiographie fournit des informations assez fiables pour établir un diagnostic. Cependant, ces méthodes sont parfois utilisées dans des cas controversés pour clarifier le diagnostic ou pour préparer les patients à la chirurgie. Le sondage cardiaque est utilisé sous le contrôle de la télévision à rayons X. Technique d'exécution de la méthode: en ponctionnant une grosse artère sous anesthésie locale avec introduction supplémentaire d'un cathéter spécial dans la cavité cardiaque, le gradient de pression (différence) entre le ventricule gauche et l'aorte qui en part est mesuré. Normalement, ce gradient ne devrait pas l'être. Cependant, avec HCM, il existe une différence de pression entre le ventricule gauche et l'aorte de 50 à 150 mm Hg. Art., une augmentation de la pression télédiastolique dans la cavité du ventricule gauche jusqu'à 18 mm Hg. Art. Le gradient de pression diminue après l'introduction des β-bloquants. De plus, lors du sondage du cœur, un agent de contraste est injecté dans la cavité du ventricule (ventriculographie) pour étudier ses caractéristiques anatomiques. Chez un certain nombre de patients (en règle générale, il s'agit de personnes de plus de 40 ans), l'angiographie des artères coronaires (angiographie coronarienne) est utilisée simultanément avant la chirurgie cardiaque pour clarifier l'étiologie de l'angine de poitrine et exclure une maladie coronarienne concomitante. traitement. La base du traitement médicamenteux de l'HCM repose sur des médicaments qui améliorent le flux sanguin vers les ventricules du cœur en diastole. Ces médicaments sont un groupe de β-bloquants (anapriline, aténolol, métoprolol et propranolol, 160-320 mg/jour, etc.) et un groupe d'antagonistes des ions calcium (vérapamil, mais avec prudence). Le novokinamide et le disopyramide réduisent également la fréquence cardiaque et ont un effet antiarythmique. Au tout début du traitement, de petites doses de ces médicaments sont utilisées, puis la posologie est progressivement augmentée jusqu'au maximum toléré par le patient. Les β-bloquants sont utilisés avec prudence dans le diabète sucré, l'asthme bronchique et certaines autres maladies. Lors du traitement avec ces médicaments, une surveillance constante de la pression artérielle et du pouls est nécessaire. Dangereux est une diminution de la pression en dessous de 90/60 mm Hg. Art. et fréquence cardiaque inférieure à 55 par minute. Si un patient présente des troubles du rythme dangereux qui ne peuvent pas être traités avec des β-bloquants ou des antagonistes des ions calcium, d'autres médicaments antiarythmiques sont également utilisés dans le traitement de ces patients. La nomination d'anticoagulants est recommandée pour les arythmies paroxystiques et la fibrillation auriculaire, ainsi qu'en présence de caillots sanguins dans les cavités cardiaques (warfarine, etc.). Pendant la période de traitement avec ces médicaments, il est nécessaire de surveiller régulièrement un certain nombre d'indicateurs du système de coagulation sanguine. Avec un surdosage important d'anticoagulants, des saignements externes (nasaux, utérins, etc.) et internes (hématomes, etc.) sont possibles. Le traitement chirurgical est réalisé chez les patients atteints de CMH obstructive lorsque le traitement médical n'est pas efficace ou lorsque le gradient entre le ventricule gauche et l'aorte est supérieur à 30 mm Hg. Art. (l'opération de myotomie ou de myectomie est réalisée - excision ou ablation d'une partie du myocarde hypertrophié du ventricule gauche). Le remplacement de la valve mitrale et l'ablation IVS non chirurgicale sont également effectués. Prévention. Tous les patients atteints de CMH, notamment ceux présentant une forme obstructive, sont contre-indiqués dans les sports pouvant augmenter significativement l'activité physique sur une courte période (athlétisme, football, hockey). La prévention de la maladie réside dans un diagnostic précoce, qui permet de commencer un traitement précoce de la maladie et de prévenir le développement d'une hypertrophie myocardique sévère. Il est obligatoire de réaliser une échocardiographie chez les parents génétiques du patient. L'ECG de dépistage et l'EchoCG, réalisés lors d'un examen médical annuel, sont également importants pour le diagnostic. Chez les patients présentant une forme obstructive de HCM, il est nécessaire de prévenir l'endocardite infectieuse (prophylaxie antibiotique, etc.), car la présence d'une obstruction crée les conditions propices au développement de cette affection potentiellement mortelle. CONFÉRENCE № 4. Maladies du système cardiovasculaire. Cardiomyopathie restrictive Cardiomyopathie restrictive (RCMP) - (du mot latin restrictio - "restriction") - un groupe de maladies du myocarde et de l'endocarde, dans lesquelles, à la suite d'une fibrose prononcée et d'une perte d'élasticité, pour diverses raisons, il existe une restriction fixe du remplissage des ventricules en diastole. Le remplissage des ventricules s'effectue dans la phase de remplissage précoce, suivi d'une stabilisation de la pression intraventriculaire. La maladie s'accompagne d'un apport sanguin insuffisant au cœur, ce qui conduit en outre au développement d'une insuffisance cardiaque chronique. La cardiomyopathie restrictive est la moins étudiée et la moins fréquente de toutes les cardiomyopathies. La GRC comprend : l'endocardite fibroplastique pariétale de Lefler (trouvée dans les pays à climat tempéré, décrite par W. Loffler et al., 1936) et la fibrose endomyocardique (trouvée dans les pays d'Afrique tropicale, décrite par D. Bedford et E. Konstman). Auparavant, ils étaient considérés comme deux processus pathologiques indépendants. Cependant, le tableau pathomorphologique de ces maladies diffère peu. Causes de la MCR. Le RCM primaire est très rare et la seule cause prouvée de son apparition est le syndrome dit hyperéosinophile (maladie de Leffler, endocardite fibroplasique pariétale de Leffler). Elle survient principalement chez les hommes âgés de 30 à 40 ans. Avec le syndrome hyperéosinophile, une inflammation de l'endocarde se produit, qui aboutit au fil du temps à un compactage important de l'endocarde et à son adhésion grossière au myocarde adjacent, ce qui entraîne une forte diminution de l'extensibilité du muscle cardiaque. Le syndrome de Lefler est également caractérisé par une éosinophilie persistante pendant 6 mois ou plus (1500 1 éosinophiles par XNUMX mm3), lésions des organes internes (foie, reins, poumons, moelle osseuse). Dans la grande majorité des cas, l'origine de la GRC est secondaire, pour d'autres raisons, parmi lesquelles les plus courantes sont : 1) amylose - une maladie associée à une violation du métabolisme des protéines dans le corps; en même temps, une protéine anormale (amyloïde) se forme et se dépose en grande quantité dans les tissus de divers organes ; lorsque le cœur est endommagé, l'amyloïde provoque une diminution de sa contractilité et de son extensibilité ; 2) hémochromatose - une violation du métabolisme du fer dans le corps, accompagnée d'une augmentation de la teneur en fer dans le sang, son excès se dépose dans de nombreux organes et tissus, y compris le myocarde, entraînant ainsi une diminution de son extensibilité ; 3) sarcoïdose - une maladie d'étiologie inconnue, caractérisée par la formation d'amas cellulaires (granulomes) dans les organes et les tissus; les poumons, le foie, les ganglions lymphatiques et la rate sont le plus souvent touchés ; et le développement de granulomes dans le myocarde entraîne une diminution de son extensibilité ; 4) les maladies endocardiques (fibrose endocardique, fibroélastose endocardique, etc.), lorsqu'il existe un épaississement et un compactage importants de l'endocarde, ce qui entraîne également une forte limitation de l'extensibilité myocardique. La fibroélastose de l'endocarde, en particulier, ne peut survenir que chez les nourrissons ; cette maladie n'est pas compatible avec la vie en raison du développement précoce d'une insuffisance cardiaque sévère. pathogénèse. Avec le RCM, la conformité myocardique souffre pour diverses raisons. En conséquence, le remplissage des ventricules avec du sang diminue et la pression intraventriculaire augmente considérablement. Cependant, contrairement à la HCM, la possibilité de développer une hypertrophie myocardique compensatoire dans la cardiomyopathie restrictive est faible. Ainsi, après un certain temps, la circulation pulmonaire stagne et la fonction de pompage du cœur diminue, ce qui entraîne une rétention d'eau progressive dans le corps, le développement d'un gonflement persistant des jambes, une hépatomégalie et une ascite. Si le compactage de l'endocarde s'étend aux valves auriculo-ventriculaires (mitrale et tricuspide), cela est aggravé par le développement de leur insuffisance et conduit également à une thrombose dans les cavités cardiaques en raison de leur contractilité et de leur extensibilité réduites. La propagation de fragments de ces caillots sanguins avec la circulation sanguine peut provoquer une thromboembolie et un blocage des gros vaisseaux, des crises cardiaques des organes internes. Avec la propagation des inclusions pathologiques du myocarde dans la zone du système de conduction du cœur, diverses perturbations de la conduction de l'impulsion cardiaque peuvent apparaître, accompagnées du développement de blocages. Avec la GRC, divers types d'arythmies sont également assez souvent observés. Sur la base de ce qui précède, nous pouvons conclure que la maladie d'un point de vue pathogénétique se déroule en 3 étapes. Stade I - nécrotique - infiltration éosinophile du myocarde et d'autres organes. Stade II - thrombotique - la formation de caillots sanguins dans les cavités des ventricules gauche et droit, le développement de complications thromboemboliques et l'épaississement progressif de l'endocarde principalement dans les régions apicales et près des valves auriculo-ventriculaires. Stade III - fibreux, caractérisé par un épaississement de l'endocarde jusqu'à plusieurs millimètres, la fibrose myocardique est exprimée - principalement les zones sous-endocardiques. La cavité est partiellement oblitérée en raison de thrombus organisés, une fibrose des cuspides de la valve mitrale, une régurgitation mitrale sont notées. Dilatation auriculaire prononcée. Une dysfonction diastolique restrictive est observée. Image clinique. Les manifestations de la maladie sont extrêmement polymorphes et sont déterminées par des symptômes de troubles circulatoires dans le petit ou le grand cercle (en fonction de l'atteinte prédominante du ventricule droit ou gauche). Les plaintes peuvent être absentes ou peuvent être dues à une congestion de la circulation pulmonaire ou systémique. Les patients se plaignent généralement d'essoufflement, qui apparaît pour la première fois pendant l'exercice, et à mesure que la maladie progresse, un essoufflement est observé au repos. En raison d'une diminution de la fonction de pompage du cœur, le patient se plaint de fatigue et d'une mauvaise tolérance à toute charge. Au fil du temps, un gonflement des jambes, une hypertrophie du foie et une hydropisie de l'abdomen se rejoignent. Périodiquement, un rythme cardiaque irrégulier apparaît et, avec le développement de blocages persistants, des évanouissements peuvent survenir. La première étape du développement de la maladie (nécrotique) se caractérise par l'apparition de fièvre, d'une perte de poids, d'une toux, d'une éruption cutanée et d'une tachycardie. diagnostics. Reconnaître RCM est extrêmement difficile. On ne peut parler avec confiance de cette pathologie qu'après avoir exclu un certain nombre de maladies similaires (telles que la myocardite idiopathique de type Abramov-Fiedler, la péricardite exsudative, les malformations cardiaques valvulaires). Lors de l'examen des patients atteints de la GRC, des symptômes caractéristiques de l'insuffisance cardiaque congestive (œdème, hépatomégalie et ascite), ainsi qu'une pulsation prononcée des veines du cou, sont trouvés. Cette dernière est due à la difficulté d'approvisionnement en sang du cœur en raison d'une mauvaise extensibilité myocardique. Lors de l'auscultation, la détection d'une hypertrophie cardiaque, d'un souffle systolique tardif doux et d'un fort tonus III précoce (dû au remplissage rapide des ventricules pendant la diastole) est d'une grande importance. Des souffles cardiaques sont également détectés chez les patients présentant une insuffisance valvulaire auriculo-ventriculaire. Une étude ECG révèle une hypertrophie modérée du myocarde ventriculaire, ainsi que divers troubles du rythme et de la conduction de l'impulsion cardiaque, des modifications non spécifiques de l'onde T sur l'ECG. L'échocardiographie est l'une des méthodes les plus informatives pour diagnostiquer la maladie, avec son aide, un épaississement de l'endocarde, une modification de la nature du remplissage des ventricules du cœur, une diminution de la fonction de pompage du cœur, un mouvement rapide du feuillet antérieur de la valve mitrale pendant la diastole et un mouvement précoce rapide de la paroi postérieure du ventricule gauche vers l'extérieur sont détectés. L'imagerie par résonance magnétique vous permet d'obtenir des informations sur l'anatomie du cœur, de déterminer les inclusions pathologiques dans le myocarde et de mesurer l'épaisseur de l'endocarde. Lors de l'examen des paramètres de l'hémodynamique centrale, une pression de remplissage accrue dans les deux ventricules est déterminée et la pression finale dans le ventricule gauche dépasse celle du ventricule droit. La ventriculographie révèle une contraction accrue du ventricule gauche, des contours lisses de ses parois, parfois avec un défaut de remplissage à l'apex (preuve d'oblitération). Dans certains cas, des dépressions dans la région des muscles papillaires sont déterminées. Il existe des signes d'insuffisance valvulaire, en particulier de la valve mitrale ou tricuspide. Diagnostic différentiel. Dans le diagnostic différentiel de la RCM, il est très important de prendre en compte la similitude de la maladie dans ses manifestations externes avec la péricardite constrictive, mais la méthode de traitement de ces maladies est diamétralement opposée. La biopsie intravitale du myocarde et de l'endocarde est généralement utilisée simultanément au sondage cardiaque, ce qui permet d'obtenir plus d'informations pour clarifier la nature de la maladie et la poursuite du traitement. Dans des cas extrêmement rares, lorsque les méthodes de diagnostic ci-dessus ne permettent pas de distinguer la MCR de la péricardite constrictive, une inspection directe du péricarde est réalisée sur la table d'opération. Tous les patients atteints de la GRC ont besoin d'un examen clinique, biochimique et supplémentaire complet pour déterminer les causes non cardiaques de la maladie. traitement. Le traitement de la maladie présente des difficultés importantes. La plupart des médicaments utilisés pour traiter l'insuffisance cardiaque peuvent ne pas apporter les résultats souhaités car, en raison des caractéristiques de la maladie, il est impossible d'obtenir une amélioration significative de la compliance myocardique (dans certains cas, des antagonistes des ions calcium sont prescrits). à ces fins). Les diurétiques (aldactone) sont utilisés pour éliminer l'excès de liquide dans le corps. Pour éliminer les troubles persistants de la conduction, il peut être nécessaire d'installer (implanter) un stimulateur cardiaque permanent. Ceci est causé par des maladies telles que la sarcoïdose et l'hémochromatose, conduisant au développement de GRC secondaires, ils sont soumis à l'auto-traitement. Dans le traitement de la sarcoïdose, des médicaments hormonaux (prednisolone, etc.) sont utilisés, et dans l'hémochromatose, des saignées régulières (pour réduire la concentration de fer dans le corps). Le traitement de l'amylose myocardique dépend directement des causes de son apparition. Il est conseillé d'utiliser des médicaments anticoagulants pour la thrombose dans les cavités cardiaques. Le traitement chirurgical est utilisé dans les cas de GRC causés par des lésions endocardiques. Pendant l'opération, si possible, la partie de l'endocarde qui a subi des modifications est excisée. Dans certains cas, en cas d'insuffisance des valves auriculo-ventriculaires, leur prothèse est réalisée. Certaines formes de lésions myocardiques amyloïdes sont traitées par une greffe cardiaque. Prévention de la GRC. Malheureusement, les mesures préventives contre cette maladie sont limitées. Il est principalement nécessaire d'identifier précocement les causes potentiellement évitables de l'amylose, de la sarcoïdose, de l'hémochromatose, etc.. Pour atteindre ces objectifs, un examen médical annuel de la population est d'une grande importance. CONFÉRENCE N ° 5. Maladies du système cardiovasculaire. Endocadite infectieuse Endocardite infectieuse (EI) - une maladie consistant en une polypose-lésion ulcéreuse de l'appareil valvulaire du cœur (souvent avec développement d'une insuffisance valvulaire) ou de l'endocarde pariétal (moins souvent, l'endothélium de l'aorte ou la grosse artère la plus proche est touchée). La maladie est causée par divers micro-organismes pathogènes et s'accompagne d'une lésion systémique des organes internes (reins, foie, rate) dans le contexte d'une réactivité altérée de l'organisme. Jusqu'à présent, dans diverses publications imprimées, les termes précédemment utilisés "endocardite bactérienne", "endocardite septique prolongée" se retrouvent pour désigner ce processus pathologique. Cependant, c'est le terme "endocardite infectieuse" qui les a remplacés qui reflète mieux la cause de la maladie causée par une grande variété de micro-organismes - agents bactériens, rickettsies, virus et champignons. Le nombre de patients atteints d'EI augmente dans le monde. Cela est dû à la présence de groupes dits à risque (patients atteints d'athérosclérose, de rhumatismes, de lésions valvulaires traumatiques, d'anomalies cardiaques ou valvulaires, d'une communication interventriculaire, d'une coarctation aortique) du fait que l'infection survient plus facilement sur un site pathologiquement altéré. valve ou endocarde. Étiologie. Les agents pathogènes responsables de la maladie sont le plus souvent le groupe de micro-organismes cocciques - les streptocoques (le streptocoque viridans était auparavant isolé dans 90% des cas), les staphylocoques (dorés, blancs), les entérocoques, les pneumocoques. Ces dernières années, en raison de l’utilisation généralisée des antibiotiques, la gamme d’agents pathogènes microbiens a changé. La maladie peut être provoquée par une flore à Gram négatif (Escherichia coli, Pseudomonas aeruginosa, Proteus, Klebsiella) ; des preuves ont été mises en évidence sur le rôle important des champignons pathogènes, Sarcinus, Brucella et des virus. Les maladies causées par ces agents pathogènes sont plus graves, en particulier l'endocardite causée par une infection fongique (survient généralement en raison de l'utilisation irrationnelle d'antibiotiques). Cependant, chez un certain nombre de patients, le véritable agent causal de la maladie n'est pas détecté (la fréquence des résultats d'hémoculture négatifs est de 20 à 50 %). Souvent, l'infection se produit au site d'une prothèse valvulaire - la soi-disant prothèse EI, qui se développe principalement dans les 2 mois suivant la chirurgie de remplacement de la valve cardiaque. Dans ce cas, l'agent causal de la maladie a le plus souvent une nature streptococcique. Ainsi, les sources d'infection et de bactériémie dans l'EI sont très différentes (chirurgies dans la cavité buccale, opérations et procédures diagnostiques dans la région urogénitale, intervention chirurgicale sur le système cardiovasculaire (y compris le remplacement valvulaire), séjour prolongé du cathéter dans une veine, perfusions intraveineuses fréquentes et méthodes de recherche endoscopique, hémodialyse chronique (shunt artério-veineux), administration intraveineuse de médicaments). Il existe des IE dites primaires, qui se sont développées sur des valves intactes, ainsi que des IE dans le contexte de modifications congénitales et acquises du cœur et de son appareil valvulaire - endocardite secondaire. Ces modifications permettent de distinguer les patients en groupes à risque distincts : malformations cardiaques (congénitales et acquises), prolapsus valvulaire mitral, anévrismes artério-veineux, anévrismes post-infarctus, shunts, état après chirurgie du cœur et des gros vaisseaux. pathogénèse. Le mécanisme de développement de l'IE est complexe et insuffisamment étudié, cependant, les principaux points du développement de la maladie peuvent être identifiés. S'il existe un foyer d'infection dans le corps sous l'influence d'une immunité humorale et locale (cellulaire) altérée avec une perversion des réactions immunologiques, divers facteurs endogènes et exogènes, une bactériémie se développe. À partir du sang, les micro-organismes pénètrent dans les valves cardiaques, y créant un foyer secondaire d'infection. La fixation et la reproduction de micro-organismes sur l'endocarde sont facilitées par un certain nombre de facteurs: une modification antérieure du tissu et de la surface de la valve, la présence de masses thrombotiques sur celle-ci, survenant sous l'influence de l'effet dommageable direct de la circulation sanguine lorsque sa circulation intracardiaque change dans les conditions d'une maladie cardiaque existante. Dans le même temps, diverses cellules sanguines (plaquettes, etc.) «collent» au site de la lésion traumatique, formant des excroissances cellulaires ressemblant à des glaçons suspendus à la valve. Ces végétations deviennent disponibles pour l'infection qui a pénétré dans le lit vasculaire. La déformation des valves due à l'apparition d'un gradient de pression important, l'étroitesse du trou et les modifications de la vitesse du flux sanguin contribuent également à l'introduction d'agents infectieux dans l'endocarde avec la formation d'un foyer infectieux. Lorsqu'une valve précédemment intacte est endommagée, des changements se produisent qui perturbent les propriétés normales des sections individuelles de cette valve (un gonflement apparaît), des processus exsudatifs ou prolifératifs ("valvulite interstitielle" - phase préclinique). Dans le développement de la maladie, on distingue le stade III. Le stade I (infectieux-toxique) se déroule avec divers degrés de gravité de l'intoxication. Il y a une croissance de bactéries, la destruction des valvules, conduisant au développement de maladies cardiaques ; au même stade, une généralisation du processus se produit souvent en raison de la propagation hématogène de l'infection - des morceaux de cuspides ou des colonies de micro-organismes peuvent se séparer de la valve, les cuspides peuvent se rompre. Le détachement de morceaux de végétation microbienne valvulaire contribue à l'introduction d'emboles infectés dans diverses parties du lit vasculaire et exacerbe les manifestations septiques. Des morceaux de la valve ou des végétations microbiennes circulent dans le corps avec le flux sanguin, lorsqu'ils pénètrent dans le cerveau, ils provoquent des infarctus cérébraux, qui s'accompagnent de paralysie, de parésie et de divers autres troubles neurologiques. La valve, qui a subi une destruction, ne peut pas remplir sa fonction, et bientôt il y a une insuffisance cardiaque qui se développe rapidement comme l'éclair. Stade II - immuno-inflammatoire, dans lequel les micro-organismes fixés sur les valves provoquent une autosensibilisation prolongée et des lésions hyperergiques des organes et des tissus du corps (généralisation immunitaire du processus). Pendant cette période, les complexes immuns circulent dans le sang et se fixent dans les tissus (cœur, reins, foie, vaisseaux sanguins). Les troubles immunitaires et auto-immuns provoquent le développement de vascularites et de viscérites (néphrite immunocomplexe, myocardite, hépatite, capillarite, etc.). Le stade III - dystrophique - survient avec la progression du processus pathologique: les fonctions d'un certain nombre d'organes sont perturbées, une insuffisance cardiaque et rénale survient, aggravant encore l'évolution de la maladie. Classification. Actuellement, la classification et la nomenclature de l'IE sont utilisées, reflétant la forme clinique, la variante d'évolution, le degré d'activité, la phase pathogénétique et la forme clinique et morphologique de la maladie (voir tableau 6). Tableau 6 Classification de l'EI
Une distinction est également faite entre les EI actifs et inactifs (guéris). Il existe également une classification chirurgicale, dans laquelle il y a: 1) la lésion est limitée aux feuillets valvulaires ; 2) la lésion s'étend au-delà de la valve. L'EI aiguë (rapidement progressive, se développe en 8 à 10 semaines) est rare, généralement chez les personnes qui n'ont jamais eu de maladie cardiaque auparavant, et se manifeste cliniquement par un tableau de septicémie générale. Avec les méthodes de traitement modernes, il est possible de le traduire en subaiguë. L'EI subaiguë (la plus fréquente) dure 3 à 4 mois, avec un traitement médicamenteux adéquat, une rémission peut survenir. Cependant, des rechutes de la maladie sont possibles. L'EI prolongée dure plusieurs mois avec des périodes d'exacerbation et de rémission, elle se caractérise par des manifestations cliniques bénignes, des paramètres de laboratoire mineurs et des troubles généraux. La maladie répond généralement bien au traitement. Avec une évolution défavorable, des complications graves surviennent et les patients meurent d'une insuffisance cardiaque progressive, augmentant l'intoxication septique. Image clinique. Selon l'agent causal de l'infection, l'IE peut survenir soudainement et se développer rapidement (Staphylococcus aureus, entérocoques) ou avoir un début latent (streptocoque viridans). Les manifestations de l'IE se présentent sous forme de syndromes. 1) Syndrome de modifications inflammatoires et septicémie (fièvre, frissons, éruptions cutanées hémorragiques, modifications des paramètres sanguins de la phase aiguë : hyperleucocytose avec déplacement vers la gauche, augmentation de la VS, apparition de la protéine C-réactive, augmentation du fibrinogène, α2-globulines. 2) Le syndrome d'intoxication générale du corps (faiblesse, transpiration, maux de tête, myalgies et arthralgies, perte d'appétit, pâleur de la peau avec une teinte ictérique). 3) Syndrome de lésion valvulaire (formation d'une maladie cardiaque). 4) Syndrome des troubles immunitaires "de laboratoire" (présence de complexes immuns circulant dans le sang ou fixés dans les reins, le myocarde, les vaisseaux sanguins ; hypergammaglobulinémie ; apparition de facteur rhumatoïde ; détection d'anticorps anti-tissus). 5) Syndrome de complications thromboemboliques (néphrite focale, infarctus du myocarde, rate, intestins, thromboembolie cérébrale, vaisseaux des membres inférieurs, etc.). 6) Syndrome de généralisation des lésions (glomérulonéphrite diffuse, myocardite, hépatite, vascularite, etc.). La gravité de ces syndromes est différente. Cela dépend de la nature de l'évolution de l'IE, du stade, du type d'agent pathogène. Par exemple, l'IE staphylococcique se caractérise par une activité élevée du processus, des symptômes graves d'intoxication générale et le développement de complications purulentes. L'endocardite fongique s'accompagne généralement d'une occlusion embolique des grosses artères, en particulier des membres inférieurs. Une image typique de la maladie est caractéristique de l'EI causée par le streptocoque viridans. L'apparition de la maladie est souvent associée à une infection aiguë ou à l'exacerbation d'une infection chronique, ainsi qu'à un certain nombre de manipulations médicales. La combinaison d'une augmentation de la température corporelle à des degrés divers (de la fièvre prolongée à un état subfébrile ou à une température normale) avec des frissons et de la transpiration est particulièrement caractéristique. Le patient se plaint simultanément de la présence d'un processus infectieux et d'une intoxication, ainsi que de complications thromboemboliques de lésions cardiaques. Les patients peuvent avoir des antécédents d'épisodes de traitement antibiotique à long terme (cela se produit lorsque l'EI se reproduit chez des patients précédemment traités). diagnostics. La détection des lésions des valvules cardiaques par des modifications du schéma auscultatoire des malformations cardiaques préexistantes est de la plus haute importance pour établir un diagnostic correct ; l’apparition de bruits « supplémentaires ». Des lésions caractéristiques de la peau et des muqueuses sont révélées : couleur de peau café au lait, hémorragies, symptômes positifs de Hecht (pincement) et de Konchalovsky-Rumpel-Leede (garrot), ainsi que ganglions d'Osler - nodules denses hyperémiques douloureux sur la surface palmaire et bout des doigts , signe Lukin-Libman (taches Lukin) - hémorragie sur le pli transitionnel de la conjonctive. La splénomégalie est souvent observée dans l'IE. Une perte de poids importante (parfois 15 à 20 kg) est très courante. Dans de rares cas, une péricardite se développe (un léger bruit de frottement pleural provoqué par des dépôts fibrineux sur le péricarde). L'examen physique peut révéler une augmentation de la pression artérielle, indiquant le développement d'une glomérulonéphrite diffuse. Parfois, des signes de dysfonctionnement du système nerveux central (parésie, hyperkinésie, réflexes pathologiques, etc.) résultant d'une embolie vasculaire cérébrale sont déterminés. Dans ce cas, l'erreur de diagnostic la plus courante est l'évaluation d'un syndrome particulier en tant que manifestation d'une maladie indépendante (par exemple, avec des signes prononcés de lésions hépatiques, une hépatite est diagnostiquée, etc.). Cependant, le diagnostic d'EI repose principalement sur la détection précoce de l'agent causal de la maladie. Pour cela, les études de laboratoire et instrumentales suivantes sont utilisées. 1) L'obtention d'une hémoculture positive est le signe diagnostique le plus important de l'EI. Une analyse est également nécessaire pour sélectionner l'antibiotique le plus efficace dans ce cas. Au moins 2-3 d'entre eux sont nécessaires pour confirmer le diagnostic. D'une grande importance sont la technique de prélèvement sanguin et de culture, le moment de l'inoculation (de préférence au plus fort de la fièvre), l'utilisation de milieux enrichis. 2) Réalisation du NBT (test au nitrobluttétrazolium) - diagnostic des infections bactériennes systémiques, qui permet de différencier les infections bactériennes des autres maladies inflammatoires. La méthode est basée sur la réduction du colorant NBT soluble par les neutrophiles en un précipité de formazan insoluble. Si le nombre de cellules NBT-positives est supérieur à 10 %, le test est considéré comme positif. 3) Un test sanguin clinique pour détecter les indicateurs de phase aiguë: une augmentation de la VS à 50 mm / h ou plus, une leucocytose avec un déplacement de la formule leucocytaire vers la gauche ou (au stade II) une leucopénie et une anémie hypochrome peuvent être détectées. La valeur diagnostique est attachée à la détection des histiocytes dans le sang prélevé au niveau du lobe de l'oreille. Leur contenu supérieur à 6 dans le champ de vision peut indiquer en faveur d'IE. Un test sanguin biochimique montre une augmentation de la teneur en fibrinogène, α2-globulines et α-globulines - jusqu'à 30-40%. 4) Identification des modifications immunologiques : hypergammaglobulinémie, complexes immuns circulants, diminution du titre du complément, apparition du facteur rhumatoïde (antiglobuline), réaction accrue de transformation impérieuse des lymphocytes avec la PHA (phytohémagglutinine) et les antigènes bactériens, détection des anticorps anti-tissus . 5) Une analyse d'urine est effectuée pour clarifier les lésions de divers organes et systèmes, lorsqu'une glomérulonéphrite est détectée, se manifestant par une protéinurie, une cylindrurie et une hématurie. Une augmentation de la teneur en bilirubine, les transaminases indique des dommages au foie. 6) Un signe diagnostique direct d'EI - la présence de végétation sur les valves cardiaques - est détecté par échocardiographie. Ainsi, parmi toute la variété des symptômes, il convient de distinguer les principaux et les autres. Les principaux critères pour le diagnostic d'IE: 1) fièvre avec une température supérieure à 38°C avec frissons ; 2) Taches de Lukin ; 3) les nodules d'Osler ; 4) endocardite sur valves inchangées (primaires) ou dans le contexte de malformations cardiaques rhumatismales et congénitales. myocardite infectieuse; 5) thromboembolie artérielle multiple, ruptures d'anévrismes mycosiques avec hémorragies ; 6) splénomégalie ; 7) hémoculture positive ; 8) un effet positif prononcé de l'utilisation d'antibiotiques. Critères supplémentaires pour le diagnostic d'EI : 1) une augmentation de la température corporelle jusqu'à 38 ° C, un refroidissement; 2) hémorragies sur la peau; 3) perte de poids rapide ; 4) l'arthrite asymétrique des petites articulations des mains, des pieds ; 5) anémisation ; 6) ESR supérieur à 40 mm/h ; 7) SRV fortement positif ; 8) la présence de facteur rhumatoïde ; 9) α-globulines supérieures à 25 % ; 10) augmentation de la teneur en immunoglobulines M, E et A. Diagnostic différentiel. Bien que la thromboembolie soit le plus souvent observée dans l'IE, d'autres causes d'embolie dans l'artère de la circulation systémique ne doivent pas être exclues : infarctus du myocarde transmural et anévrisme cardiaque, myocardite d'Abramov-Fiedler idiopathique et fibrillation auriculaire d'origines diverses, mais principalement observées dans la sténose rhumatismale. de l'orifice auriculo-ventriculaire gauche. Les endocardites rhumatismales et infectieuses sont de la plus haute importance pour le diagnostic différentiel (tableau 7). Tableau 7 Critères diagnostiques différentiels de l'endocardite rhumatismale et de l'EI prolongée
Les symptômes caractéristiques de l'IE comprennent une hypertrophie de la rate. Cependant, une grosse rate ferme et indolore est observée dans l'amylose; doux, indolore indique son hyperplasie septique. La douleur est notée avec un infarctus de la rate, situé sous la capsule. La splénomégalie peut être l'une des manifestations de l'hypertension portale au cours de l'insuffisance cardiaque droite. Dans ce cas, il est associé à une ascite et à une hépatomégalie. Une augmentation de la taille du foie avec une EI prolongée est observée assez souvent. L'hyperplasie septique est caractérisée par un élargissement relativement faible et une consistance molle du foie. Il y a une dégénérescence graisseuse et extrêmement rarement - des infarctus du foie. Le plus souvent, une augmentation du foie est associée à une congestion veineuse avec insuffisance cardiaque droite. En l'absence d'ascite, la congestion est reconnue rétrospectivement par une diminution de la taille du foie après traitement par glycosides cardiaques et diurétiques. traitement. Le traitement de l'IE doit être le plus précoce et étiotrope possible, en tenant compte des données bactériologiques. Avant que les médicaments antibactériens ne soient largement utilisés dans la pratique médicale, la plupart des patients atteints d'IE mouraient de l'infection et de ses complications. Aujourd’hui, plus de 80 % sont guéris avec succès. Mais pour près de 20 %, le traitement médicamenteux est inefficace et ils développent rapidement une insuffisance cardiaque, quasiment incurable. À cet égard, une combinaison de traitement conservateur et chirurgical est conseillée. Pour le traitement de l'EI dans tous les groupes d'âge, on utilise principalement des antibiotiques qui ont un effet bactéricide sur les micro-organismes, de préférence à des doses individualisées en fonction de la concentration de l'antibiotique dans le sang et de la sensibilité de l'agent pathogène à celui-ci. Le médicament de premier choix est toujours la pénicilline. Il a une faible toxicité, ce qui lui permet d'être utilisé pendant longtemps à des doses relativement élevées. La dose quotidienne - jusqu'à 20 000 000 UI est administrée par voie intraveineuse et intramusculaire. Cependant, il ne faut pas exclure le fait que chez les patients âgés et séniles, lorsqu'ils sont traités avec de la pénicilline et d'autres antibiotiques à fortes doses, un effet cardiotoxique est souvent observé: apparition ou intensification d'une insuffisance cardiaque, douleurs cardiaques, tachycardie. Lorsque la dose est réduite ou que le médicament est changé, ces phénomènes s'arrêtent. D'étiologie inconnue, le traitement débute par de fortes doses de benzylpénicilline par voie intramusculaire ou intraveineuse jusqu'à 18 000 000-20 000 000 unités ou plus, une association avec la streptomycine jusqu'à 1 g/m4 par jour ou des aminoglycosides (gentamicine, tobramycine à raison de 6-12 mg / jour) est utilisé. kg par jour). En l'absence d'effet ou après détermination de l'agent pathogène, des pénicillines semi-synthétiques sont utilisées (oxacilline, méthicilline ou ampicilline par voie intramusculaire jusqu'à 4 g/jour). Les céphalosporines sont également les médicaments de base utilisés pour traiter l'EI : les plus couramment utilisés sont le claforan, la céfamisine (10-10 g/jour, intramusculaire et intraveineuse), ainsi que la zéporine (16-8 g/jour) et le kefzol (jusqu'à 10 -2 g par voie intraveineuse). et etc.). Fusidin a un bon effet anti-staphylococcique, dans certains cas, il est efficace dans la résistance des micro-organismes à d'autres antibiotiques (3-XNUMX g / jour). Le traitement antibiotique est prescrit pendant une longue période de 1,5 à 2 mois, jusqu'à ce que l'infection soit complètement éliminée. Après l'élimination de l'infection, l'état général du patient s'améliore, la végétation disparaît selon l'échocardiographie et la confirmation microbiologique. Avec une immunoréactivité réduite de l'organisme, les agents antibactériens sont associés à une immunothérapie passive (par exemple, avec une endocardite staphylococcique - avec du plasma antistaphylococcique ou de l'α-globuline antistaphylococcique), en utilisant des immunomodulateurs (thymaline, T-activine, etc.). Pour prévenir la thrombose, par exemple, avec une endocardite qui s'est développée dans le contexte d'une septicémie angiogénique, une hypocoagulation contrôlée est créée à l'aide d'héparine (20 000 à 25 000 UI par voie intraveineuse ou sous-cutanée). Pour l'inhibition des enzymes protéolytiques, le contrical est utilisé (jusqu'à 40 000-60 000 UI par voie intraveineuse). Lorsque l'EI valvulaire a contribué à la formation d'une cardiopathie valvulaire ou que les manifestations de la maladie ne disparaissent pas malgré une antibiothérapie massive, il est conseillé d'effectuer un traitement chirurgical. Un argument supplémentaire en faveur de l'intervention chirurgicale est l'embolie répétée des feuillets valvulaires cardiaques détruits par l'infection. Parfois, l'infection dépasse les limites de l'anneau valvulaire, tout en formant des abcès, ce qui est également une indication de traitement chirurgical. L'objectif principal de l'opération est de préserver la propre valve du patient. Parfois, ils se limitent à enlever les végétations, suturer les ruptures des valves, etc. Si la valve est presque complètement détruite sous l'effet de l'infection, elle est remplacée par une artificielle (prothèse) à l'aide de prothèses mécaniques et biologiques. Prévention. La prévention de l'IE consiste en l'assainissement rapide des foyers d'infection chroniques dans la cavité buccale, les amygdales, le nasopharynx, les sinus paranasaux et l'utilisation d'un traitement antibactérien actif pour les maladies streptococciques et staphylococciques aiguës (angine de poitrine, etc.). Il est recommandé de durcir le corps. Tous les patients atteints de cardiopathie valvulaire, ainsi que porteurs de prothèses valvulaires, doivent prendre des antibiotiques à titre prophylactique la veille et peu de temps après toute intervention, après quoi une infection peut pénétrer dans la circulation sanguine. L'observation au dispensaire des personnes qui ont eu des infections aiguës à streptocoques et staphylocoques est nécessaire. CONFÉRENCE N ° 6. Maladies du système respiratoire. L'asthme bronchique Une définition exhaustive de l'asthme n'existe pas à ce jour, cependant, la définition la plus complète de cette maladie a été donnée par G. B. Fedoseev en 1982. L'asthme bronchique (BA) est une maladie indépendante, chronique et récurrente avec une lésion primaire des voies respiratoires, dont le mécanisme pathogénique principal et obligatoire est une altération de la réactivité bronchique due à des mécanismes spécifiques (immunologiques) et (ou) non spécifiques, congénitaux ou acquis, et dont le signe clinique principal (obligatoire) est une crise d'asthme et (ou) un état asthmatique (état asthmatique) dû à un spasme des muscles lisses bronchiques, une hypersécrétion, une dyscrinie et un œdème de la muqueuse bronchique. Étiologie. Une combinaison de plusieurs facteurs joue un rôle important dans la survenue de l'asthme. À cet égard, il existe 2 formes d'asthme - atopique (du latin athopia - « prédisposition héréditaire ») et infectieux-allergique. La prédisposition héréditaire est due à l'association de certains antigènes d'histocompatibilité (HLA) avec la gravité de l'asthme, et une augmentation de la gravité de la maladie est particulièrement souvent observée chez les porteurs d'antigènes B.35 et B40. Les facteurs internes au développement de la maladie sont les défauts biologiques des systèmes immunitaire, endocrinien, du système nerveux autonome, la sensibilité et la réactivité bronchiques, la clairance mucociliaire, l'endothélium vasculaire pulmonaire, le système de réponse rapide (mastocytes, etc.), le métabolisme de l'acide arachidonique, etc. Les facteurs externes comprennent : 1) allergènes infectieux (virus, bactéries, champignons, levures, etc.) ; 2) allergènes non infectieux (pollen, poussières, industriels, médicinaux, alimentaires ; allergènes de tiques, d'insectes et d'animaux) ; 3) irritants mécaniques et chimiques (métal, bois, silicate, poussière de coton ; vapeurs d'acides, d'alcalis ; fumées, etc.) ; 4) facteurs météorologiques et physico-chimiques (changements de température et d'humidité de l'air, fluctuations de la pression barométrique, champ magnétique terrestre, effort physique, etc.); 5) effets stressants, neuropsychiques et activité physique. Les agents infectieux peuvent non seulement avoir un effet allergène, mais également réduire le seuil de sensibilité de l'organisme aux allergènes non infectieux (atopiques), augmenter la perméabilité de la muqueuse respiratoire pour eux; former une modification de la réactivité des cellules cibles (mastocytes, basophiles, monocytes, etc.) et des systèmes effecteurs. pathogénèse. L'altération de la réactivité bronchique est un maillon central dans la pathogenèse de la maladie et peut être primaire ou secondaire. Dans le premier cas, les modifications de réactivité peuvent être congénitales ou acquises en raison d'une exposition directe à des facteurs chimiques, mécaniques, physiques et à une infection. Les modifications secondaires de la réactivité bronchique sont une manifestation de modifications de la réactivité des systèmes immunitaire, endocrinien et nerveux de l'organisme. Ainsi, en parlant de la pathogenèse de la MA, on peut distinguer 2 groupes de mécanismes : immunologiques et non immunologiques. Les mécanismes immunologiques dans la grande majorité des cas sont dominants au cours de la maladie. Les violations du système immunocompétent dans la membrane muqueuse des voies respiratoires, survenant selon les types I, III et IV de réactions d'hypersensibilité, c'est-à-dire avec une modification des immunités humorales et cellulaires, entraînent une modification de la réactivité bronchique. Dans le même temps, il y a une diminution des IgA sécrétoires, le système de phagocytose est perturbé, la fonction T-suppresseur des lymphocytes diminue, la production d'interféron diminue, ce qui conduit finalement à une diminution de la défense antivirale de l'organisme. Type I (atopique, réaginique ou anaphylactique). En réponse à l'ingestion d'antigènes exoallergènes (pollen, protéines animales et végétales, bactéries et médicaments) dans l'organisme, il y a une production accrue d'IgE (réagines), qui se fixent et s'accumulent sur les mastocytes (cellules effectrices primaires). C'est le stade immunologique de la MA. Suite à cela, l'étape pathochimique du processus se développe - dégranulation des mastocytes avec libération de substances vasoactives, bronchospastiques et chimiotactiques (histamine, sérotonine, divers facteurs chimiotactiques, etc.). Ce sont des médiateurs primaires agissant sur les vaisseaux et les cellules cibles (cellules effectrices secondaires) - éosinophiles, neutrophiles, plaquettes, monocytes macrophages. Ces derniers, lorsqu'ils sont exposés à des médiateurs primaires, sécrètent des médiateurs secondaires (leucotriènes, prostaglandines, thromboxanes, facteur d'activation plaquettaire et autres substances appartenant au groupe des eicosanoïdes). Sous l'influence de substances biologiquement actives, le stade physiopathologique de la pathogenèse commence: la perméabilité du lit microcirculatoire augmente, ce qui entraîne le développement d'un œdème, d'une inflammation séreuse et d'un bronchospasme. Cliniquement, cela se manifeste par une violation aiguë de la perméabilité bronchique et le développement d'une crise d'asthme. Une réaction de type III (type immunocomplexe, ou phénomène d'Arthus) se développe sous l'influence d'exoallergènes et d'endoallergènes (autoallergènes dont la formation entraîne la dénaturation des protéines des bronchioles et des alvéoles par suite d'une inflammation infectieuse ou allergique et de l'action de divers irritants). La réaction se produit dans la zone d'excès d'antigène avec la participation d'anticorps précipitants appartenant aux immunoglobulines des classes O et M. L'effet néfaste du complexe antigène-anticorps formé est réalisé par l'activation du complément, la libération d'enzymes lysosomales. Il y a des dommages aux membranes basales, des spasmes des muscles lisses des bronches, une vasodilatation et la perméabilité de la microvasculature augmente. Le type IV (hypersensibilité cellulaire de type retardé) se caractérise par le fait que les lymphocytes sensibilisés ont un effet néfaste. Dans ce cas, les médiateurs de la réaction allergique sont les lymphokines (agissant sur les macrophages, les cellules épithéliales), les enzymes lysosomales et un système kinine activé. Sous l'influence de ces substances, un œdème se développe, un gonflement de la membrane muqueuse, un bronchospasme, une hyperproduction de sécrétions bronchiques visqueuses. La conséquence est une violation aiguë de la perméabilité des bronches, se manifestant par une crise d'étouffement. Les mécanismes non immunologiques sont le principal changement de la réactivité bronchique à la suite d'anomalies biologiques congénitales et acquises. Des mécanismes non immunologiques agissent sur les cellules effectrices primaires ou secondaires ou sur les récepteurs des muscles lisses des bronches, des vaisseaux sanguins, des cellules des glandes bronchiques. Cela modifie la réactivité des cellules cibles et surtout des mastocytes, ce qui s'accompagne d'une production excessive de substances biologiquement actives (histamine, leucotriènes, etc.). En réponse à leur libération, un bronchospasme, un gonflement de la membrane muqueuse, une hyper- et une discrinie des glandes bronchiques se développent. Tout cela modifie considérablement la perméabilité des bronches et provoque une crise d'asthme. La résistance bronchique peut changer de manière conditionnelle et inconditionnelle par réflexe. Par exemple, l'obstruction résultant de l'exposition à l'air froid, de l'inhalation de gaz et de poussières irritants et de l'activité physique est causée par un bronchospasme via le réflexe vagal. Les causes du bronchospasme peuvent également être des lésions des zones effectrices du réflexe bronchoconstricteur vagal ou un blocage des récepteurs β-adrénergiques. Récemment, ils parlent d'un rôle particulier dans la pathogenèse des violations de la perméabilité bronchique de l'insuffisance des glucocorticoïdes et des troubles disovariens. L'insuffisance de glucocorticostéroïdes entraîne le développement d'une hyperréactivité des mastocytes, une diminution de la synthèse des catécholamines et une activation des prostaglandines F2a, ainsi qu'une violation du système immunocompétent (on parle ici de la participation complexe à la pathogenèse de la MA et des mécanismes immunologiques et non immunologiques). L'hyperestrogénémie et l'hypoprogestéronémie agissent sur les récepteurs α et β-adrénergiques, augmentant l'activité des premiers et diminuant l'activité des seconds. Classification. La prédominance de l'un ou l'autre mécanisme dans la pathogenèse de l'asthme permet d'identifier ses diverses caractéristiques pathogénétiques. Actuellement, la classification proposée par G. B. Fedoseev (1982) est utilisée. Étapes du développement de la DA. I - pré-asthme (affections menaçant le développement: bronchite aiguë et chronique, pneumonie aiguë et chronique avec éléments de bronchospasme en association avec une rhinite vasomotrice, urticaire). II - BA cliniquement formé (considéré comme tel après la première attaque ou l'apparition immédiate d'un état de mal asthmatique). Formulaires BA : 1) immunologique ; 2) non immunologique. Mécanismes pathogéniques (variantes cliniques et pathogéniques) de la MA : 1) atopique ; 2) dépendant de l'infection ; 3) auto-immune ; 4) désharmonieux ; 5) déséquilibre neuropsychique ; 6) déséquilibre adrénergique ; 7) déséquilibre cholinergique ; 8) réactivité bronchique primaire altérée. Chez un patient, une combinaison de plusieurs variantes cliniques et pathogéniques est possible. Dans une telle situation, il est nécessaire au moment de l'examen de mettre en évidence la variante principale pour ce patient, ce qui est important pour une thérapie adéquate. Au cours d'un long cours de BA, une modification du mécanisme pathogénique est possible. Gravité de BA : 1) évolution légère (les exacerbations sont rares, 2 à 3 fois par an, les crises d'asthme à court terme sont arrêtées en prenant divers médicaments bronchodilatateurs à l'intérieur); 2) modérée (exacerbations plus fréquentes 3 à 4 fois par an, les crises d'asthme sont plus sévères et arrêtées par des injections de médicaments) ; 3) évolution sévère (caractérisée par des exacerbations fréquentes et prolongées, des crises sévères, se transformant souvent en un état asthmatique). La division du BA selon la sévérité du cours est conditionnelle. Ainsi, avec un cours léger de BA, le patient peut mourir d'un état de mal asthmatique soudainement développé. Phases du cursus de BA : 1) exacerbation (présence de crises récurrentes d'asthme ou d'asthme); 2) exacerbation qui s'atténue (les crises deviennent plus rares et bénignes, les signes physiques et fonctionnels de la maladie sont moins prononcés qu'en phase d'exacerbation) ; 3) rémission (les manifestations typiques de l'asthme disparaissent : les crises d'asthme ne se produisent pas ; la perméabilité bronchique est totalement ou partiellement restaurée). complications: 1) pulmonaire : emphysème, insuffisance pulmonaire, atélectasie, pneumothorax, état de mal asthmatique, etc. ; 2) extrapulmonaire : cœur pulmonaire (compensé et décompensé avec le développement d'une insuffisance cardiaque droite), dystrophie myocardique, etc. Image clinique. Le signe le plus caractéristique de l'asthme sont les plaintes de crises d'étouffement (difficultés à respirer principalement lors de l'expiration), d'essoufflement et de toux de divers types (sèches, paroxystiques ou avec libération d'expectorations visqueuses). Le développement d'une infection bronchopulmonaire provoque une augmentation de la température corporelle. La difficulté de respiration nasale qui en résulte est une manifestation d'une rhinosinusopathie allergique (rhinite vasomotrice, polypose), qui survient généralement pendant la phase pré-asthme. Les données historiques aident à établir un lien entre le développement des crises et l'exposition à certains allergènes et à d'autres facteurs. Le plus souvent, il s'agit d'une infection des voies respiratoires, en particulier lors d'une exacerbation de la maladie. À partir de l'anamnèse, ils apprennent l'influence de l'effort physique (comme la marche rapide, le rire, etc.), les changements des facteurs météorologiques (comme le froid, l'humidité élevée, etc.), les troubles disovariens, les facteurs professionnels sur la survenue de l'asthme attaques. L'étude d'un antécédent allergique contribue au diagnostic d'un variant atopique de la BA. Dans de tels cas, les exacerbations de la maladie sont saisonnières (plus souvent au printemps et en été), accompagnées de rhinite, de conjonctivite. Ces patients ont de l'urticaire, l'œdème de Quincke; intolérance alimentaire, un certain nombre de substances médicinales sont détectées; il existe une prédisposition héréditaire aux maladies allergiques. Les données de l'anamnèse permettent souvent d'établir la présence de ce qu'on appelle l'asthme à l'aspirine. Dans ce cas, il n'y a pas de forme héréditaire de maladies allergiques. Ces patients sont préoccupés par une respiration nasale altérée (excroissances polypes), et le symptôme le plus caractéristique est l'intolérance aux anti-inflammatoires non stéroïdiens (acide acétylsalicylique, indométhacine, etc.), qui provoquent des crises d'asthme. Dans ce cas, il est déjà possible de supposer un mécanisme prostaglandine de la MA. Les données sur le développement de l'état asthmatique dans le passé indiquent la gravité de l'évolution de la maladie et indiquent la nécessité d'une corticothérapie. diagnostics. L'identification des manifestations extrapulmonaires d'allergies, des signes de broncho-obstruction, des complications de l'asthme et d'autres maladies accompagnées de crises de bronchospasme est d'une grande importance. Lors de l'examen de la peau, des manifestations allergiques peuvent être détectées: urticaire, éruptions papuleuses érythémateuses, ce qui indique une variante immunologique de BA. L'association de l'asthme avec l'eczéma, la névrodermite, le psoriasis prédispose à l'asthme sévère. Il est souvent possible d'identifier une violation de la respiration nasale. La rhinite et les polypes sont considérés comme pré-asthme. La sinusite et d'autres sinusites peuvent provoquer un étouffement. L'examen physique des poumons, souvent dû à une bronchite chronique sous-jacente, peut révéler des signes d'emphysème conduisant au développement d'une insuffisance respiratoire chronique et d'un cœur pulmonaire. Des signes auscultatoires d'obstruction bronchique sont détectés: une modification de la respiration (longue expiration, sèche, principalement une respiration sifflante, une respiration sifflante), une expiration forcée, qui révèle un bronchospasme latent (l'apparition ou l'augmentation d'une respiration sifflante sèche). L'auscultation des poumons doit être réalisée dans la position du patient allongé : le nombre de râles secs augmente avec leur mécanisme « vagal ». Constamment écoutés dans une certaine zone, de fins râles bouillonnants à voix humide ("crépitants") peuvent indiquer une pneumosclérose développée. Un examen objectif du patient révèle des symptômes d'autres maladies ("papillon" sur la peau du visage, adénopathies associées à une augmentation du foie et de la rate, une augmentation persistante de la pression artérielle, une fièvre persistante, etc.), dans lesquelles des crises de bronchospasme surviennent, se manifestant par une suffocation (lupus érythémateux disséminé, périartérite nodulaire). Ensuite, le diagnostic présumé de MA devient improbable. La spirographie révèle les signes caractéristiques de l'obstruction bronchique obstructive : une diminution du volume expiratoire maximal dans la première seconde (FEV1), une diminution du coefficient de Tiffno (FEV1 à VC en pourcentage) et le pourcentage de FEV1 à FJEL. Au cours de l'exacerbation de BA, le volume pulmonaire résiduel (RLV) et la capacité résiduelle fonctionnelle (FOC) dépassent le niveau initial de 100 % ou plus. Lors de l'analyse du spirogramme, on trouve des signes de dyskinésie trachéobronchique, contribuant à la violation de la perméabilité bronchique, par la présence d'une encoche dans la partie supérieure de la couleur descendante du spirogramme (symptôme de Kolbet-Wyss). La pneumotachométrie montre la prédominance de la puissance inspiratoire sur la puissance expiratoire, caractéristique de l'obstruction bronchique. Selon la pneumotachographie avec la construction de la courbe débit-volume, une violation de la perméabilité bronchique est diagnostiquée séparément au niveau des grandes, moyennes et petites bronches. L'apparition d'une résistance bronchique accrue, enregistrée par spirographie, pneumotachymétrie et pneumotachographie, en réponse à l'activité physique, à l'inhalation d'air froid, de gaz irritants et d'acétylcholine indique une réactivité bronchique altérée. Les tests allergologiques sont effectués à l'aide d'un ensemble de divers allergènes non infectieux et infectieux, ils ne sont effectués qu'en dehors de l'exacerbation de la maladie. Pour évaluer l'effet provocateur de l'allergène, des tests allergiques cutanés sont effectués (application, scarification et méthodes intradermiques d'application de l'allergène), l'allergène peut être appliqué sur la conjonctive de l'œil, la muqueuse nasale. Le plus fiable est le diagnostic spécifique de l'asthme - l'identification d'une hyperréactivité bronchique spécifique à l'aide de tests de provocation par inhalation. Cependant, il ne faut pas perdre de vue que cette voie d'administration peut provoquer une crise d'asthme sévère ou le développement d'un état de mal asthmatique. Pour le diagnostic spécifique de la MA, par exemple, lorsqu'il est impossible de réaliser un test allergologique, on utilise également un test radioimmunosorbant qui permet de quantifier les anticorps IgE. Les études de laboratoire permettent de confirmer le diagnostic proposé, d'évaluer l'évolution de la maladie et l'efficacité du traitement. Le principal critère de diagnostic de la MA est l'apparition d'éosinophiles dans les expectorations, mais il s'agit d'un signe non spécifique, il peut servir de manifestation d'une réaction allergique générale du corps. La détection des spirales de Kurshman et des cristaux de Charcot-Leiden dans les crachats est également importante pour le diagnostic. Des études en laboratoire prouvent la présence d'un processus inflammatoire actif et le degré de sa gravité en termes d'augmentation des indicateurs de phase aiguë. Avec une augmentation de l'insuffisance respiratoire en cas d'exacerbation de l'asthme et d'état de mal asthmatique, il est important d'étudier l'état acido-basique et la composition des gaz sanguins. L'examen aux rayons X diagnostique les foyers d'infection (dans les sinus paranasaux, les dents, la vésicule biliaire) et la présence d'une pneumonie aiguë ou d'une exacerbation d'un processus inflammatoire chronique dans les poumons, l'emphysème et la pneumosclérose. Les données ECG prouvent les signes du développement d'un cœur pulmonaire compensé - hypertrophie du cœur droit. Diagnostic différentiel. L'AB se différencie de l'asthme cardiaque (voir tableau 8). Tableau 8 Diagnostic différentiel de la MA
Il est également nécessaire de différencier l'asthme infectieux-allergique et atopique (voir tableau 9). Tableau 9 Asthme infectieux-allergique et atopique
traitement. Dans le traitement de l'asthme, une approche par étapes est recommandée, ce qui s'explique par la gravité variable de son évolution chez différentes personnes et chez un même patient. Le stade 1 est l’asthme le moins grave, le stade 4 est le plus grave. Étape 1 : Une évolution intermittente légère dans laquelle les symptômes de l'asthme apparaissent lors de l'exposition à un déclencheur (par exemple, le pollen ou les poils d'animaux) ou en raison de l'exercice. L'utilisation à long terme d'anti-inflammatoires dans le traitement de ces patients n'est pas indiquée. Le traitement consiste en une médication prophylactique si nécessaire (β inhalé2agonistes, cromoglycate, nédocromil ou anticholinergiques). Parfois, des exacerbations plus sévères et prolongées nécessitent une courte cure de corticostéroïdes oraux. Si l'asthme se manifeste par des symptômes plus fréquents, une augmentation du besoin de bronchodilatateurs, il devient alors nécessaire de passer à l'étape suivante. Stade 2. Cours léger et persistant. Le traitement primaire comprend les anti-inflammatoires, les corticostéroïdes inhalés, le cromoglycate de sodium ou le nédocromil sodique. La posologie des corticostéroïdes est de 200 à 500 microgrammes de dipropionate de béclométhasone ou de budésonide par jour. Pour le traitement symptomatique, β inhalé2-agonistes, mais pas plus de 3-4 fois par jour. Pour les exacerbations plus sévères et prolongées, une courte cure de corticostéroïdes oraux est administrée. Si les symptômes persistent malgré une dose initiale de corticostéroïdes inhalés, la dose de dipropionate de béclométhasone doit être augmentée à 750-800 microgrammes par jour. Cependant, une alternative à l'augmentation de la dose d'hormones inhalées, notamment pour contrôler les crises d'asthme nocturnes, est l'adjonction de bronchodilatateurs à longue durée d'action pris le soir (à une dose de corticoïdes inhalés d'au moins 500 µg). Le stade 3 est caractérisé par une sévérité modérée de la BA. Ces patients nécessitent une prise quotidienne de médicaments anti-inflammatoires prophylactiques. La dose de corticostéroïdes inhalés est de 800 à 2000 mcg en association avec des bronchodilatateurs à longue durée d'action. Vous pouvez utiliser des théophyllines à action prolongée (avec une surveillance constante de leur concentration ne dépassant pas 5-15 µg / ml), β orales et inhalées2agonistes à longue durée d'action. Nommer symptomatiquement β2-les agonistes à courte durée d'action ou les médicaments alternatifs (stade 2). Stade 4. Asthme sévère, lorsqu'il n'est pas complètement contrôlé. Dans ce cas, le but du traitement est d'obtenir les meilleurs résultats possibles. Le traitement primaire repose sur des corticoïdes inhalés à forte dose (entre 800 et 2000 microgrammes par jour de dipropionate de béclométhasone) en association avec des bronchodilatateurs à longue durée d'action. Si nécessaire, la β inhalée est indiquée pour soulager les symptômes.2-agonistes à courte durée d'action (pas plus de 3-4 fois par jour). Une exacerbation plus sévère peut nécessiter un traitement par corticostéroïdes oraux, qui sont prescrits à doses minimales ou tous les deux jours. Pour prévenir le développement d'effets secondaires, des doses élevées de corticostéroïdes inhalés sont administrées à travers une chambre d'inhalation. L'étape 5 consiste à réduire les médicaments de soutien. Cela est possible si l'asthme reste sous contrôle pendant au moins 3 mois, ce qui contribue à réduire le risque d'effets secondaires et augmente la sensibilité du patient au traitement prévu. La "réduction" du traitement est effectuée sous le contrôle constant des symptômes, des manifestations cliniques et des indicateurs des fonctions respiratoires en réduisant progressivement (en annulant) la dernière dose ou les médicaments supplémentaires. Arrêter les attaques. Une légère crise peut être traitée à domicile avec des bronchodilatateurs à courte durée d'action. Le traitement est effectué jusqu'à disparition complète des symptômes. Les crises modérées et sévères nécessitent non seulement des doses adéquates de bronchodilatateurs à courte durée d'action (β inhalés2-agonistes à courte durée d'action), mais aussi la nomination de corticostéroïdes systémiques. Si le patient souffre d'hypoxémie, de l'oxygène doit être administré. Pour le traitement des crises d'asthme dans un centre médical ou un hôpital, de fortes doses de β inhalé2agonistes à travers un nébuliseur. L'utilisation d'un aérosol-doseur à travers une chambre d'inhalation est très efficace. De préférence, les corticostéroïdes sont administrés par voie orale et non par voie intraveineuse. Lors de l'utilisation de théophylline ou d'aminophylline en association avec de fortes doses de β2-agonistes effet bronchodilatateur supplémentaire n'est pas fourni, mais le risque d'effets secondaires augmente. Les théophyllines ne peuvent être utilisées qu'en l'absence de β2-agonistes, cependant, ils peuvent être administrés par voie intraveineuse à raison de 6 mg/kg d'aminophylline (ou 5 mg/kg de théophylline) avec une dose constante de 0,5 à 1,0 mg/kg par heure pendant 24 heures.2Les agonistes à courte durée d'action peuvent également utiliser l'épinéphrine, mais des effets secondaires importants sont possibles avec son utilisation. Les mucolytiques inhalés, les sédatifs et les antihistaminiques, le sulfate de magnésium, la kinésithérapie respiratoire, l'hydratation avec de grands volumes de liquides pour les adultes et les enfants plus âgés ne sont pas recommandés pour le traitement des crises d'asthme afin d'éviter une toux accrue. Prévention. La prévention primaire de l'asthme comprend le traitement des patients en état de pré-asthme, l'identification des défauts biologiques chez des individus pratiquement en bonne santé ayant des antécédents familiaux qui constituent une menace pour l'apparition de l'asthme, l'élimination des allergènes, irritants et autres facteurs potentiellement dangereux du environnement des patients pouvant conduire au développement de la maladie. Dans le traitement des patients en état de préasthme, il est nécessaire d'assainir les foyers d'infection, de traiter la rhinosinusopathie allergique, d'appliquer diverses méthodes de traitement non médicamenteux, notamment l'acupuncture et la psychothérapie, la thérapie par l'exercice, la barothérapie, la cure thermale. La réalisation d'une hyposensibilisation spécifique et non spécifique est montrée. CONFÉRENCE N ° 7. Maladies du système respiratoire. Bronchite chronique La bronchite chronique obstructive est une lésion inflammatoire diffuse non allergique de l'arbre bronchique, causée par des effets irritants prolongés sur les bronches de divers agents, qui a une évolution progressive et se caractérise par une ventilation pulmonaire obstructive, la formation de mucus et la fonction drainante des voies bronchiques. arbre, qui se manifeste par la toux, les expectorations et l'essoufflement. Selon la définition de l'OMS, si un patient crache des crachats presque tous les jours pendant au moins 3 mois consécutifs pendant plus de 2 années consécutives, la maladie est considérée comme une bronchite chronique (CB). La bronchite chronique est divisée en primaire et secondaire. La bronchite chronique primaire est une maladie indépendante qui n'est pas associée à d'autres processus broncho-pulmonaires ou à des lésions d'autres organes et systèmes, dans laquelle il existe une lésion diffuse de l'arbre bronchique. La CB secondaire se développe dans le contexte d'autres maladies - pulmonaires (tuberculose, bronchectasie, etc.) et extrapulmonaires (urémie, insuffisance cardiaque congestive, etc.). Le plus souvent, il est de nature locale (segmentaire). Considérez HB primaire. Étiologie. Des facteurs à la fois exogènes (fumée de tabac, pollution de l'air, conditions professionnelles défavorables, facteurs climatiques et infectieux) et endogènes (pathologie du nasopharynx, troubles de la respiration par le nez, maladies respiratoires aiguës à répétition, bronchite aiguë et infection focale des voies respiratoires supérieures) jouent un rôle dans le développement des voies CB, prédisposition héréditaire, troubles métaboliques (obésité)). pathogénèse. Sous l'influence de facteurs exogènes et avec la participation de facteurs endogènes dans l'arbre trachéobronchique, les propriétés structurelles et fonctionnelles de la membrane muqueuse et de la couche sous-muqueuse changent, une inflammation de la membrane muqueuse se développe et la perméabilité et la fonction de drainage des bronches sont perturbées. Les modifications structurelles et fonctionnelles de la membrane muqueuse et de la couche sous-muqueuse se traduisent par une hyperplasie et une hyperfonction des cellules caliciformes, des glandes bronchiques, une hypersécrétion de mucus épais et visqueux, ce qui entraîne une perturbation du système de transport mucociliaire. La quantité d'IgA sécrétoire-lysozyme et de lactoferrine produite est réduite. L'œdème de la membrane muqueuse se développe, puis - l'atrophie et la métaplasie de l'épithélium. L'inflammation de la membrane muqueuse est causée par divers irritants associés à une infection (virale et bactérienne). Les substances chimiques (polluants) contenues dans l'air ont un effet néfaste sur les voies respiratoires, un gonflement de la membrane muqueuse se produit et une inhibition de l'activité de l'épithélium cilié se produit. Cela conduit à une violation de l'évacuation et à une diminution de la fonction barrière de la muqueuse bronchique. Le contenu catarrhal est remplacé par catarrhal-purulent, puis purulent. La propagation du processus inflammatoire aux sections distales de l'arbre bronchique perturbe la production de surfactant et réduit l'activité des macrophages alvéolaires qui phagocytent les particules étrangères. Si le bronchospasme qui survient en cas d'inflammation est prononcé, une composante bronchospastique (non allergique) se développe. L'infection associée lors de l'exacerbation de l'inflammation contribue au développement d'une composante asthmatique (allergique), ce qui permet d'attribuer un tel CB au pré-asthme. Le syndrome obstructif se développe en raison d'une combinaison d'un certain nombre de facteurs: 1) spasme des muscles lisses des bronches à la suite d'effets irritants de facteurs exogènes et de modifications inflammatoires de la membrane muqueuse; 2) hypersécrétion de mucus, modification de ses propriétés rhéologiques, entraînant une perturbation du transport mucociliaire et un blocage des bronches avec un secret visqueux; 3) métaplasie de l'épithélium de cylindrique à squameux stratifié et son hyperplasie ; 4) violations de la production de tensioactif; 5) œdème inflammatoire et infiltration muqueuse ; 6) collapsus des petites bronches et oblitération des bronchioles ; 7) modifications allergiques de la membrane muqueuse. Si des bronches de gros calibre sont impliquées dans le processus (bronchite proximale), l'obstruction bronchique n'est pas exprimée. Mais en cas de lésion des petites et moyennes bronches, une violation prononcée de la perméabilité bronchique se produit. Cependant, avec une lésion isolée des petites bronches (bronchite distale), dépourvue de récepteurs de la toux, l'essoufflement peut être le seul signe d'une bronchite développée et la toux apparaît lorsque de plus grosses bronches sont impliquées dans le processus. Divers rapports de modifications de la membrane muqueuse provoquent la formation d'une certaine forme clinique: 1) avec la bronchite catarrhale non obstructive, des modifications superficielles des propriétés structurelles et fonctionnelles de la membrane muqueuse prévalent; 2) avec la bronchite mucopurulente (purulente), les processus d'inflammation infectieuse prédominent. Cependant, une situation est également possible lorsque la bronchite catarrhale à long terme due à l'ajout d'une infection peut devenir mucopurulente, etc. Dans la variante non obstructive de toutes les formes cliniques de bronchite chronique, les troubles de la ventilation sont légèrement prononcés; 3) les troubles obstructifs n'apparaissent initialement que dans le contexte d'une exacerbation de la maladie et sont causés par des modifications inflammatoires des bronches, une hyper et dyskrinie, un bronchospasme (composants réversibles de l'obstruction), mais ils persistent ensuite constamment, tandis que le syndrome obstructif se développe tout doucement. Dans la bronchite chronique obstructive, l'épaississement de la membrane muqueuse et de la couche sous-muqueuse, l'œdème et l'hypersécrétion prédominent, et des troubles persistants de la ventilation sont également caractéristiques. L'obstruction développée des petites bronches conduit à l'emphysème. Au cours de son parcours, HB subit une certaine évolution. À la suite du développement de l'emphysème et de la pneumosclérose, une ventilation inégale des poumons est notée, des zones hyper et hypoventilées se forment. En combinaison avec des modifications inflammatoires locales, cela entraîne une altération des échanges gazeux, une insuffisance respiratoire, une hypoxémie artérielle et une hypertension pulmonaire, suivies du développement de la principale affection potentiellement mortelle - l'insuffisance ventriculaire droite. Classification. Il n’existe actuellement aucune classification généralement acceptée des CB. Il est important de diviser CB en variantes obstructives et non obstructives, avec chacune desquelles un processus inflammatoire catarrhale (muqueux), catarrhal-purulent ou purulent peut se développer. La classification comprend également des formes rares - CB hémorragique et fibrineuse. Selon le niveau d'atteinte bronchique, ils distinguent: avec une lésion prédominante, les grosses bronches (bronchite proximale) et avec une lésion prédominante des petites bronches (bronchite distale) (N. R. Paleev, 1985). Image clinique. Les principaux symptômes de la CB sont la toux, la production d'expectorations et l'essoufflement. Lors d'une exacerbation de la maladie ou en raison d'une hypoxie avec développement d'une insuffisance pulmonaire et d'autres complications, des symptômes généraux sont identifiés (transpiration, faiblesse, augmentation de la température corporelle, fatigue, etc.). La toux est la manifestation la plus typique de la maladie. Sur la base de la nature et de la consistance des crachats, on peut supposer une variante de l'évolution de la maladie. Dans la version non obstructive de la bronchite catarrhale, la toux s'accompagne de la libération d'une petite quantité d'expectorations muqueuses et aqueuses (généralement le matin, après l'exercice ou en raison d'une respiration accrue). Au début de la maladie, la toux ne gêne pas le patient ; l'apparition d'une toux paroxystique indique le développement d'une obstruction bronchique. La toux prend un ton aboyant et est de nature paroxystique avec un collapsus expiratoire prononcé de la trachée et des grosses bronches. Avec la bronchite purulente et mucopurulente, les patients sont plus préoccupés par la toux des expectorations. En cas d'exacerbation de la maladie, les expectorations acquièrent un caractère purulent, leur quantité augmente, parfois les expectorations sont excrétées avec difficulté (en raison d'une obstruction bronchique lors de l'exacerbation). Dans la variante obstructive de la bronchite, la toux est improductive et saccadée, accompagnée d'un essoufflement, avec une petite quantité de crachats. L'essoufflement survient chez tous les patients atteints de bronchite chronique à divers moments. L'apparition d'un essoufflement chez les patients "toussant de longue durée" initialement avec un effort physique important indique l'ajout d'une obstruction bronchique. Au fur et à mesure que la maladie progresse, l'essoufflement devient plus prononcé et constant, c'est-à-dire qu'une insuffisance respiratoire (pulmonaire) se développe. Dans la variante non obstructive, la CB progresse lentement, l'essoufflement apparaît généralement 20 à 30 ans après le début de la maladie. Ces patients ne corrigent presque jamais l'apparition de la maladie, mais indiquent seulement l'apparition de complications ou d'exacerbations fréquentes. Il existe des antécédents d'hypersensibilité au froid et la plupart des patients signalent un tabagisme prolongé. Chez un certain nombre de patients, la maladie est associée à des risques professionnels au travail. Lors de l'analyse d'antécédents de toux, il est nécessaire de s'assurer que le patient n'a pas d'autre pathologie de l'appareil broncho-pulmonaire (tuberculose, tumeurs, bronchectasie, pneumoconiose, maladies systémiques du tissu conjonctif, etc.), accompagnée des mêmes symptômes. Parfois, une histoire indique une hémoptysie due à une légère vulnérabilité de la muqueuse bronchique. Une hémoptysie récurrente indique une forme hémorragique de bronchite. De plus, l'hémoptysie dans la bronchite chronique à long terme peut être le premier symptôme du cancer du poumon ou de la bronchectasie. diagnostics. L'auscultation révèle une respiration difficile (avec le développement de l'emphysème, elle peut s'affaiblir) et une respiration sifflante sèche de caractère épars, dont le timbre dépend du calibre des bronches touchées (une respiration sifflante, bien audible à l'expiration, est caractéristique d'une atteinte des petites bronches ). Les changements dans les données d'auscultation seront minimes dans la bronchite chronique non obstructive en rémission et plus prononcés lors de l'exacerbation du processus (râles humides de divers calibres pouvant disparaître après une bonne toux et production d'expectorations). Avec une exacerbation de la bronchite obstructive, l'essoufflement augmente, les phénomènes d'insuffisance respiratoire augmentent. Un secret visqueux purulent complique encore la perméabilité des bronches. La composante obstructive qui a rejoint à la fois les formes catarrhale et mucopurulente de la bronchite, et pendant la période d'exacerbation ou au cours de leur évolution, aggrave considérablement l'évolution de la bronchite. Signes d'obstruction bronchique : allongement de la phase expiratoire avec respiration calme et surtout forcée ; respiration sifflante à l'expiration (mieux ausculté avec respiration forcée et en décubitus dorsal); symptômes d'emphysème pulmonaire obstructif. Dans les cas avancés de bronchite chronique et avec l'ajout de complications, des signes d'emphysème des poumons, d'insuffisance respiratoire et cardiaque (ventriculaire droit) - cœur pulmonaire décompensé apparaissent: acrocyanose, pastosité ou gonflement des jambes et des pieds, modifications des ongles dans la forme de lunettes de montre et les phalanges terminales des mains et des pieds - sous forme de pilons, gonflement des veines cervicales, pulsation dans la région épigastrique due au ventricule droit, accent du ton II dans l'espace intercostal II à gauche du sternum, hypertrophie du foie. Affecte l'image de la maladie et l'ajout d'un composant asthmatique (allergique), lorsqu'il y a une ressemblance avec l'asthme bronchique. Les indicateurs de laboratoire et instrumentaux ont un degré d'importance différent selon l'étape du processus. Dans la période initiale de la maladie ou dans la phase de rémission, il peut n'y avoir aucun changement. Cependant, ces indicateurs sont d'une grande importance pour identifier l'activité du processus inflammatoire; clarification de la forme clinique de la maladie; identifier les complications ; diagnostic différentiel avec des maladies qui ont des symptômes cliniques similaires. L'examen radiographique des organes thoraciques est effectué chez tous les patients atteints de bronchite chronique, cependant, en règle générale, il n'y a aucun changement dans les poumons sur les radiographies simples. Il peut y avoir une déformation du maillage du modèle pulmonaire, en raison du développement de la pneumosclérose. Avec un long déroulement du processus, des signes d'emphysème sont révélés. Avec le développement du cœur pulmonaire, un renflement du tronc de l'artère pulmonaire apparaît sur le contour gauche de l'ombre du cœur, une expansion des artères basales, suivie de leur rétrécissement en forme de cône et une diminution du diamètre du branches périphériques. L'examen radiologique joue un rôle important dans le diagnostic des complications (pneumonie aiguë, bronchectasie) et dans le diagnostic différentiel avec des maladies présentant des symptômes similaires. La bronchographie est utilisée uniquement pour diagnostiquer la bronchectasie. La bronchoscopie est d'une grande importance dans le diagnostic de la bronchite chronique et sa différenciation des maladies qui manifestent un tableau clinique similaire. Il confirme la présence d'un processus inflammatoire ; précise la nature de l'inflammation (le diagnostic de bronchite hémorragique ou fibrineuse n'est posé qu'après cette étude); révèle des troubles fonctionnels de l'arbre trachéobronchique (il est particulièrement important d'identifier le collapsus expiratoire - dyskinésie de la trachée et des grosses bronches); aide à identifier les lésions organiques de l'arbre bronchique. De plus, la bronchoscopie permet d'obtenir le contenu des bronches ou des lavages pour des études microbiologiques, parasitologiques et cytologiques. L'étude de la fonction de la respiration externe est réalisée pour identifier les troubles restrictifs et obstructifs de la ventilation pulmonaire. Selon le spirogramme, l'indice de Tiffno est calculé (le rapport du volume expiratoire forcé en 1 s - FEV1 à la capacité vitale des poumons - VC en pourcentage) et un indicateur de vitesse de l'air - PSV (le rapport de la ventilation maximale des poumons - MVL à VC). Avec le développement du syndrome obstructif, il y a une diminution des indicateurs de vitesse absolue de la respiration externe (MVL et FEV1), dépassant le degré de réduction de VC ; l'indice de Tiffno diminue et la résistance bronchique à l'expiration augmente. Selon la pneumotachymétrie, la prédominance de la puissance inspiratoire sur la puissance expiratoire se révèle être un signe précoce d'obstruction bronchique. L'identification des violations de la perméabilité bronchique à différents niveaux de l'arbre bronchique est possible à l'aide de pneumotachographes spéciaux, qui permettent d'obtenir une courbe "débit-volume". L'obstruction périphérique se caractérise par une diminution importante de la courbe débit-volume dans la zone de faible volume. L'évaluation conjointe des résistances bronchiques et des volumes pulmonaires permet également de déterminer le niveau d'obstruction. En cas d'obstruction au niveau des grosses bronches, il y a une augmentation du volume résiduel des poumons (RLV), et la capacité pulmonaire totale (TLC) n'augmente pas. Avec l'obstruction périphérique, une augmentation plus importante du TRL et une augmentation du TRL sont observées. Pour identifier la proportion de bronchospasme dans la proportion totale d'obstruction bronchique, la ventilation et la mécanique respiratoire sont étudiées après une série de tests pharmacologiques. Après inhalation d'aérosols bronchodilatateurs, les performances de ventilation s'améliorent en présence d'une composante spastique d'obstruction des voies respiratoires. Une radiopulmonographie utilisant l'isotope radioactif 133Xe est réalisée pour détecter une ventilation inégale associée à une obstruction des petites bronches. C'est le premier signe diagnostique de ce type d'obstruction bronchique. L'électrocardiographie est nécessaire pour détecter une hypertrophie du ventricule droit et de l'oreillette droite se développant dans l'hypertension pulmonaire. Une déviation prononcée de l'axe QRS vers la droite, un décalage de la zone de transition vers la gauche (R / S <1 en V4-V6), un ECG de type S sont détectés ; onde P aiguë élevée dans les dérivations VF, III, II. Un examen sanguin clinique révèle une érythrocytose secondaire résultant d'une hypoxie chronique avec développement d'une insuffisance pulmonaire sévère. Les indicateurs de «phase aiguë» sont exprimés modérément: la RSE est normale ou modérément augmentée, la leucocytose est faible, ainsi que le déplacement de la formule leucocytaire vers la gauche. Comme preuve de manifestations allergiques, une éosinophilie est possible. L'étude des expectorations et du contenu bronchique permet d'établir la sévérité de l'inflammation. Avec une inflammation sévère, le contenu est purulent ou purulent-muqueux, contient de nombreux neutrophiles et des macrophages uniques, les cellules dystrophiquement altérées de l'épithélium cilié et squameux sont mal représentées. Pour une inflammation modérée, le contenu est plus proche de mucopurulent; le nombre de neutrophiles est réduit, le nombre de macrophages, de mucus et de cellules épithéliales bronchiques augmente. Avec une inflammation légère, le contenu bronchique est muqueux, les cellules desquamées de l'épithélium et les bronches prédominent; les macrophages et les neutrophiles sont peu nombreux. L'examen microbiologique des crachats et du contenu bronchique est important pour identifier l'étiologie des exacerbations de la bronchite chronique et le choix de l'antibiothérapie. Diagnostic différentiel. Tableau 10 Critères de diagnostic différentiel pour CB
traitement. Comprend un ensemble de mesures qui diffèrent pendant la période d'exacerbation et de rémission de la maladie. Pendant la période d'exacerbation d'une maladie chronique, on distingue deux directions de traitement : étiotrope et pathogénétique. Le traitement étiotropique vise à éliminer le processus inflammatoire dans les bronches: un traitement par antibiotiques, sulfamides, antiseptiques, phytoncides, etc. est indiqué.Le traitement est débuté avec des antibiotiques de la série des pénicillines (pénicilline, ampicilline) ou un groupe de céphalosporines (céfamésine , tséporine), et en l'absence d'effet, les antibiotiques du groupe sont utilisés en réserve (gentamicine, etc.). La voie d'administration la plus préférée est intratrachéale (aérosol ou remplissage avec une seringue laryngée à travers un bronchoscope). Le traitement pathogénétique vise à améliorer la ventilation pulmonaire ; restauration de la perméabilité bronchique; contrôle de l'hypertension pulmonaire et de l'insuffisance ventriculaire droite. La restauration de la ventilation pulmonaire, en plus de l'élimination du processus inflammatoire dans les bronches, est facilitée par l'oxygénothérapie et la thérapie par l'exercice. L'essentiel dans le traitement de la bronchite chronique - la restauration de la perméabilité bronchique - est obtenu en améliorant leur drainage et en éliminant le bronchospasme. Pour améliorer le drainage bronchique, des expectorants sont prescrits (boisson alcaline chaude, décoctions à base de plantes, mukaltine, etc.), des médicaments mucolytiques (acétylcystéine, bromhexine; avec sécrétion visqueuse purulente - aérosols d'enzymes protéolytiques - chymopsine, trypsine); la bronchoscopie thérapeutique est utilisée. Pour éliminer le bronchospasme, on utilise de l'eufillin (par voie intraveineuse, dans des suppositoires, des comprimés), de l'éphédrine, de l'atropine; des rendez-vous uniques dans un aérosol de médicaments sympathomimétiques sont possibles: fénotérol, sulfate d'orciprénaline (asthmopenta) et un nouveau médicament domestique "Soventol", médicaments anticholinergiques: atrovent, troventol. Préparations efficaces d'aminophylline prolongée (teopec, teodur, theobelong, etc.) - 2 fois par jour. En l'absence d'effet d'un tel traitement, de petites doses de corticostéroïdes sont administrées par voie orale (10-15 mg de prednisolone par jour) ou par voie intratrachéale (suspension d'hydrocortisone - 50 mg). Comme thérapie supplémentaire, nommez: 1) médicaments antitussifs: avec une toux improductive - libexin, tusuprex, bromhexine, avec une toux sèche - codéine, dionine, stoptussin; 2) médicaments qui augmentent la résistance de l'organisme : vitamines A, C, groupe B, stimulants biogéniques. Actuellement, dans le traitement de la bronchite chronique, les médicaments immunocorrecteurs sont de plus en plus utilisés : T-activine ou thymaline (100 mg en sous-cutané pendant 3 jours) ; à l'intérieur - catergen, nucléinate de sodium ou pentoxyle (dans les 2 semaines), lévamisole (décaris). Traitement de physiothérapie: prescrire diathermie, électrophorèse au chlorure de calcium, quartz sur la poitrine, massage de la poitrine et exercices respiratoires. Avec une bronchite modérée et sévère, ainsi qu'un traitement anti-rechute et sanatorium, de nombreux patients sont obligés de recevoir en permanence un traitement médicamenteux de soutien. Le traitement d'entretien vise à améliorer la perméabilité bronchique, à réduire l'hypertension pulmonaire et à lutter contre l'insuffisance ventriculaire droite. Les mêmes médicaments sont prescrits que pendant la période d'exacerbation, mais à des doses plus faibles, en cours. Prévision. Le pronostic de guérison complète est défavorable. Le pronostic le moins favorable est celui des CB obstructifs et des CB avec lésions prédominantes des bronches distales, qui conduisent rapidement au développement d'une insuffisance pulmonaire et à la formation d'un cœur pulmonaire. Le pronostic le plus favorable est celui des CB superficielles (catarrhales) sans obstruction. CONFÉRENCE N ° 8. Maladies du système respiratoire. Pneumonie La pneumonie est une maladie infectieuse et inflammatoire aiguë de nature focale, dans laquelle les sections respiratoires et le tissu conjonctif interstitiel des poumons sont impliqués dans le processus pathologique. Classification par E. V. Gembitsky (1983). Par étiologie : 1) bactérien (indiquant l'agent pathogène); 2) viral (indiquant l'agent pathogène); 3) cornitique ; 4) rickettsies ; 5) mycoplasme ; 6) fongique; 7) mixte ; 8) infectieux-allergique; 9) étiologie inconnue. Par pathogenèse : 1) primaire (processus inflammatoire aigu indépendant); 2) secondaire (complication de maladies du système cardiovasculaire avec des troubles circulatoires dans la circulation pulmonaire, des maladies chroniques des reins, du système sanguin, du métabolisme, des maladies infectieuses ou se développant dans le contexte de maladies respiratoires chroniques). Caractéristiques cliniques et morphologiques : 1) parenchymateux (pour la pneumonie à pneumocoque) : croupeux ; focal; 2) interstitiel. Par localisation et étendue : unilatérale ; bilatéral. Par sévérité : extrêmement sévère ; lourd; modéré; doux et abortif. Aval : pointu ; prolongée (résolution radiologique et clinique de la pneumonie). Étiologie. La plupart des pneumonies sont d'origine infectieuse. Les pneumonies allergiques et celles provoquées par des facteurs physiques ou chimiques sont rares. La pneumonie bactérienne est plus souvent diagnostiquée chez les personnes d'âge moyen et âgées ; pneumonie virale - chez les jeunes. Dans l'étiologie de la pneumonie bactérienne primaire, le rôle principal appartient aux pneumocoques. Lors d'une épidémie de grippe, le rôle des associations virales-bactériennes (généralement des staphylocoques), ainsi que des micro-organismes opportunistes, augmente. Dans la pneumonie secondaire, le rôle étiologique principal est joué par les bactéries gram-négatives (klebsiella pneumoniae et influenza bacillus) ; dans la survenue d'une pneumonie par aspiration, l'importance de l'infection anaérobie est grande. pathogénèse. L'agent pathogène infectieux pénètre de l'extérieur dans les sections respiratoires des poumons par les bronches : inhalation et aspiration (à partir du nasopharynx ou de l'oropharynx). Par voie hématogène, l'agent pathogène pénètre dans les poumons principalement lors d'une pneumonie secondaire ou lors de la genèse thrombotique de la pneumonie. La propagation lymphogène de l'infection avec apparition d'une pneumonie n'est observée qu'avec des plaies à la poitrine. Il existe également un mécanisme endogène pour le développement de l'inflammation dans le tissu pulmonaire, en raison de l'activation de la microflore dans les poumons. Son rôle est important dans les pneumonies secondaires. Le développement de la pneumonie est facilité par des facteurs défavorables de l'environnement externe et interne, sous l'influence desquels il y a une diminution de la résistance générale non spécifique de l'organisme (suppression de la phagocytose, la production de bactériolysines, etc.) et suppression de la mécanismes de défense (altération de la clairance mucociliaire, diminution de l'activité phagocytaire des macrophages alvéolaires et des neutrophiles, etc.) . Une importance significative dans la pathogenèse de la pneumonie est également attachée aux réactions allergiques et autoallergiques. Les saprophytes et les micro-organismes pathogènes, devenant des antigènes, contribuent à la production d'anticorps qui se fixent sur les cellules de la membrane muqueuse des voies respiratoires, où se produit la réaction antigène-anticorps, ce qui entraîne des lésions tissulaires et le développement du processus inflammatoire. En présence de déterminants antigéniques communs des micro-organismes et du tissu pulmonaire, ou si le tissu pulmonaire est endommagé par des virus, des micro-organismes, des toxines et des substances toxiques, entraînant la manifestation de ses propriétés antigéniques, des processus autoallergiques se développent. Ces processus contribuent à une existence plus longue de changements pathologiques et à une évolution prolongée de la maladie. Image clinique. Principaux syndromes : 1) intoxication (faiblesse générale, fatigue, maux de tête et douleurs musculaires, essoufflement, palpitations, pâleur, perte d'appétit) ; 2) un syndrome de modifications inflammatoires générales (sensation de chaleur, frissons, fièvre, modifications de la formule sanguine en phase aiguë : leucocytose avec déplacement de la formule leucocytaire vers la gauche, augmentation de la VS, taux de fibrinogène, α2-globulines, l'apparition de la protéine C-réactive); 3) un syndrome de modifications inflammatoires du tissu pulmonaire (apparition de toux et d'expectorations, raccourcissement du son de percussion), augmentation du tremblement de la voix et de la bronchophonie, modifications de la fréquence et de la nature de la respiration, apparition de râles humides, modifications radiologiques ; 4) syndrome d'atteinte d'autres organes et systèmes. La gravité de ces manifestations caractérise la gravité de l'évolution de la pneumonie (voir tableau 11). Tableau 11 Symptômes et évolution de la pneumonie
A différents stades de l'évolution de la pneumonie, le tableau clinique peut évoluer du fait de l'adjonction de certaines complications : pulmonaires et extrapulmonaires. Pulmonaire : formation d'abcès ; pleurésie (para- et métapneumonique), moins souvent - empyème pleural; l'adhésion d'une composante asthmatique, la formation d'un œdème pulmonaire et le développement d'une insuffisance respiratoire aiguë est possible. Complications extrapulmonaires: choc infectieux-toxique (avec symptômes d'insuffisance aiguë vasculaire, ventriculaire gauche et rénale aiguë, ulcération de la membrane muqueuse du tube digestif et saignement, développement d'une coagulation intravasculaire disséminée; myocardite infectieuse-allergique; endocardite infectieuse; péricardite; méningite ou méningo-encéphalite, néphrite, hépatite Dans la pneumonie croupeuse sévère, des psychoses d'intoxication peuvent se développer, et dans la pneumonie totale confluente - cœur pulmonaire aigu. Les principales plaintes d'un patient atteint de pneumonie: toux, production d'expectorations, douleurs thoraciques, aggravées par la respiration et la toux, essoufflement, altération du bien-être général, fièvre. La toux peut être sèche ou accompagnée d'expectorations (muqueuse, mucopurulente, purulente-muqueuse, sanglante). Les crachats "rouillés" sont caractéristiques de la pneumonie lobaire, sanglante - pour la pneumonie causée par Klebsiella (bacille de Fridlander) et la pneumonie virale ; les crachats sanglants purulents indiquent une pneumonie d'origine streptococcique. Une toux persistante avec une petite quantité d'expectorations mucopurulentes est observée avec une pneumonie mycoplasmique, qui se caractérise également par une sensation de douleur dans la gorge. La douleur sur le côté, aggravée par la respiration profonde et la toux, est caractéristique de la pneumonie lobaire à pneumocoque, ainsi que de l'implication de la plèvre dans le processus pathologique. Avec la localisation de la pneumonie dans les parties inférieures des poumons et l'implication de la plèvre diaphragmatique dans le processus, la douleur peut irradier vers la cavité abdominale, simulant une image d'un abdomen aigu. Si le segment de roseau supérieur ou inférieur du poumon gauche est impliqué dans le processus, les douleurs sont localisées dans la région du cœur. Chez 25% des patients, la plainte d'essoufflement est l'une des principales, notamment avec une pneumonie qui s'est développée dans un contexte de maladies respiratoires chroniques et d'insuffisance cardiaque. La gravité de l'essoufflement augmente parallèlement à la violation du bien-être général. Les symptômes d'intoxication sévère sont les plus caractéristiques de la pneumonie cornitique et mycoplasmique, et sont également observés dans la pneumonie staphylococcique, grippale et pneumococcique (croupeuse). Le patient peut être dérangé par des frissons et une augmentation de la température corporelle à fébrile. Dans le contexte général d'intoxication et de température fébrile, des symptômes locaux apparaissent. diagnostics. Pour poser un diagnostic étiologique, une évaluation correcte des symptômes de la maladie à son tout début est importante. L'enrouement ou l'incapacité de parler est caractéristique de la pneumonie causée par le virus parainfluenza. Des larmoiements, des douleurs dans les yeux, des maux de gorge lors de la déglutition, des écoulements abondants du nez sans modification des autres parties des voies respiratoires se produisent avec une pneumonie causée par un adénovirus. Le plus important pour le diagnostic est la présence d'un syndrome de modifications inflammatoires du tissu pulmonaire. Ce syndrome se compose des symptômes suivants : 1) retard respiratoire du côté affecté de la poitrine; 2) raccourcissement du son de percussion dans la zone de projection de la lésion sur une étendue plus ou moins grande ; 3) augmentation du tremblement de la voix et de la bronchophonie dans la même zone ; 4) modification de la nature de la respiration (dure, bronchique, affaiblie, etc.); 5) l'apparition de bruits respiratoires pathologiques (râles bouillonnants fins et exprimés humides et crépitants). La nature de la respiration peut changer de différentes manières. Au stade initial de la pneumonie croupeuse, la respiration peut être affaiblie, avec une expiration prolongée; dans la phase d'hépatisation, parallèlement à une augmentation de la matité du son de percussion, une respiration bronchique se fait entendre; avec la résolution du foyer pulmonaire avec une diminution de la matité de la percussion, la respiration devient difficile. Avec la pneumonie focale, les symptômes les plus constants sont une respiration difficile et des râles bouillonnants fins et humides. Cependant, avec la pneumonie hilaire centrale, les données physiques sont très mal présentées et la reconnaissance de la pneumonie n'est possible qu'après un examen radiologique. Les pneumonies à mycoplasmes se distinguent par la rareté des données physiques. Une intoxication sévère, associée à un très petit nombre de sifflements, est observée dans la pneumonie causée par la pneumonie à Klebsiella. Dans certains cas, lors de l'auscultation, un grand nombre de râles secs graves et aigus, non caractéristiques du syndrome d'infiltration inflammatoire, peuvent apparaître. Cela se produit avec une pneumonie qui s'est développée dans le contexte d'une bronchite chronique; pneumonie causée par le bâton de Pfeiffer ; en cas d'accession à la pneumonie d'une composante allergique. Les symptômes aident à poser un diagnostic étiologique : 1) la détection d'une éruption cutanée à petites taches, comme dans le cas de la rubéole, associée à une lymphadénopathie est caractéristique de l'infection à adénovirus; 2) l'hypertrophie locale des ganglions lymphatiques indique une pneumonie périfocale ; 3) pneumonie fongique associée à des lésions des muqueuses, de la peau et des ongles ; 4) le syndrome hépatoliénal et un léger ictère sont retrouvés dans les pneumonies cornitiques et curickettsiennes ; 5) pour la pneumonie croupeuse typique, l'aspect du patient est caractéristique : visage pâle avec rougeur fébrile du côté de la lésion, éruptions herpétiques, gonflement des ailes du nez lors de la respiration. La méthode la plus importante pour clarifier la présence d'une pneumonie et le degré d'implication du tissu pulmonaire dans le processus est la fluorographie à grand cadre et l'examen radiologique des organes thoraciques. Les pneumonies staphylococciques se distinguent par une segmentation claire des lésions pulmonaires avec l'implication de plusieurs segments dans le processus. Leur signe radiologique caractéristique est la formation de multiples cavités dans les poumons de type pneumocèle le 5-7ème jour après le début de la maladie, et plus tard - des cavités nécrotiques avec présence de liquide. Contrairement aux véritables abcès, la configuration et le nombre de cavités changent rapidement. La lésion lobaire est une manifestation de la pneumonie croupeuse ou de la pneumonie causée par Klebsiella. Le lobe supérieur, principalement le poumon droit, est le plus souvent touché. L'examen radiologique révèle un épanchement dans la cavité pleurale. Souvent, un tel épanchement se produit avec une pneumonie streptococcique, avec une pneumonie causée par le bâton de Pfeiffer, qui est localisée dans le lobe inférieur et chez 2/3 des patients capture plus d'un lobe du poumon. Les données d'examen aux rayons X sont particulièrement importantes pour détecter une pneumonie avec de légers changements auscultatoires (pneumonie interstitielle et hilaire). Dans certains cas, pour clarifier le diagnostic, la tomographie et la bronchographie sont indiquées, ce qui aide à clarifier le diagnostic en cas de régression retardée des changements infiltrants, avec une évolution compliquée (abcès, épanchement dans la cavité pleurale). Ils sont utilisés pour exclure d'autres processus pathologiques avec des présentations cliniques et radiologiques similaires. La bronchographie révèle des cavités de décomposition dans le tissu pulmonaire, ainsi que la présence de bronchectasies, autour desquelles, lors de l'exacerbation, des modifications infiltrantes (pneumonie périfocale) sont possibles. Dans le diagnostic de la pneumonie à infarctus, une étude radionucléide du flux sanguin pulmonaire joue un certain rôle, révélant ses violations. L'examen bactériologique des crachats (ou des lavages bronchiques) avant de prescrire des antibiotiques permet de détecter l'agent pathogène et de déterminer sa sensibilité aux antibiotiques. Pas toujours identifié micro-organisme est l'agent causal de la pneumonie. Un diagnostic étiologique plus précis peut être posé grâce à des études immunologiques : réaction de fixation du complément (RCC) et réaction d'inhibition de l'hémagglutination (HITA) avec des antigènes viraux et bactériens. Dans le diagnostic des pneumonies virales et viro-bactériennes, les études virologiques et sérologiques sont importantes (résultats d'une étude de culture de crachats, comprenant un test biologique chez la souris, une méthode de culture de virus dans un embryon de poulet en développement, une méthode d'immunofluorescence, un méthode sérologique utilisant des sérums appariés contre les virus, attachent de l'importance à une augmentation de seulement 4 fois du titre d'anticorps). L'examen des expectorations aide à clarifier la nature de la pneumonie. Un grand nombre d'éosinophiles indique des processus allergiques, la présence de cellules atypiques indique une pneumonie d'origine cancéreuse; Mycobacterium tuberculosis se trouve dans la tuberculose; fibres élastiques - preuve de l'effondrement du tissu pulmonaire. Avec la pneumonie mycosique, ainsi que la détection de champignons, l'absence de flore pyogénique est notée en raison de l'effet inhibiteur des déchets de champignons. Selon la microscopie des frottis d'expectoration colorés au Gram, on peut parler de micro-organismes gram-négatifs ou gram-positifs qui vivent dans les bronches dès le premier jour du séjour du patient à l'hôpital. La sévérité du processus inflammatoire est jugée par la sévérité des paramètres sanguins de la phase aiguë et leur dynamique (leucocytose avec modification de la formule leucocytaire, augmentation de la VS, augmentation de la teneur en α2-globulines, fibrinogène, apparition de SRV, augmentation du taux d'acides sialiques). Avec une évolution prolongée de la pneumonie et le développement de complications, la réactivité immunologique du corps est étudiée. Une diminution de l'immunité humorale (IgM) et cellulaire (migration retardée des leucocytes, modifications des tests caractérisant le système lymphocytaire T) nécessite un traitement immunomodulateur. traitement. Immédiatement après le diagnostic, il est nécessaire de commencer un traitement étiotrope pour la pneumonie. Les idées empiriques sur un éventuel agent pathogène sont d'une grande importance, car l'examen bactériologique des crachats est effectué pendant une période assez longue et chez la plupart des patients, même avec une approche moderne de cette étude, donne des résultats incertains et parfois erronés. À l'heure actuelle, les pénicillines ont perdu leur importance en tant que médicament de choix dans le traitement de la pneumonie. Cela est dû au fait que les micro-organismes intracellulaires obligatoires - Mycoplasma pneumoniae et Chlamydia pneumoniae, résistants aux effets bactéricides des antibiotiques du groupe β-lactame, sont étiologiquement importants pour le développement de la pneumonie, en plus du pneumocoque et de l'Haemophilus influenzae. Il est impossible de perdre de vue le fait que l'hypersensibilité à ces médicaments se développe rapidement chez les patients. En relation avec ce qui précède, dans le traitement de la pneumonie, une grande attention est accordée aux macrolides, qui se sont avérés efficaces non seulement contre le pneumocoque, mais également contre Mycoplasma pneumoniae, Chlarnydia pneumoniae. Cependant, il ne faut pas perdre de vue que l'érythromycine, qui est le standard de ce groupe de médicaments en raison de sa faible stabilité en milieu acide (et donc de sa faible biodisponibilité), ainsi que la prévalence généralisée des souches de pneumocoque résistant à l'érythromycine, perd sa valeur clinique. En tant que médicaments de choix, il a été remplacé par d'autres médicaments de la classe des macrolides - azithromycine, roxithromycine, rovamycine, etc. Un certain nombre de macrolides sont également utilisés pour une utilisation orale et parentérale (par exemple, la rovamycine). En conséquence, leur utilisation est justifiée dans l'évolution sévère du processus inflammatoire pulmonaire (par exemple, la rovamycine est initialement administrée par voie intraveineuse pendant 2 à 3 jours, puis, avec une dynamique positive du processus pathologique, le patient passe à prendre ce médicament par voie orale). L'avantage de la rovamycine est indéniable, car elle n'interagit pas avec les théophyllines, tout en prévenant la possibilité d'un surdosage de ces médicaments, puisque les théophyllines et la rovamycine sont utilisées ensemble dans le traitement des patients atteints de maladies pulmonaires obstructives chroniques. Il est également connu que ce sous-groupe de macrolides (macrolides à 16 chaînons) sont des médicaments avec un niveau minimum d'effets secondaires. Chez les patients âgés de plus de 65 ans, en raison de l'hétérogénéité du spectre étiologique de la pneumonie et des maladies pulmonaires obstructives chroniques concomitantes, les pénicillines semi-synthétiques peuvent être utilisées pour l'antibiothérapie initiale, et en l'absence d'effet positif après cette thérapie pendant 3 -4 jours, l'utilisation des céphalosporines est justifiée. Il est important de rappeler que le spectre d'action des céphalosporines de génération I et de certaines générations II est celui des micro-organismes gram-positifs et gram-négatifs, et que les céphalosporines de génération III agissent principalement sur les pathogènes gram-négatifs. Les céphalosporines de la génération I sont représentées par la céphalothine (Keflin), la céfazoline (Kefzol), etc. Les médicaments de la génération II comprennent le céfuroxime (Ketocef), la céfoxitine (Boncefin) et d'autres. Longacef). Les pneumonies par aspiration sont associées à une microflore anaérobie ou à Gram négatif, ce qui détermine l'utilisation d'aminoglycosides ou de céphalosporines de troisième génération en association avec le semisuccinate de métronidazole (500 mg par voie intraveineuse 2 à 3 fois par jour). Les états d'immunodéficience affectent également la nature des médicaments sélectionnés, qui dans ce cas dépend de la nature de l'agent pathogène. Dans de tels cas, le schéma appliqué consiste en des aminoglycosides et des céphalosporines modernes. La durée d'une antibiothérapie efficace pour un patient atteint de pneumonie est de 7 à 10 jours. Lors de la prescription d'un traitement, il convient de tenir compte du fait que dans 7 à 15% des cas, ce traitement peut ne pas avoir d'effet. Cela indique la nécessité de remplacer les antibiotiques, sur la base des résultats d'une étude microbiologique. Une autre option est l'utilisation de médicaments alternatifs, les antibiotiques dits de second choix : céphalosporines modernes, imipénem, monobactames, fluoroquinolones. Les fluoroquinolones (ofloxacine, péfloxacine, ciprofloxacine) sont efficaces contre les agents pathogènes à Gram négatif, y compris Pseudomonas aeruginosa et certains cocci à Gram positif (Staphylococcus aureus), mais sont inactifs lorsqu'ils sont exposés à des anaérobies. Les fluoroquinolones peuvent légitimement être considérées comme une alternative aux macrolides dans les infections à chlamydia, légionelles et mycoplasmes. Les antibiotiques monobactames sous leur forme moderne sont représentés par l'aztréonam (azactam), qui est actif principalement contre les aérobies gram-négatifs (Salmonella, Shigella, Proteus, Escherichia coli, Klebsiella, etc.); et est également stable sous l'action des β-lactamases. Imipénème - un médicament antibactérien du groupe des carbapénèmes, n'est prescrit qu'en association avec la cilastatine, qui inhibe le métabolisme de l'imipénème. Le médicament est très efficace contre de nombreux anaérobies, coques gram-positifs et bâtonnets gram-négatifs. Dosage des antibiotiques utilisés dans le traitement de la pneumonie. 1) Pénicillines : benzylpénicilline (500 000-1 000 000 UI par voie intraveineuse toutes les 6 à 8 heures ou 500 000 à 1 000 000 UI toutes les 4 heures par voie intramusculaire), ampicilline (0,5-1,0-2,0 g par voie intramusculaire toutes les 6 à 8 heures ou 0,5 g toutes les 6 heures par voie intraveineuse), amoxicilline (0,5-1,0 g toutes les 8 heures par voie orale ou 0,5-1,0 g toutes les 8-12 heures par voie intramusculaire, intraveineuse), oxacilline ( 0,5 g toutes les 4-6 heures par voie orale, intramusculaire, intraveineuse). 2) Céphalosporines: I génération - céphalothine (keflin) (0,5-2,0 g toutes les 4-6 heures par voie intramusculaire, intraveineuse), céfazoline (kefzol) (0,5-2,0 g, toutes les 8 heures par voie intramusculaire, intraveineuse ), II génération - céfuroxime (zinacef , kétocef) (0,75-1,5 g toutes les 6-8 heures par voie intramusculaire, intraveineuse), génération III - céfotaxime (claforan) (1,0-2,0 g, maximum jusqu'à 12 g / jour toutes les 12 heures par voie intramusculaire, intraveineuse), ceftriaxone (longacef, rocéfine) (1,0-2,0-4,0 g toutes les 24 heures par voie intramusculaire, intraveineuse). 3) Aminoglycosides : génétamycine (80 mg toutes les 12 heures par voie intramusculaire, intraveineuse), amikacine (10-15 mg/kg toutes les 12 heures par voie intramusculaire, intraveineuse), tobramycine (brulamycine) (3-5 mg/kg toutes les 8 heures par voie intramusculaire, intraveineuse) . 4) Macrolides : érythromycine (0,5 g toutes les 6 à 8 heures par voie orale ou 0,5 à 1,0 g toutes les 6 à 8 heures par voie intraveineuse), rovamycine (3,0 millions d'UI toutes les 8 à 12 heures par voie orale ou 1,5, 3,0 à 8 millions d'UI toutes les 12 à XNUMX heures). heures par voie intraveineuse). 5) Fluoroquinolones : péfloxacine (léflacine) (400 mg toutes les 12 heures par voie orale, IV), ciprofloxacine (cyprobay) (500 mg toutes les 12 heures par voie orale ou 200-400 mg toutes les 12 heures par voie intraveineuse), ofloxacine (zanocine, tarivid) (200 mg toutes les 12 heures par voie orale). 6) Tétracyclines : doxycycline (vibramycine) (200 mg le jour 1, les jours suivants - 100 mg toutes les 24 heures par voie orale), minocycline (minocine) (200 mg le jour 1, les jours suivants - 100 mg toutes les 12 heures par voie orale), aztréonam (azactam) (1,0 à 2,0 g toutes les 8 à 12 heures), imipénème/cilstatine (thiénam) (500 mg toutes les 6 à 8 heures par voie intramusculaire). Il est également significatif qu'en règle générale, une évolution prolongée ou progressive de la maladie soit due à une antibiothérapie initiale inadéquate. Cependant, en plus de cela, il existe un certain nombre de causes locales et systémiques qui conduisent à une évolution longue et persistante de l'inflammation dans les poumons : il s'agit de l'obstruction locale des voies respiratoires (cancer, adénome, blocage mucoïde, etc.) ; bronchectasie (congénitale, acquise); fibrose kystique; défauts du système immunitaire (acquis); aspiration récurrente (achalasie, cancer de l'œsophage, etc.); activation de l'infection tuberculeuse latente; développer un abcès pulmonaire; antibiothérapie inadaptée. CONFÉRENCE N° 9. Maladies du tube digestif. Maladies de l'oesophage. Oesophagite et ulcère peptique de l'oesophage 1. Œsophagite aiguë L'oesophagite aiguë est une lésion inflammatoire de la muqueuse de l'oesophage qui dure de quelques jours à 2-3 mois. Étiologie et pathogenèse. Facteurs étiologiques : maladies infectieuses, blessures, brûlures, intoxications, réactions allergiques, erreurs nutritionnelles. Parmi les agents infectieux, les plus caractéristiques de l'œsophagite aiguë sont la diphtérie, la scarlatine, la typhoïde et le typhus, la grippe, le parainfluenza, l'infection à adénovirus, les oreillons. Les facteurs de dommages physiques et chimiques sont représentés par les rayonnements ionisants, les brûlures chimiques, les aliments chauds et très froids et les épices. Classification. Il n’existe pas de classement unique. Il est possible d'utiliser une classification de travail de l'œsophagite aiguë. Morphologiquement, les types d'œsophagite aiguë répertoriés sont distingués: catarrhal, œdémateux, érosif, pseudomembraneux, hémorragique, exfoliatif, nécrotique, phlegmoneux. Par étiologie : infectieuse, chimique, physique, alimentaire. Par stades endoscopiques: 1er - œdème et hyperémie de la muqueuse, 2ème - apparition d'érosions uniques au sommet des plis muqueux œdémateux, 3ème - œdème important et hyperémie de la muqueuse avec foyers de muqueuses érodées et saignantes, 4ème - " pleurant "- membrane muqueuse érodée de manière diffuse, saigne au moindre contact de l'endoscope. Image clinique. L'œsophagite catarrhale est la forme la plus courante d'œsophagite aiguë. Cela se produit dans le contexte d'erreurs nutritionnelles: en mangeant des aliments épicés, froids et chauds, avec des blessures mineures, des brûlures d'alcool. Elle se manifeste cliniquement par des brûlures et des douleurs derrière le sternum, obligeant les patients à refuser de s'alimenter pendant plusieurs jours. Œsophagite I-II notée par endoscopie, radiographie - hyperkinésie de l'œsophage. L'œsophagite érosive survient avec des maladies infectieuses (finn, typhus, septicémie, processus fongiques) et des allergies. Il apparaît également avec des brûlures chimiques et des lésions de l'œsophage. En fait, cette forme d'oesophagite est une phase de l'évolution de l'oesophagite catarrhale. Le tableau clinique principal est constitué des symptômes de la maladie sous-jacente. Les symptômes cliniques sont similaires à ceux de l'oesophagite catarrhale : douleurs importantes dans la poitrine lors du passage des aliments ; brûlures d'estomac, éructations, hypersalivation, odeur putride de la bouche (cacosmie). Vérifier par endoscopie les signes d'œsophagite II-III degré. L'examen histologique a révélé une hyperémie, un œdème des muqueuses, une hémorragie, une érosion. Un examen radiographique montre une abondance de mucus dans l'œsophage, une restructuration du relief avec formation de dépôts de baryum plats de forme longitudinale atteignant 1 cm de long et une hyperkinésie des parois œsophagiennes. L'oesophagite hémorragique est une forme clinique rare d'oesophagite érosive. L'étiologie est la même que dans l'œsophagite érosive. Le syndrome douloureux intense et l'hématémèse sont cliniquement typiques. L'endoscopie révèle une inflammation de grade III-IV avec une prédominance de la composante hémorragique. Il y a un décollement de la membrane muqueuse saignante sous la forme de fines bandes étroites. Œsophagite fibrineuse (pseudomembraneuse). Les facteurs étiologiques sont la scarlatine, la diphtérie, les maladies du sang, les maladies fongiques, les effets de la radiothérapie. La clinique est dominée par la dysphagie et des douleurs intenses, aggravées après avoir mangé, des nausées, des vomissements. Avec le vomi, des films de fibrine sont libérés, il peut y avoir une hémoptysie. Endoscopiquement, sur les zones touchées de la muqueuse, on trouve des plaques fibrineuses grises et jaune-gris, formées par des couches de fibrine et de détritus recouvrant la surface de la muqueuse. Avec le rejet des pseudomembranes, des érosions plates cicatrisant lentement se forment, parfois des ulcères saignants. Après un processus infectieux sévère, des sténoses membraneuses subsistent dans l'œsophage, qui disparaissent après un boudinage répété. L'œsophagite membraneuse (exfoliative) par étiologie est chimique (brûlures de l'œsophage), infectieuse (les causes sont la septicémie, le zona, la variole, l'herpès généralisé). La clinique de la maladie est variable - des formes bénignes, diagnostiquées par endoscopie, aux formes graves. Dans la clinique de l'oesophagite membraneuse sévère, l'intoxication, la dysphagie et le syndrome douloureux prévalent. Saignement possible, perforation de l'œsophage, médiastinite, qui, en règle générale, se termine par la mort. Lors de l'examen endoscopique, on observe des dommages à toutes les couches de l'œsophage, dont l'épithélium est rejeté par les couches. Lorsque la maladie sous-jacente disparaît, des sténoses cicatricielles symétriques et asymétriques membraneuses ou rugueuses subsistent parfois dans l'œsophage. L'œsophagite nécrosante est une forme rare d'inflammation aiguë de l'œsophage. Son développement est facilité par une immunité réduite dans des maladies aussi graves que la septicémie, la fièvre typhoïde, la candidose, l'insuffisance rénale terminale. La clinique se caractérise par une dysphagie douloureuse, des vomissements, une faiblesse générale, des saignements, le développement fréquent d'une médiastinite, une pleurésie, une pneumonie. Après le traitement de la maladie sous-jacente, des sténoses subsistent dans l'œsophage, diagnostiquées comme des modifications précancéreuses facultatives. L'œsophagite septique est une inflammation locale ou diffuse rare des parois de l'œsophage d'étiologie streptococcique ou survient lorsque la muqueuse est endommagée par un corps étranger, avec des brûlures, des ulcérations, et peut passer des organes voisins. Parfois, l'œsophagite phlegmoneuse aiguë survient comme une complication de toute forme d'œsophagite aiguë, entraînant une fusion purulente des parois de l'œsophage. L'effondrement des parois s'accompagne d'une percée de pus dans le tissu du médiastin, du développement d'une médiastinite, d'une pleurésie, d'une bronchite purulente, d'une pneumonie, d'une spondylarthrite, d'une rupture de l'aorte ou d'autres gros vaisseaux. L'apparition d'une infection anaérobie peut entraîner un emphysème médiastinal ou un pneumothorax spontané. Le tableau clinique est caractérisé par une intoxication sévère, une forte fièvre, des douleurs derrière le sternum et dans le cou, des vomissements. À l'examen, il y a un gonflement dans le cou, la mobilité dans cette partie de la colonne vertébrale est limitée. La position de la tête est forcée, avec une inclinaison d'un côté. La maladie se transforme souvent en médiastinite purulente. Dans les tests sanguins - hyperleucocytose, ESR accélérée. L'examen instrumental (radiographie, endoscopie) au stade aigu n'est pas indiqué. Pendant la période de cicatrisation, un examen radiographique est obligatoire en raison du risque de développer des déformations grossières et une sténose cicatricielle de l'œsophage. traitement. Principes de traitement de l'œsophagite aiguë : étiotrope, pathogénétique et symptomatique. Traitement étiotropique - traitement de la maladie sous-jacente. Dans les maladies infectieuses compliquées d'œsophagite aiguë, des antibiotiques sont utilisés (par voie parentérale). Avec des changements nécrotiques et hémorragiques prononcés dans l'œsophage, il est recommandé de s'abstenir de manger pendant 2-3 semaines. Pendant cette période, la nutrition parentérale, l'administration intraveineuse d'hydrolysats de protéines, de mélanges d'acides aminés, d'intralipides, de vitamines et une thérapie de désintoxication sont indiquées. Après avoir réduit l'inflammation, des aliments thermiquement et chimiquement épargnants sont prescrits: lait chaud, crème, soupes de légumes, céréales liquides. Pour réduire les symptômes locaux d'inflammation - à l'intérieur des solutions de tanin 1%, collargol - 2%, novocaïne - 1-2% avant les repas. Les astringents sont pris en position horizontale avec la tête du lit abaissée. En l'absence d'effet de l'administration locale de préparations astringentes, des analgésiques non narcotiques sont prescrits par voie parentérale. Pour réduire les effets de la dyskinésie œsophagienne, des médicaments procinétiques (cerucal, raglan, cisapride) sont utilisés par voie orale avant les repas. En cas d'érosions multiples, des préparations de bismuth (dénol, vikair), des injections de solcoséryl sont indiquées. Avec l'œsophagite hémorragique, compliquée par des saignements, des préparations d'acide aminocaproïque, vikasol, dicynone sont utilisées. En cas d'hémorragie massive, une transfusion de sang ou de plasma est prescrite. Avec une œsophagite purulente et nécrotique, le patient doit être sous nutrition parentérale pendant une longue période, une thérapie massive avec plusieurs antibiotiques est utilisée et l'abcès est drainé. Les sténoses oesophagiennes sont corrigées par bougienage. Dans de rares cas, une gastrostomie est pratiquée. Prévision. Le pronostic de l'œsophagite catarrhale et érosive est favorable. La disparition spontanée des symptômes de l'œsophagite est possible à condition que la maladie sous-jacente soit correctement corrigée. Le pronostic de l'œsophagite pseudomembraneuse, ecfoliative et phlegmoneuse est grave. Dans tous les cas, sous réserve de guérison de la maladie sous-jacente, l'œsophagite se termine par la formation de rétrécissements cicatriciels, qui nécessitent ensuite une correction. Les patients présentant des formes sévères d'œsophagite compliquées de sténoses œsophagiennes sont incapables de travailler. La prévention de l'œsophagite aiguë consiste en un diagnostic et un traitement adéquats et opportuns de la maladie sous-jacente. 2. Œsophagite chronique L'œsophagite chronique est une inflammation chronique de la muqueuse de l'œsophage pouvant durer jusqu'à 6 mois. La variante la plus courante est l'œsophagite peptique (œsophagite par reflux), qui peut être compliquée par un ulcère peptique de l'œsophage. Étiologie et pathogenèse. La cause principale de la maladie est le reflux constant du contenu gastrique dans l'œsophage, parfois de la bile et du contenu intestinal, c'est-à-dire que l'œsophagite peptique est une brûlure aseptique de l'œsophage par l'acide gastrique. Dans la pathogenèse de l'œsophagite par reflux, la régurgitation du contenu acide et une violation de la purification et de la vidange de l'œsophage sont importantes. Le taux de clairance de l'œsophage à partir d'une irritation chimique est appelé clairance œsophagienne. Avec une clairance normale, un seul reflux de sécrétions agressives ne provoque pas d'œsophagite par reflux. Les aliments chauds, l'alcool, le tabagisme et d'autres facteurs exogènes réduisent la clairance de l'œsophage. Ces facteurs incluent la restauration rapide, dans laquelle une quantité importante d'air est avalée avec la nourriture. La qualité des aliments compte aussi : viandes grasses, saindoux, pâtes, épices piquantes contribuent à retarder l'évacuation des aliments de l'estomac, puis le reflux du contenu dans l'œsophage. Les médicaments diminuent significativement la tonicité du sphincter inférieur de l'œsophage et favorisent le reflux : antagonistes du calcium, nitrates, antalgiques narcotiques, anticholinergiques, théophylline et ses analogues, médicaments du groupe des prostaglandines. Il existe cinq critères de pathogénicité du reflux dans la genèse de l'oesophagite peptique : fréquence, volume, régurgitation, composition chimique, état de la muqueuse oesophagienne et sensibilité à un facteur chimique (l'inflammation des parois diminue la sensibilité), vitesse de vidange (clairance) , qui dépend principalement du péristaltisme actif, de l'action alcalinisante de la salive et du mucus. La survenue d'une œsophagite par reflux est favorisée par une hernie de l'ouverture œsophagienne du diaphragme, un ulcère duodénal, des troubles post-gastrorésection et des allergies. La prédisposition allergique compte également. L'examen morphologique des patients atteints d'œsophagite peptique révèle un œdème, une hyperémie de la muqueuse, une infiltration de la sous-muqueuse du segment supradiaphragmatique de l'œsophage. Il existe deux options pour la propagation de l'inflammation chronique - l'œsophagite par reflux total et local. Avec l'implication dans le processus de plus des 2/3 de la muqueuse œsophagienne, le développement d'une trachéite par reflux, une bronchite par reflux est possible. Au sommet des plis oesophagiens, des érosions, de petits ulcères se produisent (dans les endroits d'irrigation maximale avec le contenu gastrique). L'inflammation chronique de l'œsophage entraîne une contracture spastique et un raccourcissement de l'organe. Image clinique. Les signes typiques de l'œsophagite par reflux comprennent une sensation de brûlure derrière le sternum, des brûlures d'estomac, des régurgitations, qui s'aggravent en position couchée, une dysphagie et l'effet positif de la prise d'antiacides. Des douleurs thoraciques peuvent survenir après avoir mangé, rappelant une angine de poitrine. La survenue de douleurs dans l'œsophagite par reflux est associée à une irritation peptique de la paroi œsophagienne et à ses spasmes lors de la régurgitation du contenu gastrique acide, ainsi qu'à une atteinte de la muqueuse prolabée. Particularités de cette douleur: son caractère long et brûlant, sa localisation dans le processus xiphoïde, son irradiation le long de l'œsophage, moins souvent à la moitié gauche de la poitrine, aucun effet notable de la prise d'antiacides, d'antispasmodiques, augmentée en position horizontale, surtout après en mangeant. Une attention particulière dans le diagnostic clinique doit être accordée aux symptômes mineurs de la dysphagie, tels qu'une sensation de masse derrière le sternum, une sensation d'aliments chauds traversant l'œsophage. Un signe d'œsophagite débutant progressivement peut être la salivation et l'habitude de boire de l'eau avec de la nourriture. L'examen physique des patients atteints d'oesophagite par reflux ne fournit pas d'informations diagnostiques significatives. Les complications de l'œsophagite par reflux comprennent les saignements, les ulcérations, les rétrécissements, le raccourcissement de l'œsophage et la malignité. L'œsophagite chronique par reflux peut entraîner le développement d'une hernie hiatale axiale. Diagnostic et diagnostic différentiel. La méthode de recherche la plus précieuse pour cette pathologie est l'endoscopie, au cours de laquelle on note une hyperémie, un œdème et un épaississement des plis de la membrane muqueuse. Un revêtement blanchâtre recouvrant la membrane muqueuse est fiable, qui dans les premiers stades de la maladie peut être mince, à peine perceptible, mais avec un long processus - blanc massif ou gris sale. Dans certaines zones, sur fond de plaque blanche, la membrane muqueuse rouge vif de l'œsophage est souvent visible. Dans certains cas, des défauts érosifs et ulcéreux sous forme de rayures sont détectés. Les modifications de la muqueuse peuvent correspondre à l’un des quatre stades de l’œsophagite : de l’hyperémie aux « pleurs » de la muqueuse. En cas d'œsophagite sévère, beaucoup de salive et de mucus s'accumulent dans la lumière. La pH-métrie, contrairement à l'endoscopie, permet d'évaluer plus objectivement la clairance œsophagienne. Les radiographies révèlent un reflux gastro-œsophagien. Il est nécessaire de différencier l'œsophagite par reflux avec l'ulcère peptique de l'estomac et du duodénum, la maladie coronarienne, la cholécystite chronique et la pancréatite. Le principal symptôme du diagnostic différentiel est la douleur. La différenciation avec l'ulcère peptique est facilitée par l'absence de douleurs tardives et "affamées" dans l'œsophagite, ainsi que par les données obtenues par endoscopie de l'œsophage et de l'estomac. La douleur coronarienne, contrairement à l'œsophagite, se caractérise par un lien avec le stress physique et émotionnel, l'effet des nitrates, des signes d'ischémie à l'ECG, y compris ceux selon l'ergométrie du vélo. Les données échographiques des organes abdominaux aident à exclure la pathologie de la vésicule biliaire et du pancréas comme cause du syndrome douloureux. traitement. Le traitement de l'œsophagite par reflux comprend le traitement des maladies qui l'ont provoquée et la prescription d'un traitement antireflux. Il est conseillé aux patients d'éviter de soulever des poids, de se pencher. Il est nécessaire de prendre la bonne position pendant le repos et le sommeil (la tête de lit est surélevée de 15-20 cm, à un angle de 30-50 °). Il est recommandé de normaliser le poids corporel, de manger fractionné (le dernier repas - 3 heures avant le coucher). L'alcool et les aliments épicés sont exclus de l'alimentation. Attribuez des adsorbants et des médicaments alcalinisants qui ont un effet protecteur sur la membrane muqueuse. Ces substances comprennent Venter, qui est administré par voie orale à une dose de 1 g (de préférence sous forme de suspension) 30 à 40 minutes avant les repas 3 fois par jour et la 4ème fois à jeun au coucher. La durée du traitement est de 8 à 10 semaines. Almagel, phosphalugel, maalox, gastal ont un effet similaire. Ces médicaments sont utilisés pendant la période interdigestive (1/2-2 heures après les repas et la nuit) jusqu'à la rémission complète. Phosphalugel et Maalox sont prescrits 1-2 paquets 2-3 fois par jour, gastal - 2-3 comprimés par jour. Le soda au thé, un mélange de Bourget, d'argile blanche en raison d'une efficacité insuffisante est déconseillé. Action enveloppante et astringente a nitrate de bismuth 1 g 3-4 fois par jour. Une forte activité antireflux d'un nouvel antiacide, le topalkan, a été notée. Les eaux minérales - "Borjomi", "Essentuki n ° 4", "Jermuk", "Smirnovskaya" ont un effet alcalinisant. Pour réduire la sécrétion gastrique acide, des anti-H sont prescrits.2les récepteurs de l'histamine (cimétidine, ranitidine, famotidine), les inhibiteurs de la Ka-K-ATPase (oméprazole), un bloqueur sélectif des récepteurs M-cholinergiques des cellules pariétales, son analogue buscopan. La cimétidine est prescrite 400 mg 2 fois par jour, la ranitidine - 300 mg et la famotidine - 40 mg une fois le soir après le dîner. L'oméprazole est préconisé dans les formes résistantes d'oesophagite érosive et ulcéreuse par reflux. Il est prescrit à 30-40 mg par jour pendant 3-4 semaines. Pour normaliser les troubles d'évacuation motrice dans le reflux, le métoclopramide (cerucal, raglan, perinorm, biomral), le prépulsid (sizepride, motilium, domperidone, coordinax) sont prescrits. Le métoclopramide et ses analogues de 2e génération augmentent le tonus du sphincter inférieur de l'œsophage, réduisent la pression intragastrique et accélèrent l'évacuation de l'estomac. Attribuez au métoclopramide 1 comprimé 3 à 4 fois par jour avant les repas ou 2 ml par voie intramusculaire 2 fois par jour. Le médicament est généralement bien toléré. Lors de son utilisation, la bouche sèche, la somnolence, les acouphènes sont possibles, ce qui diminue après avoir mangé. Sizepride est un nouvel agent procinétique gastro-intestinal. Il augmente la tonicité du sphincter inférieur de l'œsophage, améliore la clairance œsophagienne, améliore la fonction d'évacuation motrice du tube digestif et supprime les reflux pathologiques (gastro-œsophagiens et duodénogastriques). Le médicament, contrairement au métoclopramide, ne bloque pas les récepteurs de la donamine, n'est pas un stimulant direct des récepteurs anticholinergiques et est dépourvu d'effets secondaires inhérents au cérucal et à ses analogues. Il est prescrit par voie orale à raison de 5 ou 10 mg 2 à 3 fois par jour. Le cours du traitement dure de 2-3 semaines à 2-3 mois. Le césapride avec œsophagite par reflux peut être utilisé en monothérapie. Pronostic et prévention. Le pronostic pour la vie et le travail est favorable. Dans les cas compliqués, le pronostic est déterminé par la rapidité et la qualité des soins médicaux. Les patients atteints d'une maladie grave se voient attribuer un groupe de handicap. Les patients atteints d'œsophagite chronique par reflux doivent être sous la surveillance d'un gastro-entérologue. Des études endoscopiques et morphologiques sont indiquées au moins 2 fois par an en raison de la possibilité de malignité. 3. Ulcère peptique de l'œsophage L'ulcère peptique de l'œsophage est une maladie aiguë ou chronique caractérisée par une ulcération de la muqueuse de l'œsophage distal sous l'influence du suc gastrique actif. Étiologie et pathogenèse. Les ulcères gastroduodénaux chroniques de l'œsophage sont des complications de l'œsophagite par reflux et de la hernie hiatale. Leur apparition est facilitée par un œsophage court interne, une métaplasie focale de la muqueuse, une hétérotopie de la muqueuse gastrique dans l'œsophage, un reflux avec insuffisance cardiaque, des maladies accompagnées de vomissements fréquents (syndrome post-vagotomie, syndrome de l'anse afférente, alcoolisme chronique). Des ulcères aigus de l'œsophage sont possibles avec une sécheresse pathologique de la muqueuse œsophagienne (xérose), des allergies médicamenteuses, l'utilisation d'AINS, des infections fongiques, des infections virales, des brûlures cutanées et des maladies du système nerveux central. Ces ulcères sont considérés comme symptomatiques. Image clinique. Certains patients présentent une lésion ulcéreuse combinée de la membrane muqueuse de l'œsophage et de la zone gastroduodénale. Les symptômes d'un ulcère gastroduodénal de l'œsophage ressemblent au tableau clinique de l'œsophagite gastroduodénale : des brûlures d'estomac persistantes, s'aggravant après avoir mangé, en pliant le corps, en position couchée, des régurgitations, des douleurs lors de la déglutition et un passage altéré des aliments solides surviennent. Complications typiques des ulcères de l'œsophage : perforation, saignement, pénétration, sténose. Le saignement se manifeste par une hématémèse, un méléna, une anémie hypochrome et une diminution de l'activité cardiaque. La perforation de l'œsophage est diagnostiquée extrêmement rarement. Les symptômes cliniques de la perforation sont indiscernables des symptômes de lésions mécaniques aiguës pénétrantes et non pénétrantes par des corps étrangers. Environ 14 % des ulcères de l'œsophage pénètrent dans les tissus environnants. Diagnostic et diagnostic différentiel. Il est extrêmement difficile de suspecter un ulcère gastroduodénal sur la base des symptômes cliniques. Le diagnostic est vérifié lors d'études instrumentales et en laboratoire. Le plus informatif est l'examen radiographique et endoscopique. Radiologiquement, l'ulcère apparaît comme une niche dans l'œsophage supracardiaque avec un léger œdème périfocal de la muqueuse. L'œsophage dans la zone de l'ulcère est contracté spasmodiquement et une légère expansion suprasténotique est détectée au-dessus. L'ulcère s'accompagne de signes d'hyperkinésie et d'œsophagite par reflux, et les symptômes de hernie hiatale sont très fréquents. Parfois, l'ulcère ressemble à un petit diverticule épiphrénique, mais ce dernier n'a pas d'évolution clinique typique et n'est pas associé à une insuffisance cardiaque, une hernie ou une œsophagite. Il est plus difficile de distinguer un ulcère peptique de l'œsophage d'un cancer endophytique ulcéré, qui s'accompagne d'une rigidité des parois et d'un relief de la muqueuse, et d'une diaphyse asymétrique, par des signes radiologiques. L'information la plus fiable dans la vérification de l'ulcère peptique de l'œsophage est fournie par l'endoscopie et la biopsie multiple des bords de l'ulcère. Lors de l'avancement de l'endoscope vers l'ulcère peptique, des signes d'œsophagite de stade I-IV, de dysfonctionnement moteur de l'œsophage, d'œdème périfocal et d'hyperémie de la membrane muqueuse sont révélés. Un ulcère aigu est généralement rond ou ovale, avec des bords abrupts, recouvert d'un enduit blanchâtre ou vert. Un ulcère chronique a un fond plat avec des parois denses et inégales, des bords doux, des dépôts purulents-fibrineux, des foyers de granulations et des superpositions cicatricielles. Pour exclure la malignité, 4 à 6 biopsies sont prélevées sur les bords de l'ulcère. L'examen endoscopique révèle des défauts peptiques uniques, allongés le long de l'axe de l'œsophage. Leur longueur varie entre 1 et 10 cm, mais le plus souvent ne dépasse pas 1 cm.L'ulcère est souvent peu profond, son fond est recouvert d'un revêtement blanchâtre. L'hyperémie, l'œdème muqueux et les érosions uniques traduisent souvent une réaction inflammatoire périfocale modérée. Après la guérison d'un ulcère peptique, une cicatrice rugueuse linéaire ou étoilée ou une déformation rugueuse de la paroi en forme de diverticule et un rétrécissement de la lumière restent dans l'œsophage. Il est nécessaire de différencier les ulcères peptiques de l'œsophage des ulcérations de nature spécifique (avec tuberculose, syphilis). Dans ces situations, des tests sérologiques spécifiques, les résultats d'études histologiques et bactériologiques sont d'une aide significative. La combinaison de la pathologie de l'œsophage avec des dommages aux poumons et à d'autres organes rend nécessaire l'examen délibéré du patient par rapport à un processus spécifique. traitement. Le traitement comprend un régime : une alimentation mécaniquement et chimiquement douce est recommandée, à prendre en petites portions 5 à 6 fois par jour. Pour éviter le reflux du contenu de l'estomac vers l'œsophage, la position du patient au lit doit être avec la tête du lit surélevée. Les médicaments se prennent en position couchée. La monothérapie est prescrite avec un médicament appartenant à l'un des groupes pharmacologiques suivants : antisécrétoires, comprenant des antiacides et des adsorbants, stimulants de la fonction d'évacuation motrice de l'estomac (prokinétique), médicaments - simulateurs de mucus. La thérapie est effectuée pendant une longue période - 1,5 à 3 mois. Indications de traitement chirurgical - absence de cicatrisation dans les 6 à 9 mois, évolution compliquée (perforation, pénétration, sténose, saignement). Pronostic et prévention. L'évolution de la maladie est récidivante. Le pronostic pour la vie et le travail est favorable. Un examen périodique (1 à 2 fois par an) en ambulatoire par un gastro-entérologue par endoscopie et biopsie est recommandé. La prévention saisonnière (printemps - automne) de l'oesophagite par reflux est réalisée. CONFÉRENCE N° 10. Maladies du tube digestif. Maladies de l'estomac. Gastrite chronique La gastrite chronique est une maladie qui se caractérise cliniquement par la dyspepsie gastrique et morphologiquement - par des modifications inflammatoires et dégénératives de la muqueuse gastrique, des processus de renouvellement cellulaire altérés et une augmentation du nombre de plasmocytes et de lymphocytes dans la membrane muqueuse. Étiologie et pathogenèse. Au stade actuel de développement de la gastro-entérologie, il a été établi que l'apparition de gastrite chronique est facilitée par l'expansion microbienne d'Helicobacter pylori (HP), qui provoque une gastrite antrale dans 95 % des cas et une pangastrite dans 56 % des cas. À leur tour, les facteurs dits étiologiques de la survenue d'une gastrite chronique peuvent être attribués avec un haut degré de certitude à des facteurs de risque (alimentation irrégulière déséquilibrée, tabagisme, consommation d'alcool, hypersécrétion d'acide chlorhydrique et de pepsine). Le rôle principal dans le développement de la maladie appartient également aux mécanismes auto-immuns, accompagnés d'une accumulation d'anticorps dirigés contre les cellules pariétales de la muqueuse gastrique, d'une hérédité aggravée, ainsi que de l'utilisation de médicaments ayant un effet néfaste sur la muqueuse gastrique. Classification. En 1990, lors du IXe Congrès international des gastro-entérologues en Australie, une nouvelle systématisation de la gastrite chronique, appelée système de Sydney, a été adoptée. Bases histologiques de la classification. 1) Étiologie : gastrite chronique associée à HP, gastrite aiguë auto-immune, idiopathique, médicamenteuse. 2) Topographie : antrale, fundique, pangastrite. 3) Morphologie : formes aiguës, chroniques, particulières. Base de classification endoscopique : 1) gastrite de l'antre de l'estomac; 2) gastrite du corps de l'estomac; 3) pangastrite ; 4) modifications de la muqueuse gastrique : œdème, érythème, vulnérabilité muqueuse, exsudat, érosions plates, érosions surélevées, hyperplasie des plis, atrophie des plis, visibilité du schéma vasculaire, hémorragies supramuqueuses. Image clinique. La gastrite chronique est l'une des maladies les plus courantes en clinique de médecine interne. Sa fréquence parmi les habitants de la planète varie de 28 à 75 %. La gastrite chronique se manifeste plus souvent par des symptômes de dyspepsie gastrique et des douleurs dans la région épigastrique. Rarement, il est asymptomatique. La douleur est généralement localisée dans la région épigastrique. Il existe un lien clair entre son apparition avec l'apport alimentaire et la localisation du processus inflammatoire dans l'estomac. Chez les patients souffrant de gastrite des sections sous-cardiale et cardiale de l'estomac, une douleur dans la région épigastrique survient 10 à 15 minutes après un repas, avec une pathologie du corps de l'estomac - 40 à 50 minutes après un repas. Les douleurs "tardives", "affamées", sont typiques de la gastrite de la section de sortie de l'estomac, ou duodénite. Une douleur «à deux vagues» - après avoir mangé et à jeun - est observée avec une gastrite du sous-cardiaque et de l'antre. Avec un processus diffus, la douleur est localisée dans la région épigastrique, survient après avoir mangé et est de nature pressante. Ils parlent de l'évolution asymptomatique de la gastrite lorsqu'il n'est pas possible d'établir la relation entre la douleur dans la région épigastrique et la lésion, qui survient lorsqu'elle est d'origine endogène (la gastrite devient secondaire à la pathologie d'autres organes et systèmes). Une place tout aussi importante dans le tableau clinique de la gastrite chronique est le syndrome dyspeptique: nausées, éructations (aigres, amères, pourries), brûlures d'estomac, constipation ou diarrhée, selles instables. Avec la gastrite antrale isolée, les plaintes de brûlures d'estomac et de constipation, résultant de l'hypersécrétion d'acide chlorhydrique et de pepsine, deviennent primordiales. Avec une pangastrite avec des signes d'atrophie sévère, des nausées, des éructations "pourries", des selles instables ou une diarrhée prédominent, ce qui est typique de l'hyposécrétion d'acide chlorhydrique et de pepsine. Les nausées persistantes sont caractéristiques de la gastrite secondaire dans la pancréatite chronique, la cholécystite chronique, survenant avec une dyskinésie hypomotrice de la vésicule biliaire. diagnostics. La gastrite chronique dure longtemps, avec une augmentation des symptômes avec le temps. Les exacerbations sont provoquées par des troubles nutritionnels. Le tableau physique de la gastrite chronique est plutôt médiocre. Chez 80 à 90% des patients lors d'une exacerbation de la maladie, une étude objective ne détermine qu'une douleur locale dans la région épigastrique. Lorsque la gastrite chronique est associée à une duodénite, une cholécystite ou une pancréatite, une localisation de la douleur qui n'est pas typique de la gastrite, mais caractéristique de la pathologie d'un autre organe, peut être déterminée. Les tests sanguins et urinaires généraux, les paramètres biochimiques du sang chez les patients atteints de gastrite chronique ne diffèrent pas des paramètres correspondants chez les individus en bonne santé. Dans une étude coprologique, il n'y a pas de changement dans les analyses ou il peut y avoir des signes d'un trouble digestif. Lors de l'étude du contenu gastrique de la sécrétion acide par pH-métrie, on note à la fois des signes d'hypersécrétion acide et une diminution de la production d'acide. Les indicateurs de formation de pepsine dans la gastrite chronique sont plus persistants et diminuent dans le contexte d'une anacidité persistante dans les lésions organiques diffuses. Un examen radiographique est plus susceptible d'exclure d'autres maladies de l'estomac (ulcère, cancer), d'aider au diagnostic de la maladie de Ménétrier que de confirmer le diagnostic de gastrite chronique. En raison de la rareté des manifestations cliniques de la maladie, ainsi que de la non-spécificité des tests de laboratoire, le diagnostic de gastrite chronique repose sur les résultats d'études endoscopiques et morphologiques. L'endoscopie révèle des modifications de sévérité de la muqueuse gastrique plus ou moins sévères : œdème, érythème, vulnérabilité de la muqueuse, exsudat, érosions planes, érosions en relief, hyperplasie ou atrophie des plis, visibilité du schéma vasculaire, hémorragies sous-muqueuses. Ils parlent de gastrite chronique avec une augmentation du nombre de plasmocytes et de lymphocytes dans la propre membrane de la membrane muqueuse (contrairement à la gastrite aiguë, lorsque des leucocytes polymorphonucléaires apparaissent). En relation avec ce qui précède, l'identification morphologique de l'inflammation dans la gastrite peut ne pas coïncider avec l'interprétation des données du clinicien. L'activité des modifications inflammatoires de la muqueuse gastrique est évaluée morphologiquement et morphométriquement en fonction du degré d'infiltration leucocytaire de la lamina propria ou de l'épithélium. Il ne faut pas perdre de vue que la gastrite auto-immune n'est pas active. Les modifications morphologiques (faibles, modérées et sévères) - inflammation, activité, atrophie, métaplasie - et le degré de contamination HP sont quantifiés. Des manifestations cliniques caractéristiques de la gastrite sont également observées dans d'autres maladies du système digestif, par conséquent, dans le processus de diagnostic, une échographie de la cavité abdominale, un examen endoscopique et morphologique approfondi des organes digestifs sont nécessaires. Diagnostic différentiel. Le plus difficile est le diagnostic différentiel de la gastrite avec les maladies fonctionnelles de l'estomac, l'ulcère gastroduodénal de l'estomac et du duodénum, la cholécystite et la pancréatite chroniques et le cancer de l'estomac. Les maladies fonctionnelles de l'estomac, similaires à la gastrite chronique, peuvent survenir de manière latente ou s'accompagner de douleurs et de symptômes dyspeptiques. Ils se caractérisent par une courte durée, la présence de symptômes névrotiques généraux qui prévalent dans le tableau clinique de la maladie (tels que faiblesse, fatigue, irritabilité, maux de tête, humeur instable, transpiration). Avec des troubles de la fonction de l'estomac, la douleur ne dépend pas de la qualité de la nourriture, ou elle survient après l'utilisation d'un produit strictement défini. Il existe souvent un syndrome d'acidité (brûlures d'estomac, éructation aigre, goût amer dans la bouche) qui, contrairement à la gastrite avec une fonction sécrétoire accrue, n'augmente pas après avoir mangé, mais avec l'excitation, de longues pauses dans les aliments. Les vomissements dans les pathologies fonctionnelles de l'estomac se développent selon le mécanisme d'un réflexe conditionné, soulagent le patient et n'entraînent pas de détérioration significative de l'état général. Dans la gastrite chronique, elle survient généralement lors d'une exacerbation et n'apporte pas de soulagement au patient. Un symptôme fréquent de dysfonctionnement de l'estomac est une forte éructation d'air. Dans la gastrite chronique, elle est associée à une altération de la digestion des aliments ou de la motilité gastrique et peut être acide si la sécrétion est préservée, ou avec une odeur d'œufs pourris si elle est réduite. Dans l'étude de la sécrétion gastrique dans la gastrite, des valeurs normales de sécrétion sont détectées au début de la maladie, et à l'avenir, une tendance à une diminution de la sécrétion du suc gastrique. Avec les maladies fonctionnelles de l'estomac, on observe souvent des hétérochilies. L'examen radiographique de l'estomac permet de confirmer des formes de gastrite telles que rigide, angraale, hyperplasique géante, polypose et, en cas de violation de la fonction d'évacuation motrice de l'estomac (gastroptose, hypotension), indique la nature fonctionnelle de la maladie. La méthode de recherche la plus précieuse pour le diagnostic différentiel de la gastrite chronique et des maladies fonctionnelles de l'estomac est la gastroscopie, qui permet, dans des cas controversés, de déterminer les modifications de la muqueuse gastrique caractéristiques de la gastrite ou des maladies fonctionnelles de l'estomac. Le diagnostic différentiel de la gastrite chronique avec ulcère peptique est décrit dans la prochaine conférence. Le cancer gastrique a une image très similaire à la gastrite avec une fonction sécrétoire réduite. Le diagnostic précoce du cancer gastrique sur la base des signes cliniques est difficile, en particulier chez les patients souffrant de gastrite depuis longtemps. D'une grande importance pour le diagnostic du cancer sont l'apparition de douleurs persistantes persistantes, peu dépendantes de l'apport alimentaire, une faiblesse et une fatigue générales non motivées, une perversion de l'appétit, ainsi qu'une diminution progressive du poids corporel du patient. La détection d'une tumeur à la palpation fait référence aux derniers stades du processus cancéreux. Des symptômes tels qu'une modification de l'état de santé du patient, une diminution rapide de l'acidité du suc gastrique, une "carence" en acide chlorhydrique, l'apparition de cellules atypiques dans le suc gastrique, une réaction positive au sang occulte dans les selles doivent amener le médecin à suspecter un cancer gastrique. Les études radiographiques et gastroscopiques avec biopsie ciblée de la muqueuse gastrique revêtent une importance décisive dans le diagnostic différentiel. Chez les patients atteints de gastrite chronique à fonction sécrétoire réduite, l'examen aux rayons X révèle une atrophie de sa membrane muqueuse, qui est également confirmée par la gastroscopie. Avec une biopsie ciblée dans de tels cas, des changements structurels et une atrophie de la membrane muqueuse sont révélés. Pour le cancer gastrique, l'examen radiographique se caractérise par la présence d'un défaut de remplissage, l'absence de plis muqueux ou une modification de leur nature, et l'absence de péristaltisme dans certaines zones. L'endoscopie de l'estomac permet de détecter une tumeur au stade le plus précoce de son développement, lorsque la tumeur est encore dans la muqueuse gastrique, et le traitement chirurgical conduit à la guérison dans plus de 90 % des cas. Cholécystite chronique. Dans la cholécystite chronique, la douleur est localisée dans l'hypocondre droit et est de nature sourde. Avec la cholécystite calculeuse, la douleur est aiguë, colique, irradiant vers la région sous-scapulaire droite. L'apparition de la douleur est associée à la consommation d'aliments gras ou à une conduite cahoteuse. Dans la gastrite chronique, la douleur dans l'épigastre est diffuse, sourde, il n'y a pas d'irradiation, elle survient immédiatement après avoir mangé des aliments secs ou en violation du régime alimentaire. Avec la gastrite et la cholécystite, la douleur s'accompagne de symptômes dyspeptiques, mais une sensation de lourdeur dans l'épigastre, une plénitude, des éructations de nourriture ou d'air, un goût métallique dans la bouche sont plus caractéristiques de la gastrite. Les vomissements dans la gastrite chronique sont rares. Objectivement, dans la cholécystite chronique, surtout calculeuse, on retrouve une tension de la paroi abdominale antérieure, une hyperesthésie de la peau de l'hypochondre droit, ce qui n'est pas caractéristique de la gastrite chronique. À la palpation de l'abdomen en cas de cholécystite chronique, on note une douleur dans la localisation de la vésicule biliaire. La gastrite chronique se caractérise par une douleur diffuse. Chez les patients atteints de cholécystite chronique, l'examen de la bile révèle une augmentation de la quantité de mucus et de leucocytes. La gastrite chronique se caractérise par une image normale de la bile dans le contexte de modifications de la sécrétion et de l'acidité du suc gastrique, ainsi que d'autres fonctions de l'estomac (absorption, moteur). Un examen radiologique de la vésicule biliaire chez les patients atteints de cholécystite chronique révèle une modification de sa fonction d'évacuation, ainsi que des calculs. Pancréatite chronique. Dans la pancréatite chronique, la douleur est localisée dans la moitié gauche de l'abdomen, irradiant vers la région sous-scapulaire gauche, vers le bas du dos et vers la région environnante. La survenue de douleurs est associée à la consommation d’aliments abondants, souvent gras, et d’alcool. Si la gastrite chronique se caractérise par une évolution longue et monotone de la maladie, alors dans la pancréatite chronique, elle se fait par étapes. Un examen objectif en cas de pancréatite chronique révèle une hyperesthésie de la peau dans l'hypochondre gauche, la douleur correspond topographiquement à la localisation du pancréas. Dans une étude en laboratoire sur le suc pancréatique dans la pancréatite chronique, on constate un changement persistant de l'alcalinité et des enzymes: le niveau de diastase dans le sang et l'urine peut changer, ce qui n'est pas le cas avec la gastrite chronique. Radiologiquement, la pancréatite chronique se caractérise par une inversion accrue de l'anneau duodénal, une forte augmentation de sa papille majeure (symptôme de Frostberg), et parfois la présence de zones de calcification du pancréas. Le diagnostic intranosologique de diverses formes de gastrite chronique doit également être effectué. Ainsi, la maladie associée à HP évolue cliniquement avec des symptômes d'ulcères duodénaux et, dans certains cas, elle peut évoluer de manière latente. L'examen endoscopique et morphologique révèle une antropylorhoduodénite. Les érosions de la gastrite à Helicobacter pylori sont généralement localisées dans la zone d'inflammation sévère (zone anthropoylorique de l'estomac). La gastrite chronique auto-immune se caractérise cliniquement par une sensation de lourdeur dans la région épigastrique, un arrière-goût désagréable dans la bouche, des éructations pourries et des nausées. En raison d'une production insuffisante d'acide chlorhydrique, une diarrhée apparaît. Dans 10% des cas, sur fond de gastrite auto-immune, on retrouve des symptômes B12- anémie par carence : faiblesse, pâleur de la peau et des muqueuses, ongles cassants, dans les analyses de sang - anémie mégaloblastique hyperchrome. Les formes particulières de la maladie comprennent la gastrite granulomateuse, éosinophile, hypertrophique (maladie de Ménetrier), lymphocytaire. La gastrite granulomateuse agit comme une forme indépendante de la maladie ou plus souvent - l'un des composants d'une pathologie plus grave (maladie de Crohn, tuberculose, sarcoïdose). Le diagnostic est toujours confirmé par les résultats de l'examen histologique des échantillons de biopsie de la muqueuse gastrique. La gastrite éosinophile est extrêmement rare et est causée par une vascularite systémique. Une histoire de réactions allergiques est obligatoire. L'examen histologique révèle une infiltration éosinophile de la muqueuse gastrique. La gastrite hypertrophique (maladie de Ménetrier) se manifeste cliniquement par des douleurs dans la région épigastrique et des nausées. Certains patients peuvent perdre du poids à cause de la diarrhée. Dans les études endoscopiques, radiologiques et morphologiques, on retrouve des plis muqueux géants hypertrophiés, ressemblant aux circonvolutions du cerveau. La gastrite lymphocytaire est cliniquement asymptomatique; morphologiquement, cette forme se caractérise par une infiltration prononcée de la muqueuse gastrique par les lymphocytes. traitement. Les patients atteints de gastrite ont besoin de mesures médicales générales : alimentation régulière et équilibrée, normalisation des horaires de travail et de repos, nivellement des situations stressantes de la vie quotidienne et du travail. Le traitement médicamenteux n'est indiqué qu'en présence de manifestations cliniques de gastrite chronique. Les patients souffrant de gastrite associée à HP sont traités avec un programme d'ulcère gastro-duodénal (voir le cours suivant). Les personnes atteintes de gastrite auto-immune ont besoin d'une supplémentation en vitamine B12 (500 mcg une fois par jour en sous-cutané pendant 1 jours, suivi d'une répétition des cures), acide folique (30 mg par jour), acide ascorbique (jusqu'à 5 g par jour). Si nécessaire, une thérapie de remplacement avec des préparations enzymatiques (mezim-forte, festal, enzistal, créon, pancitrate, acidine-pepsine) est effectuée. Le syndrome douloureux est généralement arrêté par la prise d'antiacides (maalox, almagel, gastal) ou de bloqueurs des récepteurs de l'histamine H (ranitidine, famotidine) à des doses thérapeutiques moyennes. Avec des formes spéciales de gastrite, le traitement de la maladie sous-jacente est nécessaire. Pronostic et prévention. Le pronostic pour la vie et le travail est favorable. Les patients souffrant de gastrite chronique doivent être enregistrés auprès d'un gastro-entérologue. Ils sont examinés cliniquement et endoscopiquement avec une biopsie au moins une fois par an pour exclure une transformation tumorale. Les plus dangereuses en termes de dégénérescence cancéreuse sont la gastrite atrophique hypertrophique et diffuse avec dysplasie épithéliale. Dans les formes érosives de la maladie compliquées par des saignements, ainsi que dans la forme décompensée de la maladie de Ménétrier, le pronostic est déterminé par la rapidité et l'adéquation du traitement chirurgical. La prévention de la gastrite est réduite à une nutrition rationnelle, au respect du régime de travail et de repos, à la limitation de la prise d'AINS. CONFÉRENCE N° 11. Maladies du tube digestif. Maladies de l'estomac. ulcère peptique L'ulcère peptique (ulcère peptique) est une maladie chronique et récurrente, qui se manifeste cliniquement par une pathologie fonctionnelle de la zone gastro-duodénale et morphologiquement - par une violation de l'intégrité de ses couches muqueuses et sous-muqueuses, et donc l'ulcère guérit toujours avec la formation de une cicatrice. Étiologie. Le principal facteur étiologique de l’ulcère gastroduodénal est l’expansion microbienne des HP à la surface de l’épithélium gastrique. L'importance de l'agression bactérienne dans l'étiologie de la maladie est étudiée depuis 1983, lorsque J. Warren et B. Marshall ont rapporté la découverte d'un grand nombre de bactéries S-spirales à la surface de l'épithélium de l'antre de l'estomac. Les hélicobactéries peuvent exister dans un environnement acide en raison de la production de l'enzyme uréase, qui convertit l'urée (de la circulation sanguine) en ammoniac et en dioxyde de carbone. Les produits de l'hydrolyse enzymatique neutralisent l'acide chlorhydrique et créent des conditions pour modifier le pH de l'environnement autour de chaque cellule bactérienne, offrant ainsi des conditions favorables à l'activité vitale des micro-organismes. La colonisation HP totale se produit à la surface des cellules épithéliales gastriques, qui s'accompagne d'une atteinte de l'épithélium sous l'action des phospholipases. Ces derniers assurent la formation de lécithines et de protéinases toxiques à partir de la bile, provoquant la destruction des complexes protéiques protecteurs et du mucus. Dans le contexte de "l'alcalinisation" des membranes cellulaires épithéliales avec de l'ammoniac, le potentiel membranaire des cellules change, la diffusion inverse des ions hydrogène augmente, la mort et la desquamation de l'épithélium de la muqueuse gastrique. Tous ces changements conduisent à la pénétration de HP dans la profondeur de la muqueuse gastrique. Non moins importants dans le développement des ulcères peptiques sont les effets neuropsychiques, la prédisposition héréditaire, les agents infectieux, les erreurs alimentaires et la prise de certains médicaments, et les mauvaises habitudes. Pour la première fois, le concept neurogène de l'apparition de la maladie a été formulé par Bergman, qui a fait valoir que les troubles héréditaires-constitutionnels du système nerveux autonome entraînent des spasmes des muscles et des vaisseaux sanguins de la paroi de l'estomac, une ischémie et une diminution dans la résistance de la membrane muqueuse aux effets agressifs du suc gastrique. Cette théorie a été développée par K. N. Bykov et I. T. Kurtsin (1952). Ils ont étayé la théorie corticoviscérale de l'ulcérogénèse, qui est basée sur des données sur les modifications de l'activité nerveuse supérieure résultant d'un traumatisme neuropsychique chronique. Complétée et détaillée par la doctrine des liens biochimiques et hormonaux dans la régulation de la sécrétion gastrique, de la motilité et du trophisme, cette théorie de l'ulcérogénèse a de nouveau gagné de nombreux partisans ces dernières années. Les facteurs héréditaires sont populaires parmi les chercheurs: l'inertie des principaux processus nerveux, les propriétés spécifiques au groupe du sang, les caractéristiques immunologiques et biochimiques, le syndrome de charge héréditaire. Dans l'apparition de l'ulcère gastro-duodénal, une importance essentielle a été attachée aux violations alimentaires. Cependant, les études cliniques et expérimentales menées au cours des deux dernières décennies n'ont dans la plupart des cas pas révélé l'effet néfaste des produits alimentaires sur la muqueuse gastroduodénale. La prévalence de l'ulcère gastro-duodénal parmi des contingents importants de personnes ayant des habitudes alimentaires différentes témoigne également de l'importance primordiale des facteurs nutritionnels. Les perturbations du rythme et de la régularité de l'alimentation, les longues pauses entre les repas, les repas intempestifs sont indispensables à la survenue d'ulcères peptiques. Les chercheurs ont exprimé des points de vue relativement contradictoires sur le rôle de l'alcool dans l'ulcérogénèse. On sait que l'alcool provoque des modifications atrophiques de la muqueuse gastrique. Ces observations sont en contradiction avec le concept général de la formation d'ulcères. Cependant, la consommation fréquente d'alcool s'accompagne de violations du régime alimentaire, de changements qualitatifs dans la composition des aliments, qui peuvent finalement provoquer un ulcère peptique de l'estomac et du duodénum. Le rôle des effets médicinaux dans l'ulcérogénèse est activement étudié. Les résultats d'études publiées dans la littérature et nos propres données indiquent que les anti-inflammatoires non stéroïdiens et les hormones glucocorticoïdes ont les propriétés ulcérogènes les plus prononcées. pathogénèse. La pathogenèse de l’ulcère gastroduodénal n’est pas encore entièrement comprise. Lorsqu'on considère les processus d'ulcérogénèse, il est nécessaire de souligner un certain nombre de postulats : 1) caractérisé par la saisonnalité des exacerbations de l'ulcère peptique ; 2) il existe une localisation prédominante des ulcères peptiques dans la zone antropyloroduodénale ; 3) la présence d'acide chlorhydrique et de pepsine dans le suc gastrique a été notée ; 4) une fréquence élevée (jusqu'à 70%) de guérison spontanée des ulcères gastriques et duodénaux est perceptible; 5) il existe une gastrite antrale chronique associée à HP ; 6) la partie anthropylorique de l'estomac et la partie initiale du duodénum sont "l'hypothalamus" du tractus gastro-intestinal ; 7) il existe une prédisposition héréditaire à la survenue d'ulcères peptiques ; 8) la survenue d'un ulcère, sa récidive et sa rémission sont possibles en présence de tous les facteurs ci-dessus. Ainsi, le concept unifié d'ulcérogénèse est le suivant. Chez un patient présentant une prédisposition héréditaire à l'ulcère gastro-duodénal en présence d'une gastrite bactérienne chronique pendant la période de dishormonose automnale ou printanière, on ne note que l'hyperplasie et l'hyperfonctionnement des cellules endocrines sécrétant de la gastrine, de l'histamine, de la mélatonine et de la sérotonine. Les principales hormones et amines biogènes produites par la zone anthropolyloruduodénale interviennent à la fois dans la stimulation de la sécrétion gastrique et dans la modification du trophisme et de la prolifération cellulaire, principalement dans cette zone. Dans le contexte de la gastrite bactérienne active et de la duodénite, des conditions favorables se présentent pour la formation d'ulcères. Avec la formation d'un défaut peptique, l'activité fonctionnelle des cellules endocrines diminue. Cela conduit à une diminution de l'agression acido-peptique, à une amélioration du trophisme tissulaire dans la zone anthropoyloroduodénale et à la création de conditions pour la guérison des ulcères gastriques et duodénaux, même dans le contexte de l'expansion microbienne en cours de HP. Dans la période aiguë de l'ulcère peptique, on note une hyperplasie des cellules productrices d'α-endorphine, qui sont des cytoprotecteurs universels. Ils agissent comme les principaux mécanismes de protection dans les ulcères gastro-duodénaux et assurent le processus d'auto-limitation de l'ulcère et de sa guérison, à la fois directement et en stimulant le système immunitaire. Dans le même temps, les anticorps contre HP, synthétisés dans la sous-muqueuse de l'estomac et du duodénum, se lient efficacement aux cellules bactériennes et neutralisent les toxines HP et contribuent à leur mort. Tout ce qui précède contribue à la création d'un équilibre entre les facteurs dits d'agression et les facteurs de protection et la guérison d'un défaut peptique dans la zone gastroduodénale. Classification. Classification (Panfilov Yu. A., Osadchuk M. A., 1991) Localisation de l'anomalie peptique : 1) ulcère gastrique (sections sous-cardiale et cardiaque, partie pylorique et canal pylorique, petite et grande courbure); 2) ulcère duodénal (section bulbaire et post-bulbaire); 3) ulcères de l'estomac et du duodénum. Le cours de l'ulcère peptique. 1. Facile. L'exacerbation de l'ulcère ne dépasse pas 1 fois en 1 à 3 ans, la cicatrisation de l'anomalie peptique se termine à la 5-6ème semaine à compter du début du traitement, la sévérité de la douleur et des syndromes dyspeptiques est modérée. 2. Modéré. Récidive au moins 2 fois par an, épithélialisation de l'ulcère - dans les 7 à 12 semaines, sévérité de la douleur et des syndromes dyspeptiques. 3. Lourd. Les périodes de rémission ne dépassent pas 3-4 mois. En plus des douleurs intenses, il y a des complications. Phases de la maladie : 1) exacerbation de la récidive de l'ulcère ou des troubles fonctionnels du système gastroduodénal ; 2) rémission complète (dans les aspects cliniques, radiologiques, endoscopiques et fonctionnels) ; 3) incomplet (avec préservation de troubles fonctionnels ou structurels dans la zone gastroduodénale). L'état de la membrane muqueuse de l'estomac et du duodénum: 1) gastrite chronique ; 2) duodénite chronique. Etat fonctionnel du système gastroduodénal Sécrétion : normale, augmentée, réduite. Motilité : normale, accélérée, lente ; évacuation : normale, accélérée, retardée, duodénostasie. Complications : saignement, perforation, pénétration, périgastrite, périduodénite, déformation cicatricielle de l'estomac et du duodénum. Image clinique. Le tableau clinique de l’ulcère gastroduodénal est polymorphe. Les symptômes dépendent du sexe et de l'âge du patient, de la période de l'année, de la localisation et de la taille de l'ulcère, des caractéristiques personnelles et sociales du patient et de ses qualités professionnelles. La clinique est déterminée par une combinaison de symptômes : évolution chronique de la maladie dès son apparition, présence de signes d'exacerbation et de rémission de la maladie, guérison du défaut de la muqueuse gastrique et duodénale avec formation d'un cicatrice. L'ulcère peptique est représenté par deux variantes cliniques et morphologiques : l'ulcère gastrique et l'ulcère duodénal. Traditionnellement, on distingue les syndromes douloureux et dyspeptiques. Le principal signe clinique est une douleur dans le haut de l'abdomen. De par la nature du syndrome douloureux, il est presque impossible de faire la distinction entre la gastrite bactérienne chronique et l'ulcère peptique. La douleur dans la région épigastrique, à jeun, principalement au printemps et à l'automne, est également fréquente dans l'ulcère peptique et la gastrite bactérienne chronique. Le soulagement du syndrome douloureux avec des aliments et des antiacides médicinaux est obtenu à la fois dans la gastrite bactérienne chronique et dans l'ulcère peptique. L'ulcère duodénal se distingue uniquement par la présence de douleurs dans la région épigastrique la nuit. Les vomissements avec ulcère peptique sont rares. Les nausées sont beaucoup plus fréquentes avec les ulcères de l'estomac et les ulcères duodénaux. La constipation accompagne l'ulcère duodénal chronique. Les symptômes de l'ulcère peptique sont déterminés par le nombre d'anomalies ulcéreuses et leur localisation. Les ulcères d'estomac multiples sont 3 fois plus fréquents chez les hommes. Le tableau clinique dans ce cas dépend de la localisation des anomalies peptiques. Avec des ulcères dans le corps de l'estomac, une douleur sourde dans l'épigastre sans irradiation, qui survient 20 à 30 minutes après avoir mangé, et des nausées sont notées. Avec les ulcères de la région sous-cardiale, des douleurs sourdes sous le processus xiphoïde, irradiant vers la moitié gauche de la poitrine, sont caractéristiques. Les ulcères gastriques et les ulcères duodénaux combinés sont une combinaison d'un ulcère gastrique actif et d'un ulcère duodénal cicatrisé. Ils se caractérisent par une préservation à long terme du syndrome douloureux, une évolution persistante de la maladie, des rechutes fréquentes de la maladie, une cicatrisation lente de l'ulcère et des complications fréquentes. Les ulcères extrabulbeux comprennent les ulcères situés dans la région du sphincter bulboduodénal et en aval de celui-ci. Leur tableau clinique a ses propres caractéristiques et a beaucoup en commun avec les ulcères duodénaux. Ils surviennent principalement chez les patients âgés de 40 à 60 ans. Les ulcères postbulbaires sont graves et sujets à des exacerbations fréquentes, accompagnées de saignements massifs. Une douleur localisée dans l'hypochondre droit de l'abdomen, irradiant vers le dos ou sous l'omoplate droite, survient dans 100 % des cas. L'intensité, la sévérité de la douleur, qui ne s'atténue qu'après la prise d'analgésiques narcotiques, amène les patients à une neurasthénie sévère. La saisonnalité des exacerbations dans les ulcères extra-bulbeux est enregistrée chez près de 90% des patients. Chez de nombreux patients, les saignements gastro-intestinaux deviennent un symptôme cardinal. Les ulcères du canal pylorique sont caractérisés par un ensemble de symptômes appelé syndrome pylorique : douleurs épigastriques, nausées, vomissements et amaigrissement important. L'exacerbation de la maladie est très longue. Dans le contexte d'une thérapie antiulcéreuse intensive, l'ulcère cicatrise en 3 mois. Un apport sanguin abondant au canal pylorique provoque des saignements gastriques massifs. diagnostics. Au cours de l'évolution sans complication d'un ulcère gastroduodénal, il n'y a aucun changement dans le test sanguin général, une légère diminution de la VS et une légère érythrocytose sont possibles. Lorsque des complications surviennent lors des analyses de sang, une anémie apparaît, une leucocytose - lorsque le péritoine est impliqué dans le processus pathologique. Il n'y a pas de changement dans l'analyse générale de l'urine. Dans l'analyse biochimique du sang en cas d'évolution compliquée de l'ulcère peptique, des modifications des paramètres du test sialique, de la protéine C-réactive, de la réaction DPA sont possibles. La méthode traditionnelle de recherche dans la pathologie de l'estomac est la détermination de l'acidité du contenu gastrique. Divers indicateurs sont possibles: élevés et normaux, dans certains cas même réduits. Un ulcère duodénal survient avec une acidité élevée du suc gastrique. Lors d'un examen aux rayons X, un ulcère peptique est une "niche" - un dépôt de suspension de baryum. Outre un tel symptôme radiologique direct, les signes indirects d'une anomalie peptique sont importants pour le diagnostic : hypersécrétion du contenu de l'estomac à jeun, troubles de l'évacuation, reflux duodénal, dysfonctionnement du cardia, spasmes locaux, convergence des mucosités plis, déformation cicatricielle de l'estomac et du duodénum. La gastroduodénoscopie avec biopsie est la méthode la plus fiable pour diagnostiquer l'ulcère peptique. Il permet d'évaluer la nature des modifications de la muqueuse au bord de l'ulcère, dans la zone périulcéreuse et garantit la précision du diagnostic au niveau morphologique. Dans des études endoscopiques et morphologiques, il a été constaté que la majorité des ulcères gastriques sont situés dans la région de la petite courbure et de l'antre, beaucoup moins souvent - sur la grande courbure et dans la zone du canal pylorique. 90% des ulcères duodénaux sont localisés dans la région bulbaire. Un ulcère peptique est généralement de forme ronde ou ovale. Son fond est constitué de masses nécrotiques, sous lesquelles se trouve un tissu de granulation. La présence de taches sombres sur le fond indique un saignement. La phase de cicatrisation de l'ulcère se caractérise par une diminution de l'hyperhémie de la muqueuse et un puits inflammatoire dans la zone périulcéreuse. Le défaut devient moins profond, progressivement débarrassé de la plaque fibrineuse. La cicatrice ressemble à une zone hyperémique de la muqueuse avec des rétractions linéaires ou étoilées de la paroi. À l'avenir, lors d'un examen endoscopique sur le site de l'ancien ulcère, diverses violations du relief de la membrane muqueuse sont déterminées: déformations, cicatrices, rétrécissement. À l'endoscopie, une cicatrice mature due au remplacement d'un défaut par du tissu de granulation a un aspect blanchâtre, il n'y a aucun signe d'inflammation active. Une étude morphologique d'un spécimen de biopsie obtenu à partir du fond et des bords de l'ulcère révèle des détritus cellulaires sous la forme d'une accumulation de mucus avec un mélange de leucocytes en décomposition, d'érythrocytes et de cellules épithéliales desquamées avec des fibres de collagène situées en dessous. Diagnostic différentiel. Avec l'utilisation généralisée de l'endoscopie, le diagnostic différentiel des ulcérations de l'estomac et du duodénum (ulcères symptomatiques, ulcérations spécifiques de la tuberculose, syphilis, maladie de Crohn, cancer ulcéreux primaire, ulcères malins secondaires) devient particulièrement important. Pour les ulcères symptomatiques, il doit y avoir une cause qui les a provoqués (exposition extrême, signes cliniques et morphologiques de maladies endocriniennes, troubles cardiovasculaires et respiratoires, maladies rhumatismales). Plus que pour l'ulcère peptique, ils se caractérisent par une multiplicité des lésions, une localisation prédominante dans l'estomac et une taille importante. Avec l'ulcère peptique, le syndrome douloureux prévaut et avec la gastrite chronique - phénomènes dyspeptiques. Dans la gastrite chronique, la douleur est légère ou absente, il n'y a pas de saisonnalité de la maladie et une douleur limitée à la palpation ; l'aggravation de la maladie dépend souvent de la nature de l'aliment. L'état de la fonction sécrétoire de l'estomac avec gastrite peut être différent. La gastroscopie et la gastrobiopsie sont d'une importance décisive, dans lesquelles des modifications muqueuses caractéristiques de la gastrite et un ulcère dans l'ulcère peptique sont détectés. La hernie hiatale (HH) est également souvent accompagnée de douleurs à l'épigastre. Cependant, contrairement à l'ulcère peptique, cette maladie se caractérise principalement par l'âge avancé des patients, la relation de la douleur avec la position du corps (la douleur augmente en décubitus dorsal, s'affaiblit en position debout). Le diagnostic de HH est confirmé par les résultats de l'examen radiologique. La cholécystite chronique se caractérise par des douleurs dans l'hypochondre et l'épigastre droits, irradiant souvent vers l'omoplate droite, vers l'épaule, vers l'angle de la mâchoire inférieure à droite. Avec la cholécystite acalculeuse, ils ont un caractère terne, monotone et pressant, et avec la cholécystite calculeuse, ils acquièrent le caractère de colique. Nausées, constipation, flatulences sont notées. Un état subfébrile persistant est possible. Avec une obstruction prolongée des voies biliaires, la jaunisse peut se joindre. Le diagnostic de lésion du système biliaire est vérifié par les données de l'échographie abdominale, de l'examen radiographique (cholécystographie), de la cholépancréatographie rétrograde endoscopique (CPRE), ainsi que par les résultats du sondage duodénal, qui n'est indiqué que pour un processus sans pierre. Dans la pancréatite aiguë et l'exacerbation de la douleur chronique, la douleur est localisée dans la moitié gauche de la région épigastrique, a un caractère de zona et est provoquée par la prise de tout aliment. Dans l'anamnèse - pathologie du système biliaire, abus d'alcool, utilisation à long terme de médicaments pancréatiques. Révéler objectivement la perte de poids, polyfecal, steatorrhea, creatorrhea. Le diagnostic est confirmé par les résultats d'un test sanguin biochimique pour les enzymes pancréatiques, les matières fécales - pour la digestibilité, ainsi que des données instrumentales. traitement. Le traitement rationnel des ulcères gastroduodénaux devrait inclure un régime, une nutrition appropriée, un traitement médicamenteux, une psychothérapie, des méthodes de traitement physique et thermal. Pendant la période d'exacerbation de l'ulcère gastroduodénal, il est nécessaire de respecter strictement un régime fractionné (de 4 à 6 fois par jour avec un petit volume de chaque portion de nourriture prise à certaines heures). Les produits alimentaires doivent avoir de bonnes propriétés tampons et contenir une quantité suffisante de protéines (120-140 g). La psychothérapie est essentielle pour arrêter ou réduire les réactions psychonévrotiques résultant du syndrome de douleur persistante et de son attente. Les médicaments utilisés pour traiter les ulcères peptiques sont divisés en 5 groupes : 1) les médicaments qui affectent le facteur acido-peptique (antiacides et H2antihistaminiques, autres agents antisécrétoires); 2) médicaments qui améliorent la barrière muqueuse gastrique; 3) médicaments qui augmentent la synthèse des prostaglandines endogènes; 4) agents antibactériens et antiseptiques; 5) médicaments qui normalisent les troubles d'évacuation motrice de l'estomac et du duodénum. Antiacides : 1) soluble (absorbable) - bicarbonate de soude, carbonate de calcium (craie) et oxyde de magnésium (magnésie brûlée); 2) insolubles (non résorbables) : trisilicate de magnésium et hydroxyde d'aluminium. Les antiacides solubles ont un effet alcalinisant rapide, énergique mais à court terme, mais provoquent souvent des effets secondaires, c'est pourquoi ils ne sont pas utilisés dans le traitement des ulcères gastroduodénaux. Les antiacides insolubles à base d'hydroxyde d'aluminium et d'hydroxyde de magnésium (Almagel, Phosphalugel, Gelusillac, Topaal, Maalox, etc.) assurent une neutralisation à long terme de l'acide chlorhydrique, enveloppent la muqueuse, la protégeant des effets néfastes de l'acide et des aliments. En plus de neutraliser l'acide chlorhydrique, ils aident à réduire l'activité protéolytique du suc gastrique, à lier la lysolécithine et les acides biliaires et ont un effet cytoprotecteur universel. Les antiacides doivent être pris 1 à 2 heures après les repas et le soir. Maalox est prescrit en suspension (15 ml 4 fois par jour) ou en comprimés (1-2 comprimés 4 fois par jour), phosphalugel - sous forme de gel (16 g 3-4 fois par jour). L'un des principaux effets secondaires des antiacides non résorbables est la perturbation des selles. Les préparations d'hydroxyde d'aluminium provoquent la constipation et les préparations d'hydroxyde de magnésium (Maalox) ont un effet laxatif dose-dépendant. Une nouvelle ère dans le traitement de l'ulcère peptique a commencé avec l'avènement de H2- les bloqueurs d'histamine. Dans des conditions physiologiques, l'histamine médie les nerfs extragastriques et les stimuli humoraux qui provoquent la production d'acide. La stimulation de la production d'acide chlorhydrique par l'histamine est due à une augmentation de l'activité de l'AMPc, qui agit sur l'enzyme adénylcyclase contenue dans la région productrice d'acide de l'estomac, ce qui améliore la sécrétion d'ions hydrogène. Les données obtenues ont servi de base à la synthèse de médicaments qui interrompent la participation de l'histamine au processus de sécrétion au niveau cellulaire, tels que la cimétidine, la ranitidine, la famotidine, la nizatidine, etc. De plus, les antagonistes H2Les récepteurs de l'histamine préviennent les troubles de la microcirculation dans la muqueuse gastrique et préviennent ainsi le développement des ulcères. De plus, ils réduisent la production de pepsine, augmentent la sécrétion de bicarbonates, normalisent la motilité gastroduodénale, augmentent le nombre de cellules épithéliales synthétisant l'ADN, stimulent les processus de réparation et accélèrent la guérison des ulcères chroniques de l'estomac et du duodénum. Cependant, les médicaments de 1ère génération (cimétidine, cinamet, belomet, tagamet) peuvent provoquer des modifications du système nerveux, des hépatites toxiques, des troubles du rythme et de la conduction du système cardiovasculaire et des modifications des organes hématopoïétiques. Bloqueurs H2les générations suivantes de récepteurs de l'histamine - la ranitidine (zantak, ranisan, gistak), la famotidine (kvamatel, lecedil, gastrosidin), la nizatidine (roxatidine) diffèrent de la cimétidine par une bonne tolérance. La ranitidine est prescrite à une dose de 150 mg 2 fois par jour, la famotidine - 20 mg 2 fois par jour pendant 4 à 6 semaines. Pour prévenir le syndrome de sevrage après la cicatrisation de l'ulcère, il est recommandé de continuer à prendre de la ranitidine (150 mg) ou de la famotidine (20 mg) le soir pendant 2 à 3 mois. Ces dernières années, un nouveau médicament antisécrétoire, l'oméprazole (omenrol, omez, losek), qui appartient aux dérivés du benzimidazole, est apparu. Il bloque l'enzyme H + -K + -ATPase de la pompe à protons de la cellule pariétale. La courte demi-vie (environ 1 heure) et la longue durée d'action (18-24 heures) permettent de prendre ce médicament en une seule fois. L'oméprazole est prescrit 20 mg le soir 1 fois par jour pendant 2-3 semaines. L'oméprazole se classe au premier rang en termes de sévérité de l'effet antisécrétoire parmi les médicaments antiulcéreux modernes.Les effets secondaires du médicament ne sont pas très prononcés. L'utilisation généralisée dans le traitement des ulcères gastro-duodénaux a trouvé la gastrocépine (nirenzépine, gastrozépine), qui appartient aux médicaments anticholinergiques. Le médicament bloque sélectivement les récepteurs muscariniques de l'acétylcholine situés dans les cellules de la muqueuse gastrique qui produisent de l'acide chlorhydrique et de la pepsine. La gastrocépine a un effet inhibiteur sur la sécrétion gastrique basale et stimulée, inhibe la production de pepsine, ralentit l'évacuation de l'estomac, provoque une inhibition de la production de gastrine, réduit le niveau de polypeptide pancréatique, a un effet cytoprotecteur en augmentant la production de glycoprotéines du mucus gastrique , ainsi qu'en améliorant l'apport sanguin à la membrane muqueuse de la région gastroduodénale . Attribuez-lui 50 mg 2 fois par jour 30 minutes avant les repas. La durée du traitement est en moyenne de 4 semaines. Les médicaments qui renforcent la barrière muqueuse de l'estomac comprennent des préparations de bismuth colloïdal (dénol), qui forment un film protecteur sur la membrane muqueuse, réduisent l'activité peptique de l'estomac, formant un composé insoluble avec la pepsine, améliorent la formation de mucus, ont un effet cytoprotecteur. effet, augmentant la teneur en prostaglandines dans la paroi de l'estomac. Le Denol a la capacité d'inhiber l'activité des HP dans la muqueuse gastrique. Le médicament est prescrit 2 comprimés (240 mg) 2 fois par jour une demi-heure avant les repas ou 2 heures après les repas. Pour éviter l'accumulation de sels de bismuth dans l'organisme, il n'est pas recommandé de suivre un traitement avec ces médicaments pendant plus de 8 semaines. Aux fins du traitement antibactérien des ulcères gastriques et duodénaux, la tétracycline, l'amoxicilline et la clarithromycine sont utilisées. Ils sont utilisés en association avec d’autres médicaments antiulcéreux. Plusieurs schémas de traitement combiné (deux, trois, quatre composants) ont été proposés. Thérapie à deux composants : amoxicilline 1000 mg 2 fois par jour pendant 2 semaines ; oméprazole 40 mg deux fois par jour. Le schéma à trois composants comprend la préparation de bismuth colloïdal 2 mg 120 fois par jour; tétracycline 4 mg 250 fois par jour; métronidazole 4 mg 250 fois par jour. Le cycle thérapeutique est de 4 jours. Le schéma à quatre composants implique l'oméprazole 20 mg 2 fois par jour du 1er au 10ème jour ; de-nol 120 mg 4 fois par jour du 4ème au 10ème jour ; tétracycline 500 mg 4 fois par jour du 4ème au 10ème jour ; métronidazole 500 mg 3 fois par jour du 4ème au 10ème jour. Le schéma à quatre composants pour le traitement de l'ulcère peptique de l'estomac et du duodénum est reconnu comme le plus efficace. 6 semaines après, la guérison du défaut peptique est observée chez 93 à 96% des patients. Après cicatrisation d'un ulcère peptique de l'estomac et du duodénum, deux types de traitement sont traditionnellement utilisés. 1) Un traitement d'entretien continu est effectué avec des médicaments antisécrétoires à la moitié de la dose quotidienne pendant une période pouvant aller jusqu'à un an. 2) La thérapie "à la demande", implique l'utilisation de l'un des agents antisécrétoires à la moitié de la dose quotidienne pendant deux semaines lorsque des symptômes d'ulcère peptique apparaissent. Pronostic et prévention. Les formes simples de la maladie ont un pronostic favorable pour la vie et le travail. En cas de complications de l'ulcère gastroduodénal, le pronostic est déterminé par la rapidité des soins chirurgicaux. La prévention de la récidive de l'ulcère peptique comprend une surveillance dynamique avec des examens de suivi obligatoires par un médecin 2 fois par an. Les examens doivent comprendre un examen clinique et endoscopique et, si nécessaire, un examen morphologique. À titre préventif, il est recommandé de normaliser le sommeil et le repos, d'abandonner les mauvaises habitudes, de limiter la prise de médicaments ulcérogènes, de raisonner cinq repas par jour et d'utiliser une thérapie à deux ou trois composants pendant une semaine tous les 3 mois. CONFÉRENCE N° 12. Maladies du tube digestif. Maladies des intestins. Maladies de l'intestin grêle. Entérite chronique L'entérite chronique est une maladie de l'intestin grêle, caractérisée par une violation de ses fonctions (digestion et absorption) dans le contexte de changements dystrophiques et dysrégénératifs, aboutissant au développement d'une inflammation, d'une atrophie et d'une sclérose de la membrane muqueuse de l'intestin grêle. Étiologie et pathogenèse. Il s'agit d'une maladie polyétiologique qui peut être le résultat d'une inflammation aiguë de l'intestin grêle ou d'un processus chronique primaire. Ces dernières années, Yersinia, Helicobacteria, Proteus, Pseudomonas aeruginosa, les rotavirus, de nombreux représentants de protozoaires et d'helminthes (giardia, ascaris, ténias, opisthorchia, cryptosporidium) se sont vu accorder une grande importance en tant que facteur étiologique de l'entérite chronique. Les facteurs alimentaires sont d'une grande importance dans l'apparition de l'entérite chronique - suralimentation, consommation d'aliments secs, aliments déséquilibrés à prédominance glucidique, abus d'épices. L'entérite est causée par des rayonnements ionisants, l'exposition à des substances toxiques et des médicaments. Parmi les mécanismes pathogéniques courants des maladies chroniques de l'intestin grêle, il existe des modifications de la microflore intestinale dans le contexte d'une diminution de l'immunité locale et générale. Des modifications de l'état immunitaire - une diminution de la teneur en IgA sécrétoires, une augmentation du taux d'IgE, une diminution de la transformation blastique des lymphocytes et une inhibition de la migration des leucocytes - conduisent à la colonisation de l'intestin grêle par des représentants de la microflore opportuniste et à une diminution de la flore anaérobie normale. La colonisation bactérienne de l'intestin grêle améliore la sécrétion intestinale en raison de l'activation de l'AMPc des cellules épithéliales, qui augmente la perméabilité intestinale, améliore la production d'électrolytes et d'eau par les cellules. La sécrétion d'eau et d'électrolytes entraîne une violation du métabolisme eau-sel. Sous l'influence de la flore microbienne, la circulation entérohépatique de la bile est perturbée. Les acides gras se lient aux ions calcium, formant des savons peu solubles qui sont excrétés dans les fèces. La violation du métabolisme du calcium est favorisée par des modifications du métabolisme de la vitamine D, ce qui réduit l'absorption du calcium. Sous l'influence des troubles métaboliques des vitamines liposolubles, la teneur en microéléments dans le sang diminue. La dysbiose prolongée favorise la sensibilisation aux antigènes microbiens et alimentaires, provoque une inflammation immunitaire de la membrane muqueuse, ce qui entraîne la formation d'antigènes tissulaires. L'augmentation de la perméabilité de la barrière muqueuse s'accompagne de la résorption des macromolécules protéiques non fractionnées, qui deviennent des allergènes, et la réactivité immunologique est altérée. Avec les allergies, des substances biologiquement actives sont libérées qui augmentent la perméabilité de la paroi intestinale, modifient les propriétés fonctionnelles des entérocytes. Les violations de la microstructure de la membrane cytoplasmique des entérocytes entraînent d'abord une inhibition de l'activité de la lactase, puis de l'activité de la maltase et de la sucrase. Avec les modifications dystrophiques et dysrégénératives des épithéliocytes, la synthèse des enzymes et leur sorption sur les membranes des épithéliocytes - disaccharidases, peptidases, entérokinase, phosphatase alcaline - sont réduites, ce qui perturbe la digestion de la membrane et de la cavité. Tout cela devient la base du syndrome de malabsorption. Aux premiers stades de la maladie, des troubles du métabolisme des lipides se développent en raison d'une diminution de l'absorption des graisses, de leur perte avec les matières fécales et de modifications de la phase intestinale de la circulation biliaire entérohépatique. La violation du métabolisme de la bile, à son tour, entraîne une violation du métabolisme des lipides, qui affecte la structure et la fonction des membranes cellulaires. En relation avec une absorption insuffisante des graisses, une violation de la synthèse des stéroïdes se produit, ce qui induit une violation des fonctions des glandes endocrines. Morphologiquement, l'entérite chronique se manifeste par des modifications inflammatoires et dysrégénératives de la muqueuse de l'intestin grêle. Si le processus progresse, son atrophie et sa sclérose sont observées. Classification (Zlatkina A.R., Frolkis A.V., 1985). 1) Étiologie : infections intestinales, invasions helminthiques, facteurs alimentaires, physiques et chimiques, maladies de l'estomac, du pancréas, des voies biliaires. 2) Phases de la maladie : exacerbation ; remise. 3) Degré de gravité : léger ; modéré; lourd. 4) Courant : monotone ; récurrent; se reproduisant continuellement ; latent. 5) Caractère des changements morphologiques : unité sans atrophie ; jéunite avec atrophie villositaire partielle modérée ; jéunite avec atrophie villositaire partielle; unité avec atrophie villositaire totale. 6) La nature des troubles fonctionnels : troubles de la digestion membranaire (déficit en disaccharidase), malabsorption de l'eau, des électrolytes, des oligo-éléments, des vitamines, des protéines, des lipides, des glucides. 7) Complications : solarite, mésadénite non spécifique. Image clinique. Le tableau clinique de l'entérite chronique comprend des syndromes entériques locaux et généraux. Le premier est causé par une violation des processus de digestion pariétale (membrane) et cavitaire (maldigestion). Les patients se plaignent de flatulences, de douleurs dans la région para-ombilicale, de ballonnements en forme de bonnet, de grondements bruyants, de diarrhée et, plus rarement, de constipation. La palpation révèle des douleurs dans le mésogastre, ainsi qu'à gauche et au-dessus du nombril (signe de Porges positif), des bruits d'éclaboussures au niveau du caecum (signe d'Obraztsov). Les selles prennent un aspect argileux et la matière polyfécale est caractéristique. Le syndrome entéral général est associé à une mauvaise absorption des ingrédients alimentaires (malabsorption), entraînant des troubles de tous les types de métabolisme, des modifications de l'homéostasie. Caractérisé par des troubles métaboliques multiformes, principalement protéiques, qui se manifestent par une perte progressive de poids corporel. Les changements dans le métabolisme des glucides sont moins prononcés, ce qui se manifeste par des ballonnements, des grondements dans l'abdomen et une augmentation de la diarrhée lors de la prise de produits laitiers. Dans une large mesure, la carence en poids corporel chez les patients est due non seulement aux protéines, mais également à un déséquilibre lipidique. Les modifications du métabolisme des lipides sont étroitement liées aux troubles métaboliques des vitamines et minéraux liposolubles (calcium, magnésium, phosphore). Les signes caractéristiques de la carence en calcium sont un symptôme positif du rouleau musculaire, des convulsions, des fractures osseuses récurrentes "non motivées", de l'ostéoporose, de l'ostéomalacie. Il existe également un gonflement du visage, une cyanose des lèvres, une glossite, une irritabilité, un mauvais sommeil. Les violations de l'équilibre hydrique et électrolytique se manifestent par une faiblesse générale, une inactivité physique, une hypotension musculaire, des nausées, des vomissements et des modifications du système nerveux central. Les symptômes de la polyhypovitaminose deviennent typiques de l'entérite chronique de gravité modérée à sévère. L'hypovitaminose C se manifeste cliniquement par des saignements des gencives, des saignements nasaux, utérins répétés, des ecchymoses sur la peau. L'hypovitaminose B s'accompagne d'une pâleur de la peau, d'une glossite, d'une stomatite angulaire (cheilez). Signes de carence en vitamines liposolubles (A, O, E, K) : mauvaise vision crépusculaire, peau et muqueuses sèches, augmentation des saignements des gencives. Des formes sévères d'entérite chronique surviennent avec des symptômes de dysfonctionnement endocrinien (insuffisance pluriglandulaire). L'hypocorticisme se manifeste par une hypotension artérielle, des arythmies cardiaques, une anorexie et une pigmentation cutanée. Une diminution de l'activité des gonades s'accompagne d'un dysfonctionnement ovarien, de troubles menstruels, chez l'homme - impuissance, gynécomastie, perte de cheveux. Le dysfonctionnement thyroïdien se caractérise par une faiblesse générale, une peau sèche, une bradycardie, une diminution des performances et des troubles intellectuels et mnésiques. Diagnostic et diagnostic différentiel. Un test sanguin général révèle une anémie micro- et macrocytaire, une augmentation de l'ESR et, dans les cas graves, une lympho- et une éosinopénie. Si la maladie est d'origine parasitaire, une lymphocytose et une éosinophilie peuvent être observées dans le sang. L'examen scatologique révèle une stéatorrhée de type intestinale due aux acides gras et aux savons, créarrhée, amylorrhée. La teneur en entérokinase et en phosphatase alcaline dans les matières fécales augmente. La masse quotidienne de matières fécales augmente considérablement. L'analyse bactériologique des matières fécales révèle une dysbactériose à des degrés divers. Il y a une diminution des lacto- et bifidobactéries, des entérocoques, des souches d'Escherichia coli aux propriétés enzymatiques altérées apparaissent. Dans l'analyse générale de l'urine sous forme sévère d'entérite chronique, on note une microalbuminurie et une migrohématurie. Dans un test sanguin biochimique, une hypoprotéinémie, une hypoalbuminémie, une hypoglobulinémie, une hypocalcémie, une diminution du taux de magnésium, de phosphore et d'autres microéléments, des troubles du métabolisme électrolytique sous la forme d'une diminution du taux de sodium et de potassium sont détectés. Les troubles du métabolisme lipidique s'accompagnent de modifications du spectre lipidique : le taux de cholestérol, de phospholipides diminue, et le spectre des acides biliaires, des phospholipides et des triglycérides change également. Les résultats d'une étude aux rayons X nous permettent de clarifier la fonction motrice de l'intestin grêle et le soulagement de la muqueuse, les changements dystoniques et dyskinétiques sous la forme d'un ralentissement ou d'une accélération du passage d'une suspension de sulfate de baryum à travers le petit intestin, et le relief de la muqueuse change sous la forme d'un épaississement inégal, d'une déformation et d'un lissage des plis. La gastroduodénoscopie révèle une gastrite atrophique et une duodénite. Le tableau morphologique d'une forme bénigne d'entérite chronique se caractérise par un épaississement des villosités, leur déformation, une diminution de la profondeur des encoches, une diminution du tonus des muscles lisses, un œdème sous-épithélial, des modifications dégénératives de la surface de l'épithélium , amincissement de la bordure en brosse des cellules, diminution du nombre de cellules caliciformes dans la région des villosités, augmentation du nombre de cryptes, infiltration de la propre couche muqueuse avec des éléments lymphoplasmocytaires, diminution des cellules de Paneth dans la région du fond des cryptes. Pour la forme modérée, une atrophie partielle des villosités, une diminution du nombre de cryptes, un amincissement de la muqueuse, une diminution de la bordure en brosse et une infiltration lymphoplasmocytaire des couches sous-muqueuses et musculaires sont typiques. La forme sévère de la maladie est caractérisée par une atrophie villositaire progressive, diagnostiquée par des critères histologiques, histochimiques et morphométriques. Le processus de prolifération des entérocytes prévaut sur leur différenciation, une abondance de cellules immatures et défectueuses apparaît. Le diagnostic différentiel dans l'entérite chronique est réalisé avec l'entéropathie coeliaque, la maladie de Crohn, la maladie de Whipple, l'amylose intestinale, la maladie diverticulaire, le lymphome, les tumeurs de l'intestin grêle. Les syndromes cliniques d'indigestion, d'absorption et de dysbactériose sont communs à toutes ces affections. Le diagnostic final est confirmé par l'examen morphologique de la muqueuse de l'intestin grêle. Ainsi, pour l'entéropathie cœliaque, une indication anamnestique de la relation entre les exacerbations de la maladie et l'utilisation de produits contenant de la gliadine est typique. La clinique de l'entéropathie coeliaque ressemble à l'entérite chronique. Le plus souvent, les intestins supérieurs sont touchés et il n'y a aucun changement dans l'iléon. Le site optimal pour prélever des échantillons de biopsie est la zone de la membrane muqueuse près du ligament de Treitz. L'examen morphologique révèle une diminution du nombre de cellules caliciformes et une augmentation du nombre de lymphocytes interépithéliaux, une atrophie villositaire subtotale et une infiltration cellulaire inflammatoire de sa propre couche. Avec l'entéropathie coeliaque, les changements morphologiques sur fond de régime sans gluten sont réversibles, contrairement à l'entérite chronique banale, dans laquelle les changements morphologiques sont irréversibles. Dans la maladie de Crohn, on note un polymorphisme clinique, dû à la genèse auto-immune de la maladie et à ses manifestations systémiques caractéristiques (telles que thyroïdite auto-immune, polyarthrite, iritis, hépatite, association fréquente d'entérite et de colite distale). Les tests endoscopiques et morphologiques ont une haute résolution dans la vérification de la maladie de Crohn, révélant la nature mosaïque de la lésion intestinale, des changements typiques de type "pavé pavé", qui alternent avec des zones de muqueuse intacte. Les rayons X, l'examen endoscopique peuvent détecter des rétrécissements intestinaux, parfois des fistules intestinales se forment. Le diagnostic morphologique indique une infiltration cellulaire inflammatoire de toutes les couches de la paroi intestinale avec un maximum de dommages à la couche sous-muqueuse et des modifications minimes de la muqueuse. Dans la couche sous-muqueuse, on trouve des granulomes lymphocytaires de type sarcoïde, pathognomoniques de cette maladie. La maladie de Whipple, en plus des signes d'entérite, se caractérise par des manifestations extra-intestinales sous forme de fièvre, d'arthrite, de lymphadénopathie, d'hypotension artérielle et de pigmentation de la peau. Les critères morphologiques les plus informatifs de la maladie. Les biopsies prélevées dans l'intestin grêle révèlent une accumulation de graisse intracellulaire et extracellulaire dans la muqueuse de l'intestin grêle et les ganglions lymphatiques mésentériques ; infiltration de sa propre couche par de gros microphages contenant des granules sans graisse CHIC-positifs et présence de bacilles dans la muqueuse. traitement. Le traitement de l'entérite chronique doit être complet et inclure des agents qui affectent les facteurs étiologiques, les mécanismes pathogénétiques ainsi que les symptômes locaux et généraux de la maladie. La base est la nutrition diététique, qui aide à réduire l'augmentation de la pression osmotique dans la cavité intestinale, réduit la sécrétion et normalise le passage du contenu intestinal. Exclure les produits contenant des fibres végétales grossières (légumes crus, fruits, pain de seigle, noix, pâtisseries, conserves, épices, plats épicés, lait entier, bière, kvas, boissons gazeuses et alcoolisées). L'utilisation du sel de table est limitée. Des repas fractionnés sont nécessaires, jusqu'à 5-6 fois par jour. Pendant la période de rémission, certains légumes et fruits sont introduits dans l'alimentation, jusqu'à 100-200 g par jour. Attribuez de la laitue, des tomates mûres pelées, des poires douces, des pommes douces, des oranges, des mandarines, des framboises, des fraises, des fraises des bois. Les aliments doivent être bouillis ou cuits à la vapeur. Le traitement médicamenteux doit être étiotrope, pathogénétique et symptomatique. Traitement étiotrope : pour la dysbiose de grade II-IV, des médicaments antibactériens sont prescrits : métronidazole (0,5 g 3 fois par jour), clindamycine (0,5 g 4 fois par jour), céphalexine (0,5 g 2 fois par jour), biseptol ( 0,48 g 2 fois par jour), sulgin (1 g 3 à 4 fois par jour), furazolidone (0,1 g 4 fois par jour). Après avoir utilisé des médicaments antibactériens, des eubiotiques sont prescrits - bifidumbactérine ou bificol 5 doses 3 fois par jour 30 minutes avant les repas, coli-bactérine ou lactobactérine 3 doses 3 fois par jour avant les repas, hilakforte 40 gouttes 3 fois par jour avant les repas. Le traitement avec des préparations bactériennes est réalisé sur une longue durée : 3 cures de 3 mois chaque année. Pour la dysbiose staphylococcique, un bactériophage antistaphylococcique est prescrit (20 ml 3 fois par jour pendant 15 à 20 jours), pour la dysbactériose protéique - un bactériophage coliproteus par voie orale, 20 ml 3 fois par jour, la durée du traitement est de 2 à 3 semaines. En tant qu'agent symptomatique antidiarrhéique, l'imodium (lopéramide) est prescrit 1 capsule 2 à 3 fois par jour avant les repas pendant 3 à 5 jours. Pour améliorer le processus de digestion, des enzymes sont recommandées: pancréatine, panzinorm forte, festal, digestif, pankurmen, mezim forte, trienzyme, dont les doses sont sélectionnées individuellement (de 1 comprimé 3 fois par jour à 3-4 comprimés 4 fois par jour ) et qui sont prescrits directement avant ou pendant les repas pendant 2-3 mois. Si nécessaire, l'enzymothérapie substitutive est poursuivie plus longtemps. Pour normaliser l'état général des patients atteints d'entérite et éliminer les troubles métaboliques, un traitement de substitution est indiqué. Afin de compenser la carence en vitamines, les vitamines B et B sont prescrites pendant 4 à 5 semaines.6 50 mg chacun, PP - 10-30 mg, C - 500 mg chacun. Pour la stéatorrhée, l'administration parentérale de vitamine B est indiquée.2 (100-200 mcg) en combinaison avec des vitamines liposolubles. La riboflavine 0,02 g, l'acide folique 0,003 g une fois par jour, la vitamine E 3300 UI 2 fois par jour sont prescrits à l'intérieur. En cas d'entérite chronique survenant avec une carence protéique sévère, associée à un régime alimentaire, administration parentérale de plasma, 150-200 ml d'hydrolysats de protéines et de mélanges d'acides aminés (aminopeptide, alvésine, polyamine, intrafusine, 250-500 ml par voie intraveineuse pendant 20 jours) dans combinaison avec des hormones anabolisantes (retabolil 2,0 ml 1 fois en 7-10 jours pendant 3-4 semaines) et des mélanges gras tels que intralipid. La nomination de stéroïdes n'est indiquée qu'en cas de carence protéique importante, d'hypoprotéinémie, de présence d'insuffisance surrénalienne. Pour corriger les troubles hydriques et électrolytiques, injections intraveineuses de panangine 20-30 ml, gluconate de calcium 10% 10-20 ml dans 200-400 ml d'une solution isotonique ou d'une solution de glucose, solutions polyioniques "Disol", "Trisol", "Quartasol" sont indiqués. Les solutions d'électrolytes sont administrées par voie intraveineuse pendant 10 à 20 jours sous le contrôle de l'état acido-basique et du taux d'électrolytes sanguins. Pronostic et prévention. Le pronostic vital et l’aptitude au travail sont favorables dans la plupart des cas. Les signes pronostiques défavorables sont une évolution continue de la maladie, une perte de poids soudaine et importante, une anémie, un syndrome de trouble endocrinien (diminution de la libido, dysménorrhée, infertilité). La prévention de l'entérite chronique consiste en un traitement rapide des infections intestinales aiguës et des maladies concomitantes de la zone gastroduodénale, conformément au régime alimentaire, en l'administration prophylactique de préparations bactériennes pendant la radiographie et la radiothérapie. CONFÉRENCE N° 13. Maladies du tube digestif. Maladies des intestins. la maladie de Crohn La maladie de Crohn est une maladie intestinale chronique avec des manifestations systémiques ; dont la base morphologique est l'inflammation auto-immune granulomateuse du tractus gastro-intestinal. Étiologie et pathogenèse. L'étiologie et la pathogenèse de la maladie n'ont pas été suffisamment étudiées. Les concepts infectieux et immunitaires de l'apparition de la maladie sont les plus populaires. Ces dernières années, des rapports ont été publiés sur le rôle étiologique des micro-organismes du genre Yersinia. Il est cependant difficile de déterminer si ces agents microbiens sont pathogènes ou commensaux. Dans le même temps, les modifications de la microflore intestinale jouent un rôle important dans la pathogenèse de la maladie. Typiquement, une diminution des bactéries de type bifidum avec une augmentation simultanée des entérobactéries avec des signes de pathogénicité. Les mécanismes auto-immuns jouent un rôle dans le développement de la maladie. Dans la maladie de Crohn, des auto-anticorps (IgC, IgM) apparaissent contre les tissus intestinaux. Le substrat morphologique de la maladie est un processus inflammatoire auto-immun qui se produit initialement dans la couche sous-muqueuse, s'étend à toute l'épaisseur de la paroi intestinale et se caractérise par la présence d'infiltrats granulomateux suivis d'une ulcération de la muqueuse, du développement d'abcès et fistules qui guérissent avec la formation de cicatrices et le rétrécissement de la lumière intestinale. Avec une augmentation de la durée de la maladie, l'étendue de la lésion augmente et des symptômes de troubles extra-intestinaux apparaissent. Classification. Classification (F.I. Komarov, A.I. Kazanov, 1992). 1) Cours : aigu ; chronique. 2) Caractéristiques du processus : lésion au sein de l'intestin grêle ; lésion dans la région iléo-colique ; lésion à l'intérieur du côlon. 3) Complications : rétrécissement de l'intestin ; dilatation toxique du côlon; fistules; amylose; néphrolithiase, cholélithiase; À12-anémie par carence. Image clinique. Le tableau clinique de la maladie de Crohn se caractérise par une diversité significative, déterminée par la localisation et l'étendue du processus pathologique dans l'intestin, la forme de la maladie et l'ajout de complications. Le début de la maladie peut être aigu, lorsque la maladie progresse dès le début, et chronique, lorsque la maladie commence progressivement. Dans le premier cas, le diagnostic est souvent posé lors d'une laparotomie pratiquée pour une suspicion d'appendicite, ou d'occlusion intestinale qui s'est développée sans raison apparente chez des sujets jeunes. Dans le même temps, on trouve une zone hyperémique de l'intestin grêle, des ganglions lymphatiques hypertrophiés de la racine mésentérique, caractéristiques de la maladie de Crohn. Les patients se plaignent de douleurs abdominales sans localisation spécifique, d'un relâchement des selles sans impuretés pathologiques visibles, d'une perte de poids, d'une température corporelle basse. Une étude objective prête attention à la pâleur de la peau, qui est en corrélation avec la sévérité de l'anémie, le gonflement des jambes dû à une mauvaise absorption et au métabolisme des protéines. À la palpation de l'abdomen, on note des flatulences et des grondements. Lorsque le processus est localisé dans le gros intestin, on observe une alternance de constipation avec diarrhée, crampes abdominales, selles liquides ou semi-formées contenant un mélange de sang. Lorsque le tractus gastro-intestinal supérieur est affecté, des symptômes ressemblant à une œsophagite chronique, une gastrite chronique et une duodénite chronique se produisent. Il peut y avoir des douleurs derrière le sternum lors du passage des aliments dans l'œsophage, des douleurs nocturnes et "affamées" dans l'épigastre, des douleurs à la palpation dans la zone pyloroduodénale. Lors de l'examen physique du patient, la pâleur de la peau, l'état subfébrile, l'insuffisance de poids corporel sont déterminés, la palpation révèle des anses intestinales spasmodiques, des douleurs dans la zone para-ombilicale, dans la région iliaque droite. Dans la maladie de Crohn, on note des signes extra-intestinaux de la maladie: stomatite aphteuse, phlegmon et fistules de la cavité buccale, arthrite, ressemblant à la polyarthrite rhumatoïde en clinique, avec symptômes caractéristiques de lésions symétriques des petites articulations, raideur le matin. Modifications typiques des yeux : iritis, iridocyclite, maculopathie. La peau peut développer un érythème noueux et un pyoderma gangrenosum. La diarrhée se caractérise par une augmentation de la fréquence des selles jusqu'à 10 fois par jour ou plus, matière polyfécale. Le volume des selles est déterminé par la localisation anatomique du processus: en cas de lésion de l'intestin grêle proximal, le volume des matières fécales est beaucoup plus important qu'en cas de lésion des parties distales. Une perte de poids est notée chez tous les patients. Diagnostic et diagnostic différentiel. Un test sanguin clinique lors d'une exacerbation révèle une leucocytose, une anémie et une augmentation de la VS. Des modifications de l'analyse générale des urines apparaissent dans des formes sévères, caractérisées par l'ajout d'une amylose rénale (protéinurie). Un test sanguin biochimique révèle une hypoprotéinémie, une hypoalbuminémie, une augmentation des α-globulines, une diminution de la teneur en fer, en vitamine B12, acide folique, zinc, magnésium et potassium. Les données de l'examen scatologique permettent d'évaluer indirectement le niveau de la lésion. Dans le coprogramme avec la localisation intestinale du processus, on trouve de la matière polyfécale, de la stéatorrhée, de la Creatorrhée; dans le côlon - un mélange de mucus, de leucocytes, d'érythrocytes. Le diagnostic par rayons X vous permet d'établir la localisation et la prévalence du processus pathologique dans l'intestin. Les zones de l'intestin affecté alternent avec des zones de l'intestin inchangé. Les anses altérées deviennent rigides, le tableau est mosaïque avec de petits défauts de remplissage et avec la pénétration du contraste au-delà de la paroi intestinale sous forme de poches. L'intestin dans la zone touchée acquiert le caractère de finement frangé, avec la formation de pseudodiverticula. La capacité contractile de la paroi intestinale est réduite ou complètement perdue, l'évacuation du baryum ralentit. Un rétrécissement inégal de la lumière intestinale est observé, en conséquence, il devient si étroit qu'il prend la forme d'une dentelle. Au-dessus de la zone de rétrécissement, l'intestin se dilate. Le diagnostic endoscopique est d'une importance décisive dans la vérification du diagnostic. Pour la maladie de Crohn, la plus caractéristique est la modification de l'antre de l'estomac et de la section initiale du duodénum. En endoscopie, il est possible de détecter un rétrécissement circulaire de l'antre, ressemblant à une sténose tumorale. La période initiale de la maladie de Crohn est caractérisée par de mauvaises données endoscopiques : une muqueuse terne, contre laquelle sont visibles des érosions de type aphtes, entourées de granulations blanchâtres. Le schéma vasculaire est absent ou lissé. Dans la lumière de l'intestin et sur ses parois, le mucus purulent est déterminé. En rémission clinique, les changements décrits peuvent disparaître complètement. Au fur et à mesure que la maladie progresse, la muqueuse s'épaissit de manière inégale, prend une couleur blanchâtre et on note de grands ulcères de fissure superficiels ou profonds. La lumière intestinale se rétrécit, ce qui rend difficile l'avancement du coloscope. La coloscopie permet de réaliser une biopsie ciblée de la muqueuse dans n'importe quelle partie du côlon et dans l'iléon terminal. Dans la maladie de Crohn, le processus pathologique commence dans la couche sous-muqueuse, de sorte que la biopsie doit être effectuée de manière à ce qu'une partie de la couche sous-muqueuse pénètre dans le matériel de biopsie. En relation avec ce qui précède, dans 54% des cas, le substrat morphologique de la maladie n'est pas détecté. Il est nécessaire de différencier la maladie de Crohn de la colite ulcéreuse non spécifique, de la tuberculose gastro-intestinale, de la colite ischémique, de la maladie de Whipple, de la maladie diverticulaire, de la colite pseudomembraneuse, de la lymphogranulomatose, de l'amylose primitive de l'intestin grêle, de l'entérite chronique. Le syndrome de dyspepsie intestinale et certaines lésions systémiques sont communs à toutes ces maladies. Cependant, la colite ulcéreuse se caractérise par une modification des parties distales du côlon avec l'implication obligatoire du rectum et du sigmoïde dans le processus. Dans la rectocolite hémorragique non spécifique, il n'y a pas de segmentation de la lésion ; moins souvent que dans la maladie de Crohn, les manifestations systémiques sont déterminées et le syndrome de malabsorption est moins prononcé. Cependant, le diagnostic le plus précis de la maladie de Crohn est confirmé par l'endoscopie avec biopsie ciblée. La forme gastro-intestinale de la tuberculose se distingue de la maladie de Crohn par une localisation fréquente dans l'iléon, des découvertes endoscopiques qui permettent la détection d'ulcères à bords surélevés et exfoliés remplis d'un contenu grisâtre. Ces ulcères guérissent avec la formation d'une courte cicatrice, qui n'est pas observée dans la maladie de Crohn. Chez les personnes âgées, il est nécessaire de différencier la maladie de Crohn et la colite ischémique. Pour ces derniers, les crises de douleur intense dans l'abdomen après avoir mangé sont des modifications typiques de la colite détectables par irrigation irrigoscopique dans l'angle splénique, le côlon descendant et le côlon sigmoïde. Le signe radiographique le plus important de la colite ischémique est le symptôme de "l'empreinte du pouce". L'examen endoscopique et morphologique révèle des cellules contenant de l'hémosidérine typiques de la colite ischémique et une fibrose dans le matériel de biopsie. Le diagnostic de lymphogranulomatose et d'amylose intestinale primitive repose sur l'examen histologique. Dans le premier cas, des cellules de Berezovsky-Sternberg se trouvent dans l'échantillon de biopsie du ganglion lymphatique mésentérique, dans le second cas, il existe des dépôts d'amyloïde dans la muqueuse rectale. traitement. Une alimentation mécaniquement et chimiquement douce, à haute teneur en protéines, vitamines, microéléments, est prescrite, à l'exclusion du lait en cas d'intolérance et en limitant les fibres végétales grossières. L'utilisation d'hydrolysats entéraux liquides est indiquée. Les préparations de salazo et les corticostéroïdes constituent la base de la pharmacothérapie pathogénique. La dose quotidienne de médicaments est de 3 à 6 g.Avec la localisation du processus pathologique dans le gros intestin, l'activité de la sulfasalazine dépasse l'activité de la prednisolone. En l'absence d'effet de l'utilisation de la sulfasalazine, avec des lésions prédominantes de l'intestin grêle et des signes prononcés d'inflammation immunitaire, ainsi qu'en présence de manifestations systémiques de la maladie, l'utilisation de corticostéroïdes est indiquée. L'effet de leur utilisation est noté dans les 8 premières semaines à compter du début du traitement. La prednisolone est prescrite selon le schéma suivant: au plus fort de l'exacerbation, 60 mg par jour, puis la dose est progressivement réduite et, à la 6-10e semaine, est ajustée à une dose d'entretien de 5-10 mg par jour. Après avoir atteint la rémission clinique, le médicament est progressivement annulé. Si la rémission n'est pas obtenue, le traitement par prednisolone est poursuivi en ambulatoire jusqu'à 52 semaines. En cas d'évolution sévère de la maladie, en cas de complications sous forme de fistules rectovaginales, cutanées-entériques, entéro-entériques, la nomination de 6-mercaptopurine par voie orale à 0,05 g 2 à 3 fois par jour est indiquée pour des cours de 10 jours avec un intervalle de 3 jours jusqu'à l'obtention d'une rémission clinique. Par la suite, ils passent à la prise de doses d'entretien du médicament au cours de l'année. La dose de 6-mercaptopurine dans ce cas est de 75 mg par jour. L'effet du traitement par immunosuppresseurs ne peut être déterminé qu'après 3-4 mois. Le métronidazole a été largement utilisé dans le traitement de la maladie de Crohn, dont les principales indications sont les fistules et fissures périanales, l'absence d'effet des préparations de salazo et des glucocorticoïdes, ainsi que les rechutes de la maladie après proctectomie. Le médicament est prescrit à une dose de 500-1000 mg par jour. La durée du cours continu ne doit pas dépasser 4 semaines. Le traitement symptomatique de la maladie de Crohn est réduit à la nomination de cours courts (2-3 jours chacun) de médicaments antidiarrhéiques (imodium, lopéramide). Les doses sont choisies individuellement en fonction de l'effet clinique. Ne pas prescrire d'antidiarrhéiques pendant une longue période (plus de 5 jours). En raison de la présence d'un syndrome de malabsorption dans la maladie de Crohn, les préparations enzymatiques ne contenant pas d'acides biliaires (pancréatine, mésimforte, solizim, somilase) sont utilisées à raison de 2 à 6 comprimés à chaque repas. Selon les indications, l'anémie et l'hypoalbuminémie sont corrigées en prescrivant des préparations de fer (par voie parentérale) et en administrant Alvezin, hydrolyseurs de protéines, aminopeptide, aminosang. Attribuez des multivitamines en pilules, Essentiale en capsules. Le traitement de la dysbactériose est effectué selon les règles générales. Pronostic et prévention. Avec la maladie de Crohn, le pronostic à vie avec un diagnostic rapide et un suivi efficace est favorable, mais pour le travail, il est incertain. Chez les patients atteints d'une maladie grave, en présence de complications et de manifestations systémiques, un groupe de handicap I ou II est établi. La maladie de Crohn est une maladie précancéreuse. Le patient doit être familiarisé en détail avec les caractéristiques de l'évolution de la maladie et averti des complications possibles, en décrivant leurs manifestations cliniques sous une forme accessible. CONFÉRENCE N° 14. Maladies du tube digestif. Maladies du côlon. Colite ulcéreuse non spécifique La colite ulcéreuse non spécifique est une maladie inflammatoire qui affecte la membrane muqueuse du côlon avec des modifications ulcéro-destructrices, qui a une évolution chronique récurrente, souvent accompagnée du développement de complications potentiellement mortelles. Étiologie et pathogenèse. La colite ulcéreuse non spécifique est une maladie idiopathique. Les raisons de son apparition ne sont pas connues. Parmi les nombreuses théories expliquant l'origine de la maladie (infectieuse, enzymatique, allergique, immunitaire, neurogène, etc.), la théorie infectieuse est la plus intéressante, mais les tentatives pour isoler l'agent pathogène du contenu du côlon ont échoué. Le processus pathologique de la colite ulcéreuse chronique commence dans le rectum et se propage dans la direction proximale, capturant les parties sus-jacentes du côlon. L'inflammation peut être limitée au rectum (proctite), au rectum et au sigmoïde (proctosigmoïdite), s'étendre à toute la section gauche (colite gauche) ou affecter tout le côlon (colite totale). En termes fonctionnels, la longueur du côlon dans les colites non spécifiques est réduite d'environ 1/3. Dans l'étude du matériel pathologique a révélé une inflammation diffuse de la membrane muqueuse du côlon (gonflement prononcé et pléthore, épaississement des plis). Des ulcères de différentes tailles se forment dans la muqueuse, de forme irrégulière, dont le fond est situé dans la membrane muqueuse, moins souvent dans la couche sous-muqueuse, dans les membranes musculaires et séreuses. Morphologiquement, dans la période initiale, un infiltrat dans la lamina propria de la membrane muqueuse est déterminé, constitué de lymphocytes avec un mélange de leucocytes polymorphonucléaires, une dilatation des vaisseaux sanguins et un gonflement de l'endothélium de ces vaisseaux. La violation de la microcirculation s'accompagne du développement de l'hypoxie, qui exacerbe les violations de la structure et de la fonction de l'épithélium muqueux. Le stade des manifestations cliniques prononcées s'accompagne d'une infiltration leucocytaire de la couche superficielle de l'épithélium, du développement d'une cryptite, dans laquelle des accumulations de neutrophiles se produisent dans la lumière des cryptes. Les parties distales des cryptes sont oblitérées, des abcès de crypte apparaissent, dans la formation desquels un rôle important est joué par une altération de la maturation des épithéliocytes. Avec la nécrose de l'épithélium tapissant les cryptes, les abcès des cryptes s'ouvrent, des ulcères se forment. Pendant la période de rémission, la membrane muqueuse est restaurée, mais son atrophie, la déformation des cryptes et l'épaississement inégal de la lamina propria demeurent. Classification (Yu. V. Baltaitis et al., 1986). Caractéristique clinique. 1. Forme clinique : 1) aigu ; 2) chronique. 2. Actuel : 1) progresse rapidement ; 2) rechutant continuellement ; 3) récurrent ; 4) latente. 3. Degré d'activité : 1) exacerbation ; 2) exacerbation de la décoloration ; 3) rémission. 4. Gravité : 1) lumière ; 2) modéré ; 3) lourd. Caractéristique anatomique. 1. Caractéristique macroscopique : 1) rectite : 2) proctosigmoïdite ; 3) lésion sous-totale ; 4) défaite totale. 2. Caractéristique microscopique : 1) la prédominance des processus destructeurs-inflammatoires; 2) réduction des processus inflammatoires avec des éléments de réparation; 3) conséquences du processus inflammatoire Complications. 1. Locale : 1) saignement intestinal ; 2) perforation du côlon ; 3) rétrécissement du côlon ; 4) pseudopolypose ; 5) infection intestinale secondaire ; 6) disparition de la muqueuse ; 7) dilatation toxique du côlon ; 8) malignité. 2. Général : 1) hypocorticisme fonctionnel ; 2) septicémie ; 3) manifestations systémiques - arthrite, sacroiliite, lésions cutanées, iritis, amylose, phlébite, cholangite sclérosante, dystrophie hépatique. Image clinique. Le tableau clinique de la colite ulcéreuse est polymorphe et dépend de la gravité de l'évolution et de la gravité du processus. L'évolution du processus inflammatoire, souvent considérée comme chronique, devient dans certains cas aiguë. L'étendue des dommages au côlon peut également varier. La colite ulcéreuse non spécifique se caractérise par 3 principaux symptômes : un écoulement de sang écarlate lors des selles, un dysfonctionnement intestinal et des douleurs abdominales. L'isolement du sang (des stries à la surface des matières fécales jusqu'à 300 ml ou plus) pendant la défécation est le premier signe de la maladie. Dans la forme aiguë de la maladie, le sang est sécrété par un jet, ce qui entraîne une diminution de la pression artérielle jusqu'au développement d'un collapsus et d'un choc hémorragique. Le dysfonctionnement intestinal se manifeste sous la forme de plaintes de selles instables répétées, qui sont le résultat de dommages importants à la membrane muqueuse et d'une diminution de l'absorption d'eau et de sels. Le plus souvent, la diarrhée survient avec une colite ulcéreuse sévère. Cependant, la diarrhée n'est pas un indicateur fiable de la gravité du processus. La gravité de la diarrhée associée à la présence de sang rouge dans les selles est importante. Chez un nombre important de patients atteints de colite ulcéreuse, du sang et du mucus se retrouvent périodiquement à la surface des matières fécales formées, ce qui est souvent considéré à tort comme une manifestation d'hémorroïdes. Les patients se plaignent de douleurs dans le bas-ventre de nature crampes ou persistantes, qui sont plus souvent localisées dans l'hypogastre ou la région iliaque gauche, augmentent avant l'acte de défécation et disparaissent après celui-ci. Un ténesme est souvent noté. Lorsque les couches sous-muqueuse, musculaire et séreuse de l'intestin sont impliquées dans le processus, la douleur augmente; la palpation de l'abdomen fait apparaître la défense des muscles de la paroi abdominale antérieure. L'évolution bénigne de la colite ulcéreuse non spécifique se caractérise par un état satisfaisant des patients. La douleur dans l'abdomen est modérée et de courte durée. La chaise est décorée, accélérée, jusqu'à 2-3 fois par jour. Du sang et du mucus se retrouvent dans les selles. Le processus est localisé dans le rectum et le côlon sigmoïde. L'évolution clinique est récurrente. L'effet du traitement avec salazopreparations est satisfaisant. Les rechutes ne surviennent pas plus de 2 fois par an. Les rémissions peuvent être longues (plus de 2-3 ans). L'évolution modérée de la maladie est diagnostiquée si le patient a la diarrhée. La chaise est fréquente (jusqu'à 6-8 fois par jour), dans chaque portion un mélange de sang et de mucus est visible. Les crampes dans l'abdomen sont plus intenses. Il existe une fièvre intermittente avec une élévation de la température corporelle jusqu'à 38°C, une faiblesse générale intense. Il peut également y avoir des manifestations extra-intestinales de la maladie (arthrite, uvéite, érythème noueux). Le cours est continuellement récurrent, l'effet des préparations salazo est instable, les hormones sont prescrites lors des exacerbations. La forme sévère de la maladie se caractérise par un début aigu. Une lésion totale du gros intestin se développe rapidement avec la propagation du processus pathologique profondément dans la paroi intestinale. L'état du patient se détériore fortement. La clinique se caractérise par une apparition soudaine, une forte fièvre, une diarrhée abondante jusqu'à 24 fois par jour, des saignements intestinaux abondants et une augmentation rapide de la déshydratation. Une tachycardie apparaît, la pression artérielle diminue, les manifestations extra-intestinales de la colite ulcéreuse non spécifique augmentent. Le traitement conservateur n'est pas toujours efficace et une intervention chirurgicale d'urgence est souvent nécessaire. Diagnostic et diagnostic différentiel. Dans les tests sanguins cliniques dans les formes bénignes de la maladie, une légère leucocytose neutrophile, une augmentation de la VS et la numération globulaire rouge ne sont pas modifiées. À mesure que la gravité de l'évolution augmente et que la durée de l'exacerbation augmente, une anémie d'origine mixte apparaît (B12-déficients et carencés en fer), augmentation de la VS. Dans l'analyse biochimique du sang dans les formes modérées et sévères, on note une dysprotéinémie, une hypoalbuminémie, une hypergammaglobulinémie, un déséquilibre électrolytique et un état acido-basique. Dans l'analyse générale de l'urine, les changements n'apparaissent que lorsque des complications se produisent sous la forme d'un syndrome néphrotique dans le contexte de l'amylose, lorsqu'il y a des changements caractéristiques dans les tests d'urine - protéinurie, sédiment urinaire "mort", il y a aussi une augmentation du sang et le niveau de créatinine, urée. Le rôle principal dans le diagnostic est acquis par l'examen endoscopique avec biopsie ciblée, car dans la colite ulcéreuse non spécifique, la muqueuse du côlon est principalement touchée. Le rectum est toujours impliqué dans le processus pathologique, c'est-à-dire que des modifications érosives et ulcéreuses sont détectées lors de l'endoscopie immédiatement derrière le sphincter anal lors de la sigmoïdoscopie. Dans la colite ulcéreuse, la courbure recto-sigmoïdienne n'est pas toujours possible à surmonter en raison d'un spasme sévère. Une tentative de tenir le tube du proctoscope s'accompagne d'une douleur intense. Dans cette situation, le proctoscope doit être inséré à une profondeur maximale de 12 à 15 cm. La coloscopie lors d'une exacerbation sévère de colite ulcéreuse non spécifique n'est pas sûre à réaliser. Il doit être utilisé en cas de risque élevé de malignité. Il convient de noter le contenu informatif élevé de la sigmoïdoscopie. L'image endoscopique dépend de la forme de la maladie. Avec une forme bénigne, une muqueuse terne oedémateuse, des couches épaisses de mucus blanchâtre sur les parois de l'intestin, de légers saignements de contact sont visibles. Le schéma vasculaire de la couche sous-muqueuse n'est pas déterminé visuellement. Avec une évolution modérée de la maladie, une hyperémie et un œdème de la membrane muqueuse, des saignements de contact sévères, des hémorragies, des érosions et des ulcères de forme irrégulière, des couches épaisses de mucus sur les parois de l'intestin sont révélées. Dans une évolution sévère de la maladie, la membrane muqueuse du côlon est détruite sur une étendue considérable. On trouve une surface interne granuleuse et saignante, de vastes zones d'ulcération avec des dépôts fibrineux, des pseudopolypes de différentes tailles et formes, du pus et du sang dans la lumière intestinale. Les contre-indications à la coloscopie et à la sigmoïdoscopie sont des formes sévères de colite ulcéreuse au stade aigu de la maladie. L'examen radiographique vous permet de déterminer l'étendue de la lésion; clarifier le diagnostic en cas de données endoscopiques insuffisamment convaincantes ; diagnostic différentiel avec la maladie de Crohn, la maladie diverticulaire, la colite ischémique ; détecter en temps opportun les signes de malignité. Les radiographies simples peuvent révéler un raccourcissement de l'intestin, une absence d'haustration, une dilatation toxique, des gaz libres sous le dôme du diaphragme lors de la perforation. L'irrigoscopie doit être effectuée avec beaucoup de soin. Cela peut provoquer une détérioration de l'état du patient. Dans certains cas, la préparation du patient au lavement baryté avec lavements et laxatifs doit être remplacée par un régime alimentaire spécial prescrit 2 jours avant l'étude. Dans certains cas, l'utilisation d'un lavement de contraste peut accélérer la perforation ou provoquer une dilatation toxique du côlon. Par conséquent, l'irrigoscopie est réalisée après la disparition des phénomènes aigus. Cette méthode révèle des irrégularités et un "grain" de la muqueuse, un épaississement de la paroi intestinale, une ulcération, une pseudopolypose, un manque d'haustration. Le diagnostic différentiel de la colite ulcéreuse non spécifique est réalisé principalement avec des infections intestinales aiguës. En présence d'une épidémie d'infections intestinales, le diagnostic est facilement établi. Mais même en cas de morbidité sporadique dans les infections intestinales aiguës, le syndrome de la colite coule sans rechutes, tandis que la colite ulcéreuse a une évolution récurrente. Les méthodes les plus précises pour identifier une infection intestinale aiguë sont bactériologiques et sérologiques. Souvent, la colite ulcéreuse est différenciée de la maladie de Crohn. Dans les cas typiques, la maladie de Crohn diffère de la colite non spécifique par l'absence de lésion du rectum, une implication fréquente de l'iléon dans le processus pathologique et des lésions segmentaires de la paroi intestinale. Le diagnostic définitif peut être posé en détectant des granulomes lymphoïdes spécifiques de la maladie de Crohn dans des échantillons de biopsie. Avec la colite granulomateuse, la paraproctite et les fistules pararectales sont détectées plus souvent qu'avec la colite ulcéreuse non spécifique. Dans certains cas, il devient nécessaire de faire la distinction entre la colite ulcéreuse et la tuberculose intestinale. Pour la tuberculose intestinale, une certaine localisation du processus est caractéristique (iléon, région iléo-colique), lésion intestinale segmentaire. Mais parfois, avec la tuberculose intestinale, le rectum et tout le gros intestin sont touchés. L'image coloscopique de la tuberculose intestinale est caractérisée par la présence d'ulcères à bords relevés remplis d'un contenu grisâtre. Les ulcères tuberculeux ont tendance à se propager dans le sens transversal et à laisser de courtes cicatrices dans lesquelles les ulcères réapparaissent. Avec la colite ulcéreuse non spécifique, les cicatrices ne se forment pas sur le site des anciens ulcères. Chez les patients âgés et séniles, la colite ulcéreuse doit être différenciée de la colite ischémique. Cette dernière se caractérise par une douleur intense et paroxystique dans l'abdomen 20 à 30 minutes après avoir mangé, tandis que dans la colite ulcéreuse, la douleur survient avant l'acte de défécation. Le signe radiologique le plus important est le symptôme "empreinte du pouce". L'image endoscopique de la colite ischémique est caractérisée par des limites bien définies de la lésion, des hémorragies sous-muqueuses, des formations pseudopolypes cyanotiques faisant saillie dans la lumière intestinale. L'examen histologique révèle des cellules contenant de l'hémosidérine et une fibrose. L'absence de saignement de contact au moment de la biopsie est également plus révélatrice d'une colite ischémique. traitement. L'absence d'un facteur étiologique unique et la complexité de la pathogenèse de la colite ulcéreuse non spécifique rendent le traitement de cette maladie difficile. Des médicaments ayant des effets anti-inflammatoires et antibactériens sont utilisés : salazopyridazine, sulfasalazine, salazodiméthoxine, salofalk. La sulfasalazine prise par voie orale, avec la participation de la microflore intestinale, se décompose en acide 5-aminosalicylique et sulfapyridine. La sulfapyridine non absorbée inhibe la croissance de la microflore anaérobie dans l'intestin, notamment les clostridies et les bactériodes. Et grâce à l'acide 5-aminosalicylique, le médicament provoque non seulement des modifications de la microflore intestinale, mais module également les réactions immunitaires et bloque les médiateurs du processus inflammatoire. Le médicament est prescrit à la dose de 2 à 6 g par jour pendant toute la période d'inflammation active. Lorsque le syndrome colique s'atténue, la dose de sulfasalazine est réduite progressivement pour la ramener à l'entretien (en moyenne 1 à 1,5 comprimés par jour). La nomination de dérivés d'acide 5-aminosalicylique (salofalk, mesacol, salosan, tidikol) est la méthode de base et peut être utilisée en monothérapie pour les formes légères et modérées de colite ulcéreuse. Le traitement est effectué dans le contexte d'une thérapie diététique à l'exception des produits laitiers, en présence d'une teneur équilibrée en protéines, lipides, glucides et vitamines dans l'alimentation. Il est conseillé d'exclure les fruits frais, les légumes et les conserves. Les aliments doivent être mécaniquement et chimiquement doux. Nourrissez fractionné 4-5 fois par jour. Le déséquilibre vitaminique perturbe le processus d'absorption des microéléments et est compensé par la nomination de préparations complexes en comprimés ("Duovit", "Oligovit", "Unicap"). En cas de syndrome diarrhéique sévère chez les personnes atteintes d'une maladie légère à modérée, la sandostatine est indiquée, qui inhibe la synthèse des hormones gastro-intestinales et des amines biogènes (peptide intestinal vasoactif, gastrine, sérotonine), dont la production est fortement augmentée dans la colite ulcéreuse et la maladie de Crohn. De plus, le médicament réduit la sécrétion et améliore l'absorption dans l'intestin, inhibe le flux sanguin viscéral et réduit la motilité. Lors de l'utilisation de sandostatine (dans les 7 jours à une dose de 0,1 mg 2 fois, par voie sous-cutanée), la diarrhée diminue, le ténesme disparaît pratiquement et l'excrétion sanguine avec les matières fécales diminue. Dans une forme sévère de colite ulcéreuse non spécifique, le traitement est effectué dans le contexte de la nutrition parentérale. La teneur en protéines de ces préparations doit être d'environ 1,5 à 2,0 g/kg de poids corporel. Les corticostéroïdes, administrés par voie parentérale, constituent un traitement pathogénique pour une forme grave de la maladie: le premier jour, la prednisolone est administrée par voie intraveineuse à des intervalles de 12 heures (90-120 mg ou plus), dans les 5 jours suivants - par voie intramusculaire, réduire progressivement la dose. Avec un effet positif, ils passent à des médicaments oraux (prednisolone 40 mg par jour). L'administration à long terme d'hormones pendant une période de rémission stable n'est pas pratique. Chez les patients présentant une évolution sévère de la maladie, un effet positif de l'oxygénation hyperbare (HBO) a été noté. L'utilisation d'un cours de HBO (7-10 procédures) pendant la période de rémission peut réduire la fréquence des rechutes. Indications du traitement chirurgical d'urgence : perforation intestinale, dilatation toxique, hémorragie intestinale abondante, malignité. Dans la forme modérée de l'évolution de l'ulcère ulcéreux non spécifique, un régime strict est nécessaire avec une restriction des fibres, des produits laitiers et une teneur élevée en protéines. La prednisolone est administrée par voie orale à une dose initiale de 20 à 40 mg par jour. Le traitement peut être complété par de la sulfasalazine et ses analogues, qui sont pris par voie orale ou administrés dans des microclysters et des suppositoires dans le rectum. La dose initiale de sulfasalazine est de 1 g par jour, puis elle est augmentée à 4-6 g. En tant que méthode auxiliaire de traitement, des décoctions d'herbes aux effets anti-inflammatoires et hémostatiques (racine de pimprenelle, feuille d'ortie, lichen, cônes d'aulne gris, racine de réglisse) peuvent être utilisées, la phytothérapie permet souvent de réduire la dose de salazopréparations, de prolonger remise. Pronostic et prévention. Dans les cas graves et en présence de complications systémiques et locales, le pronostic est grave. Les patients sont complètement incapables de travailler. Dans les formes légères et modérées de la maladie, le pronostic à vie est favorable. Les patients doivent être transférés vers des travaux légers. Pendant la période de rémission, un traitement d'entretien avec des préparations de salazo, des agents bactériens, une psychothérapie et une thérapie diététique est recommandé. Les patients souffrant de colite ulcéreuse non spécifique pendant une longue période (plus de 5 à 7 ans) doivent être affectés au groupe à risque de survenue d'un cancer de l'intestin et inscrits dans les dossiers du dispensaire. Ces patients sont présentés une fois par an par coloscopie avec biopsie ciblée. CONFÉRENCE N° 15. Maladies des reins. Glomérulonéphrite aiguë La glomérulonéphrite aiguë (AGN) est une maladie rénale aiguë diffuse de nature infectieuse-allergique, localisée dans les glomérules. L'AGN peut être une maladie indépendante (primaire) ou être secondaire dans le cadre d'une autre maladie, compliquant le tableau clinique et le diagnostic de cette dernière. L'AGN affecte généralement les hommes jeunes et d'âge moyen. Étiologie. L'AGN survient le plus souvent après une infection coccique (grippe, amygdalite aiguë, pharyngite causée par des souches de micro-organismes dites néphritogènes). Chez 60 à 80 % des patients, le streptocoque β-hémolytique du groupe A est détecté ; dans 1/3 des cas, l'étiologie de l'AGN ne peut être établie. L'hypothermie prolongée, en particulier dans des conditions de forte humidité, contribue au développement de l'AGN. La vaccination est également un facteur d'apparition de la maladie, et dans 75 % des cas, les reins sont atteints après la deuxième ou la troisième injection. pathogénèse. La pathogenèse de la maladie a un mécanisme immunitaire : lorsque des antigènes (streptocoques, médicaments, protéines étrangères) pénètrent dans l'organisme, des anticorps se forment en réponse, se liant à ces antigènes et, avec la 3ème fraction du complément, formant des complexes immuns circulant dans le système vasculaire. lit. Les complexes sont capables de se déposer sur la face externe de la membrane basale des capillaires glomérulaires, provoquant leurs dommages par la libération de produits de dégradation du complément, qui augmentent la perméabilité des capillaires et provoquent des modifications locales de ces derniers. Les neutrophiles se précipitent vers les sites de dépôt de complexes immuns, dont les enzymes lysosomales aggravent les dommages causés à l'endothélium et à la membrane basale, les séparant les uns des autres. La dégranulation plaquettaire provoque la libération de sérotonine, entraînant une hémocoagulation et un dépôt de fibrine sur la membrane basale. L'élimination des complexes immuns du corps est facilitée par une réaction macrophage sous forme de prolifération de cellules mésangiales et endothéliales, avec l'efficacité de ce processus, la récupération se produit. Image clinique. Le tableau clinique de la maladie comprend les syndromes suivants. syndrome urinaire. 1. Protéinurie due au passage de molécules protéiques à travers les espaces de la paroi capillaire du glomérule, formées lors du dépôt de complexes immuns sur celles-ci. La protéinurie est de nature sélective, dans laquelle principalement les albumines passent à travers le "filtre" glomérulaire. 2. Hématurie due à l'implication du mésangium capillaire et du tissu interstitiel dans le processus pathologique. Les érythrocytes pénètrent à travers les plus petites ruptures de la membrane basale, changeant de forme. 3. Cylindrurie - excrétion urinaire de cellules cylindriques des tubules. Au cours des processus dystrophiques dans les tubules des cellules désintégrées de l'épithélium rénal, des cylindres granulaires se forment, constitués d'une masse granuleuse dense; les cylindres cireux ont des contours nets et une structure homogène; les cylindres hyalins sont des formations protéiques. Le syndrome hypertensif est observé en raison de: 1) rétention de sodium et d'eau; 2) activation des systèmes rénine-angiotensine-aldostérone et sympatho-surrénalien ; 3) diminution de la fonction du système dépresseur des reins. Le syndrome d'œdème est associé aux facteurs suivants : 1) une diminution de la filtration glomérulaire due à leur défaite ; 2) une diminution de la charge de filtration du sodium et une augmentation de sa réabsorption ; 3) rétention d'eau due à la rétention de sodium dans le corps ; 4) une augmentation du CBC ; 5) hyperaldostéronisme secondaire ; 6) une augmentation de la sécrétion d'ADH et une augmentation de la sensibilité du néphron distal à celui-ci, entraînant une rétention d'eau ; 7) une augmentation de la perméabilité des parois capillaires et de la libération de plasma dans les tissus ; 8) une diminution de la pression oncotique plasmatique avec une protéinurie massive. Les plaintes présentées dans l'AGN ne sont pas spécifiques et se produisent dans diverses maladies. Il est très important d'indiquer dans l'anamnèse un mal de gorge récent, une exacerbation d'une amygdalite chronique, une hypothermie, etc. Certains patients notent une diminution du débit urinaire, associée à un gonflement (pâteux) du visage le matin. Chez 1/3-3/4 patients dans les premiers jours de la maladie, il n'y a pas de douleurs très fortes et douloureuses dans la région lombaire associées à une augmentation de la taille des reins. Il y a aussi une fatigue accrue, des maux de tête, un essoufflement lors d'un effort physique, une augmentation à court terme de la température corporelle jusqu'à subfébrile. L'hypertension artérielle, détectée seulement chez la moitié des patients, se caractérise par une augmentation du nombre à 140-160 / 85-90 mm Hg. Art. (rarement - jusqu'à 180/100 mm Hg. Art.). diagnostics. Dans 100 % des cas, l'examen des urines révèle une protéinurie de gravité variable, une cylindrurie et, ce qui est le plus important pour le diagnostic, une hématurie de gravité variable - de la microhématurie (jusqu'à 10 globules rouges dans le champ de vision) à la macrohématurie (bien qu'assez rare). ). Cependant, si une AGN est suspectée, il est nécessaire d'effectuer une série d'analyses d'urine répétées ou d'effectuer un test de Nechiporenko (déterminant le nombre d'éléments formés dans 1 µl), car les globules rouges peuvent ne pas être détectés dans une seule portion d'urine. Lors de l'examen du sang, des indicateurs de phase aiguë sont détectés (augmentation de la teneur en fibrinogène et α2-globuline, protéine C-réactive, accélération de la RSE), le nombre de leucocytes change peu, anémie modérée. Avec une évolution simple de l'AGN, la teneur en substances azotées (créatinine, indican, urée) dans le sang ne change pas. Dans la phase initiale de la maladie, on observe une modification du test de Reberg - une diminution de la filtration glomérulaire et une augmentation de la réabsorption tubulaire, qui se normalise à mesure qu'elle se rétablit. Un examen radiologique chez les patients souffrant d'hypertension artérielle sévère peut montrer une augmentation modérée du ventricule gauche, qui prend la même taille que le patient se rétablit. Il existe 3 variantes cliniques d'AGN. 1) Variante monosymptomatique : plaintes mineures, absence d'œdème et d'hypertension artérielle, il n'y a qu'un syndrome urinaire ; la variante la plus courante de l'évolution de la maladie (86% des cas). 2) Variante néphrotique: œdème, oligurie sont prononcés, il est possible d'augmenter la pression artérielle à des nombres relativement faibles, il est détecté chez 8% des patients. 3) Version étendue: hypertension artérielle, atteignant des nombres élevés (180/100 mm Hg), œdème modérément prononcé, insuffisance circulatoire, survient dans 6% des cas. Diagnostic différentiel. L'AGN doit être distinguée de la glomérulonéphrite chronique, qui n'est pas difficile avec l'apparition aiguë de l'AGN et l'inversion complète des symptômes qui s'ensuit. Cependant, en l’absence d’apparition aiguë, ainsi qu’en cas de persistance à long terme de certains signes de la maladie, le diagnostic devient nettement plus compliqué. Si la différenciation est difficile, on a recours à une biopsie par ponction du rein. Il est difficile de différencier l'AGN de la pyélonéphrite en raison de la présence de leucocyturie dans les deux maladies. Cependant, l'AGN s'accompagne d'une protéinurie plus massive et, dans certains cas, d'un œdème. Le diagnostic différentiel est également aidé par les symptômes cliniques de la pyélonéphrite sous la forme de douleurs lombaires plus prononcées, accompagnées de fièvre et de troubles dysuriques. La détermination de la bactériurie dans la pyélonéphrite, l'identification des leucocytes "actifs", ainsi que les études radiographiques (déformation des cupules) et isotopo-rénographiques (asymétrie de la fonction rénale) ont également une valeur diagnostique. L'AGN en tant que maladie indépendante doit être différenciée des maladies chroniques diffuses du tissu conjonctif, dans lesquelles l'AGN est l'une des manifestations de la maladie. Cette situation survient généralement avec la gravité des syndromes urinaires, hypertensifs et œdémateux et la clarté insuffisante des autres symptômes de la maladie, plus souvent avec le LED (lupus érythémateux disséminé). Le diagnostic correct du LED peut être posé en tenant compte du syndrome articulaire, des lésions de la peau et d'autres organes (cœur), des modifications immunologiques prononcées (détection d'anticorps anti-organes à titre élevé, cellules lupus érythémateuses, anticorps anti-ADN et ARN ), ainsi que le suivi de la dynamique du tableau clinique. traitement. Le traitement de l'AGN est complexe et comprend les mesures suivantes. 1. Mode. Si l'AGN est suspectée ou immédiatement après l'établissement du diagnostic, le patient doit être immédiatement hospitalisé. Un alitement strict doit être observé pendant environ 2 à 4 semaines jusqu'à l'élimination de l'œdème et la normalisation de la pression artérielle. Le fait de rester au lit procure un réchauffement uniforme du corps, ce qui entraîne une diminution du vasospasme (donc une diminution de la pression artérielle) et une augmentation de la filtration glomérulaire et de la diurèse. Après la sortie de l'hôpital, le traitement à domicile est indiqué jusqu'à 4 mois à compter de la date d'apparition de la maladie, ce qui constitue la meilleure prévention du passage de l'AGN au stade chronique. 2. Régime alimentaire. Selon la sévérité des symptômes cliniques, il est très important de limiter les liquides et le chlorure de sodium. Avec une forme élargie et néphrotique, un jeûne complet est recommandé pendant 1 à 2 jours avec un apport hydrique en quantité égale à la diurèse. Le 2-3ème jour, la consommation d'aliments riches en sels de potassium (bouillie de riz, pommes de terre) est indiquée. La quantité totale d'eau bue par jour doit être égale au volume d'urine alloué pour la veille plus 300 à 500 ml. Après 3-4 jours, le patient est transféré à un régime avec restriction protéique (jusqu'à 60 g par jour) et la quantité totale de sel ne dépasse pas 3-5 g / jour. Un tel régime est recommandé jusqu'à la disparition de tous les symptômes extrarénaux et une nette amélioration des sédiments urinaires. 3. La pharmacothérapie comprend principalement l'antibiothérapie, qui, cependant, ne doit être effectuée que si la nature infectieuse de l'AGN est établie de manière fiable (l'agent pathogène a été isolé et pas plus de 3 semaines se sont écoulées depuis le début de la maladie). Habituellement prescrit la pénicilline ou ses analogues semi-synthétiques à des doses conventionnelles. La présence de foyers évidents d'infection chronique (amygdalite, sinusite, etc.) est également une indication directe de l'antibiothérapie. Les diurétiques dans le traitement de l'AGN ne sont indiqués qu'en cas de rétention d'eau, d'augmentation de la pression artérielle et d'apparition d'insuffisance cardiaque. Le furosémide le plus efficace (40-80 mg), utilisé jusqu'à l'élimination de l'œdème et de l'hypertension. Il n'y a pas besoin d'une prescription à long terme de ces médicaments, 3-4 doses suffisent. En l'absence d'œdème, mais d'hypertension artérielle persistante ou d'effet antihypertenseur insuffisant des salurétiques, des antihypertenseurs (clophéline, dopegyt) sont prescrits avec une durée d'administration qui dépend de la persistance de l'hypertension artérielle. Dans la forme néphrotique de l'AGN, un traitement immunosuppresseur est prescrit (corticostéroïdes - prednisolone 60-120 mg par jour, suivi d'une réduction progressive de la dose, durée d'utilisation de 4 à 8 semaines). En cas d'AGN avec œdème sévère et diminution significative de la diurèse, l'héparine est administrée à raison de 20 000 à 30 000 UI par jour pendant 4 à 6 semaines, ce qui permet d'augmenter le temps de coagulation sanguine de 2 à 3 fois. En cas de protéinurie prolongée, l'indométhacine ou le voltarène sont prescrits à raison de 75 à 150 mg par jour (en l'absence d'hypertension et d'oligurie). Le pronostic est favorable, cependant, avec des formes prolongées, il est possible que le processus devienne chronique. La prévention de l'AGN se résume à un traitement efficace de l'infection focale, un durcissement rationnel. Afin de détecter en temps opportun l'apparition de la maladie après la vaccination, les ARVI transférés chez tous les patients, il est nécessaire d'examiner l'urine. CONFÉRENCE N° 16. Maladies des reins. Pyélonéphrite La pyélonéphrite est une maladie infectieuse dans laquelle le bassinet du rein, ses calices et la substance des reins sont impliqués dans le processus, avec une lésion prédominante du tissu interstitiel. À cet égard, la pyélonéphrite est une néphrite interstitielle (interstitielle). Il s'agit d'un concept plus large que la pyélonéphrite. Il désigne, d'une part, un type d'inflammation des reins de toute étiologie avec atteinte prédominante de l'interstitium, et d'autre part, une maladie particulière dans laquelle cette inflammation est sa seule et principale expression. Près de la néphrite interstitielle se trouve la néphrite dite tubulo-interstitielle, dans laquelle il existe une lésion amicale des tubules et du stroma des reins. Classification. Sur la base des données cliniques et morphologiques, on distingue la pyélonéphrite aiguë et chronique, qui a généralement une évolution récurrente sous la forme d'attaques de pyélonéphrite aiguë. De plus, la pyélonéphrite peut être unilatérale ou bilatérale. Selon la forme de l'évolution (pour la pyélonéphrite chronique) : forme récurrente, pyélonéphrite chronique latente, rein plissé pyélonéphritique. Étiologie et pathogenèse. La pyélonéphrite est une maladie infectieuse. Ses agents responsables sont des agents infectieux de nature non spécifique : E. coli, entérocoques, staphylocoques et autres bactéries, mais dans la plupart des cas on parle d'E. coli (40 %) et de flore mixte (38 %). L'attention est attirée sur les formes L des bactéries, les protoplastes (les corps des bactéries, dépourvus de membranes pouvant favoriser l'infection), les candida, qui peuvent provoquer une pyélonéphrite chronique. Les sources d'infection peuvent être les amygdales, les maladies des organes génitaux et du gros intestin, c'est-à-dire que les agents infectieux peuvent pénétrer dans les reins, y compris le bassin, avec la circulation sanguine (pyélonéphrite hématogène descendante), ce qui est observé dans de nombreuses maladies infectieuses (fièvre typhoïde, grippe). , angine, septicémie). Le plus souvent, les microbes sont amenés dans les reins par voie ascendante à partir des uretères, de la vessie, de l'urètre (pyélonéphrite urogène ascendante), ce qui est facilité par une dyskinésie des uretères et du bassin, une augmentation de la pression intrapelvienne (reflux vésicorénal et pyélorénal), ainsi que réabsorption du contenu du bassin dans les veines de la médullaire rénale (reflux pyéloveineux). La pyélonéphrite ascendante, en règle générale, complique les maladies du système génito-urinaire, dans lesquelles l'écoulement de l'urine est difficile (calculs et rétrécissements des uretères, rétrécissements de l'urètre, tumeurs du système génito-urinaire), de sorte qu'il se développe souvent pendant la grossesse. Une infection lymphogénique des reins (pyélonéphrite lymphogénique) est également possible, lorsque le côlon et les organes génitaux sont à l'origine de l'infection. Pour le développement de la pyélonéphrite, en plus de la pénétration de l'infection dans les reins, la réactivité du corps et un certain nombre de causes locales qui provoquent une violation de l'écoulement de l'urine et de la stase urinaire sont d'une grande importance. Les mêmes raisons expliquent la possibilité d'une évolution chronique récurrente de la maladie. Les micro-organismes infectés présentant des modifications fonctionnelles et morphologiques des voies urinaires entraînant une stase urinaire, une altération de l'écoulement veineux et lymphatique du rein, contribuant à la fixation de l'infection dans les reins, provoquent des zones focales et polymorphes d'infiltrats inflammatoires et une suppuration de l'interstitium d'un ou les deux reins. Le tissu interstitiel des tubules est touché, puis les néphrons. Il existe une endartérite productive, une hyperplasie de la coque moyenne des vaisseaux, des phénomènes d'hyalinose, une artériolosclérose se développant jusqu'au rein secondairement ridé. Ces dernières années, un certain rôle dans le développement de la pyélonéphrite chronique est attribué aux réactions auto-immunes: sous l'influence d'antigènes bactériens, l'immunoglobuline G et le complément se déposent sur la membrane basale des capillaires glomérulaires, provoquant ses dommages. Le passage de la pyélonéphrite aiguë à la chronique est facilité par : le diagnostic tardif de la pyélonéphrite aiguë, l'hospitalisation intempestive, la présence d'infections chroniques, le diabète, la goutte, l'abus d'analgésiques - phénacétine. La pyélonéphrite chronique est plus fréquente chez la femme (50%), ce qui est facilité par les grossesses, surtout répétées (les œstrogènes provoquent une atonie des muscles lisses des voies urinaires), dans l'enfance chez les filles, ce qui est lié à la structure des voies urinaires , leurs anomalies. Image clinique. Comme mentionné ci-dessus, une évolution aiguë et chronique de la pyélonéphrite est possible. Le tableau clinique de la phase aiguë de la maladie se caractérise par une augmentation soudaine et brutale de la température corporelle jusqu'à 39-40 ° C, l'apparition d'une faiblesse, des maux de tête, des frissons, associés à une transpiration abondante, des nausées et des vomissements peuvent survenir. Parallèlement à l'augmentation de la température corporelle, des douleurs apparaissent dans la région lombaire, qui, en règle générale, sont notées d'un côté. La nature de la douleur est sourde, leur intensité est différente. Dans le cas du développement de la maladie dans le contexte de la lithiase urinaire, une attaque de pyélonéphrite est précédée d'une attaque de colique néphrétique. En l'absence de traitement adéquat, la maladie peut devenir chronique ou entraîner le développement de processus suppuratifs dans le rein, qui se manifestent cliniquement par une détérioration de l'état général du patient et des fluctuations brusques de température (de 35 à 36 ° C le matin à 40-41°C le soir). La pyélonéphrite chronique est, en règle générale, une conséquence d'une pyélonéphrite aiguë sous-traitée, lorsqu'il était possible d'éliminer l'inflammation aiguë, mais il n'était pas possible de détruire radicalement tous les agents pathogènes du rein ou de rétablir l'écoulement physiologique de l'urine du rein. La pyélonéphrite chronique s'inquiète de douleurs sourdes constantes dans la région lombaire, aggravées par temps froid et humide. En outre, la pyélonéphrite chronique est sujette à des exacerbations périodiques, lorsque le patient présente tous les signes d'un processus aigu. diagnostics. Le problème du diagnostic de la maladie est dû au fait que les symptômes de la pyélonéphrite sont similaires aux symptômes d'autres maladies résultant d'une inflammation des voies urinaires. Le plan d'examen diagnostique comprend des analyses de sang, des analyses d'urine, ainsi que des études montrant l'état du système urinaire: échographie des reins, études aux rayons X, analyse PCR pour un agent infectieux. Pour vérifier le type d'agent infectieux, il est nécessaire de procéder à une culture bactériologique d'un échantillon d'urine, et la méthode de tomodensitométrie est utilisée pour exclure les processus tumoraux. Ainsi, les méthodes de laboratoire et de recherche spéciales sont d'une grande importance pour la reconnaissance de la maladie. Et dans la pyélonéphrite chronique, les manifestations décisives, et parfois les seules, sont des modifications de l'urine, du sang et des voies urinaires. Il est nécessaire de surveiller dynamiquement la pression artérielle et le poids du patient. Leucocytose, augmentation de la VS, déplacement des neutrophiles dans le sang, augmentation du taux d'azote résiduel (norme 20-40 mg), urée (norme 40-60 mg), créatinine (norme 53-106 μmol / l), indican (norme de 1,41, 3,76-180 µmol/l), cholestérol (norme 200-83 mg), chlorures sanguins (norme XNUMX mmol/l). Important pour le diagnostic des modifications de l'urine: diminution de la gravité spécifique, protéinurie (y compris quotidienne), hématurie et cylindrurie. Cependant, les méthodes de détermination quantitative des éléments formés du sédiment urinaire acquièrent une importance diagnostique croissante : Kakovsky-Addis (leucocytes normaux jusqu'à 4 millions de globules rouges - jusqu'à 1 million, cylindres - jusqu'à 2 24 en 2000 heures), Amburger (leucocytes normaux jusqu'à 1400, érythrocytes - jusqu'à 20, cylindres - jusqu'à 1 par minute), Nechiporenko (normalement leucocytes jusqu'à 2500, érythrocytes - jusqu'à 1000, cylindres - jusqu'à 20 dans 1 ml d'urine fraîchement libérée) . Le rapport du nombre absolu d'érythrocytes et de leucocytes dans le sédiment urinaire dans la pyélonéphrite change radicalement vers une prédominance significative des leucocytes de 10 à 20 fois. Dans la pyélonéphrite chronique, des cellules de Stenheimer-Malbin apparaissent dans les urines : gros leucocytes, à mouvement brownien de granules cytoplasmiques, apparaissant avec une diminution des propriétés osmotiques de l'urine (densité inférieure à 10-14), colorés en bleu au violet de gentiane et à la safronine, leucocytes « actifs » : leucocytes altérés, possédant le mouvement brownien du protoplasme, révélés lors d'une coloration avec une solution aqueuse à 1 % de bleu de méthylène additionnée d'eau distillée. La valeur diagnostique d'une augmentation du nombre de leucocytes "actifs" et de cellules de Stenheimer-Malbin (jusqu'à 40%), de bactériurie (numération microbienne supérieure à 100 1 pour 100 ml d'urine), d'un test de nitrite (avec une numération microbienne de plus plus de 4 mille U, les microbes décomposent les nitrites urinaires) sont soulignés. , avec l'ajout d'acide sulfanilique et de L-naphtylamine, une couleur rouge apparaît), un test colorimétrique TTX (sous l'action des déshydrogénases microbiennes, le chlorure de triphényltétrazolyte est réduit en rouge insoluble triphénylformazan dans les 10 à 37 heures à une température de -30 ° C), un test provocateur de prednisolone (le patient recueille dans un plat stérile, la partie médiane de l'urine est le témoin, puis 10 mg de prednisolone dans 24 ml de solution saline est lentement injecté dans la veine et la partie médiane de l'urine est recueillie trois fois à intervalle d'une heure et après XNUMX heures ; dans la pyélonéphrite chronique, le nombre de leucocytes, de bactéries double, des leucocytes "actifs" apparaissent, au moins dans une portion), antibiogrammes. Une attention particulière doit être portée à la microscopie de la tuberculose des reins (microscopie de frottis colorés selon Tsil, ensemencement d'urine sur des supports spéciaux - la méthode de Preis et Shkolnikova, la méthode biologique). Si un processus unilatéral est suspecté, il est nécessaire d'effectuer un test d'urine, prélevé séparément de chaque rein avec des cathéters spéciaux. Les méthodes de recherche radiologique jouent un rôle important dans le diagnostic de la pyélonéphrite chronique: radiographie et tomographie d'enquête (caractérisent la position, la taille et la forme des reins), pyélographie excrétrice et rétrograde (diminution de la concentration et de la capacité excrétrice des reins, spasmes , anomalies, déformations du bassin, calices), pneumopyélographie (pour la reconnaissance des calculs sans contraste), angiographie rénale (révèle une violation de l'architectonique vasculaire - artères et veines). Pour déterminer la sécurité de la fonction et du parenchyme des reins, en particulier avec un processus unilatéral, des méthodes de radioindication sont utilisées - renographie (hippurane iode 131) et scanographie (utilisant du néohydrure Hg 203). La biopsie par ponction dans le cas d'une pyélonéphrite due aux foyers du processus peut ne pas fournir d'informations. La chromocystoscopie peut indiquer des lésions rénales. traitement. Le plus souvent, le traitement de la pyélonéphrite est conservateur. Cependant, si la pyélonéphrite aiguë est purulente, une intervention chirurgicale peut être nécessaire. Le traitement conservateur consiste en un régime, un régime, l’utilisation d’antibiotiques ainsi que divers médicaments qui stabilisent la fonction des reins et du corps du patient dans son ensemble. Dans la pyélonéphrite aiguë, un alitement strict est indiqué. La nourriture doit être des aliments consommés contenant la quantité optimale de protéines, de graisses et de glucides. En période aiguë, il faut alterner aliments protéinés et végétaux. En cas d'intoxication grave, vous devez boire beaucoup d'eau. Le traitement de la pyélonéphrite chronique consiste en l'impact sur l'infection (étiotrope) dans la pyélonéphrite primaire et l'élimination de l'une ou l'autre cause dans la pyélonéphrite secondaire, les mécanismes pathogéniques et le traitement des complications. Le traitement le plus efficace est après détermination de l'antibiogramme. Un traitement continu (au moins 2 mois) avec des médicaments antibactériens est effectué. Dès l'admission, un médicament antibiotique, sulfanilamide ou nitrofurane est prescrit. Après 1 à 10 jours, les médicaments sont changés, le traitement est effectué jusqu'à la disparition persistante de la leucocyturie et de la bactériurie. Dès que l'exacerbation est éliminée, un traitement intermittent avec l'un des agents antibactériens est effectué pendant 4 à 5 mois: le médicament est administré pendant 7 jours, puis une pause est prise pendant 8 à 10 jours, ou le médicament est administré pendant 10 jours avec un intervalle de 15 à 20 jours, ou le médicament est administré pendant 15 jours, l'intervalle est de 15 jours, puis un traitement antimicrobien est à nouveau prescrit. La durée du traitement et les intervalles sont déterminés par les symptômes cliniques et le contrôle de laboratoire. Il convient de souligner qu'en cas de pyélonéphrite qui s'est développée chez un patient atteint d'amygdalite chronique, les antibiotiques de la série des pénicillines sont les plus efficaces ; en cas d'infection des organes génitaux chez l'homme et la femme, des antibiotiques à large spectre sont utilisés (voir Tableau 12). En présence de flore gram-négative, le traitement à l'acide nalidixique donne de bons résultats (noirs, ievigramon - 1,0 g 4 fois par jour pendant 7 jours, mais ses préparations doivent être prescrites moins fréquemment que les autres médicaments (2 fois)). À partir de préparations de sulfanilamide, on utilise de l'étazol (1,0 g 4 fois - 10 jours), du solafur (0,1 g 3 fois), des sulfamides à action prolongée. En outre, les cours sont traités avec de la furazolidone, de la furadonine, de la furagine (0,1 g 4 fois par jour). Il faut souligner que la fonction rénale doit être déterminée avant de commencer le traitement. L'antibiothérapie à long terme doit être effectuée avec un débit de filtration glomérulaire d'au moins 30 ml / min ou avec une teneur en azote résiduel dans le sérum sanguin ne dépassant pas 70 mg. Un indicateur de l'efficacité du médicament après une semaine de traitement est une diminution du nombre de microbes à 10 000 dans 1 ml d'urine. Il est possible de réduire la virulence de la microflore et d'augmenter l'efficacité des agents antibactériens en modifiant la réaction de l'urine tous les 10 à 14 jours. Les aliments alcalinisants, le citrate de sodium (10 g par jour), les eaux minérales alcalines aident à réduire les réactions de pH. Une action antibactérienne a du benzoate de sodium (4-6 g par jour), qui est abondant dans les canneberges et les busseroles. La thérapie pathogénétique doit viser à augmenter la réactivité de l'organisme, à améliorer le débit urinaire et à normaliser la pression artérielle. Pour activer la réactivité immunobiologique, on utilise l'α-globuline, l'autohémothérapie, la transfusion sanguine, la thérapie vaccinale (le traitement par autovaccin est effectué pendant 30 à 40 jours, 0,1 ml par voie sous-cutanée ou 0,2-0,3 ml tous les 2 jours), l'anatoxine staphylococcique ( 0,1-0,3- 0,5-0,7-1,0-1,2-1,7-2,0 ml tous les 3 jours). Les herbes diurétiques (busserole, baies de genévrier, prêle des champs, feuille d'orthosiphon - tisane rénale, feuille d'airelle), les antispasmodiques (papavérine, no-shpa, etc.) aident à normaliser l'écoulement de l'urine. S'il y a une obstruction à l'écoulement de l'urine, un traitement chirurgical est indiqué. Avec l'hypertension concomitante, les préparations de rauwolfia sont indiquées - isobarine, dopegyt, hémiton, salurétiques, antagonistes de l'aldostérone. Prévention et pronostic. La prévention de la pyélonéphrite consiste en des mesures primaires et secondaires. La prévention primaire comprend, tout d'abord, le traitement des maladies pouvant entraîner le développement d'une pyélonéphrite: infections focales, maladies urologiques (telles que lithiase urinaire, adénome de la prostate, ainsi que toute maladie accompagnée d'une violation de l'écoulement de l'urine du rein), activités récréatives. Tableau 12 Efficacité comparée des médicaments antibactériens dans la pyélonéphrite
La prévention secondaire comprend la détection de la bactériurie lors d'examens préventifs (par exemple, les femmes enceintes doivent effectuer une analyse bactériologique des urines au moins une fois par mois), la nomination d'un traitement anti-rechute : la première semaine de chaque mois - une pause dans le traitement : décoction d'églantier, la deuxième, troisième semaine - diurétiques à base de plantes et antiseptiques, la quatrième semaine - agents antibactériens (nitrofuranes, antibiotiques, antiseptiques, une fois par an - névigramon 1 g 1 fois pendant la semaine et 1,0 g - pendant la deuxième semaine, ou 4 -NOC 2-5 mg 100 fois par jour 150-4 jours). Le traitement anti-rechute est effectué pendant 2-3 ans. Les examens de dispensaire avec traitement doivent être effectués 3 à 4 fois par an ou 4 à 6 fois. Prévision. Le pronostic dépend du stade de la maladie. traitement de Spa. Le traitement en sanatorium est indiqué pendant la période de rémission, en particulier pour les patients atteints de pyélonéphrite calculeuse secondaire après des opérations urologiques (eaux minérales Truskavets, Sairme, Zheleznovodsk, Berezovsky), où les patients prennent des eaux faiblement minéralisées. Le traitement en sanatorium et spa est contre-indiqué en cas d'hypertension artérielle élevée, d'anémie sévère et d'insuffisance rénale manifeste. Les complications de la pyélonéphrite sont variées. Dans la pyélonéphrite aiguë, la progression du processus purulent entraîne la fusion de gros abcès et la formation d'un anthrax du rein, la communication de cavités purulentes avec le bassin (pyonéphrose), la transition du processus vers une capsule fibreuse (périnéphrite ) et du tissu périnéphrétique (paranéphrite). La pyélonéphrite aiguë peut être compliquée par une nécrose des papilles des pyramides (papillonekrosis), qui se développe à la suite de l'effet toxique direct des bactéries dans des conditions de stase urinaire. Cette complication de la pyélonéphrite survient dans la plupart des cas chez les patients diabétiques. Rarement, la pyélonéphrite devient une source de septicémie. Avec la restriction du processus purulent pendant la période de cicatrisation, des abcès entourés d'une membrane pyogénique (abcès rénal chronique) peuvent se former. Dans la pyélonéphrite chronique, en particulier unilatérale, il est possible de développer une hypertension néphrogénique et une artériolosclérose dans le deuxième rein (intact). Les rides pyélonéphritiques bilatérales des reins entraînent une insuffisance rénale chronique. Le résultat de la pyélonéphrite aiguë est généralement la guérison, mais à la suite de complications (pyonéphrose, septicémie, papilonécrose), la mort peut survenir. La pyélonéphrite chronique avec plissement des reins se termine souvent par une urémie urémique. Avec le développement de l'hypertension artérielle d'origine rénale, l'issue létale de la pyélonéphrite chronique est parfois associée aux complications qui surviennent dans l'hypertension (hémorragie cérébrale, infarctus du myocarde, etc.). Auteur : Mostovaya O.S.
▪ Sociologie générale. Notes de lecture ▪ Théorie du gouvernement et des droits. Notes de lecture ▪ Avocats et notaires. Notes de lecture
L'existence d'une règle d'entropie pour l'intrication quantique a été prouvée
09.05.2024 Mini climatiseur Sony Reon Pocket 5
09.05.2024 L'énergie de l'espace pour Starship
08.05.2024
▪ Mesuré le champ magnétique d'un trou noir au centre de la galaxie ▪ Tesla Rodster amènera des bactéries terrestres sur Mars ▪ L'épaisseur du smartphone Gionee GN9005 - 5 mm ▪ La nouvelle architecture de Fujitsu accélérera les PC de 10 000 fois
▪ section du site Constructeur, maître de maison. Sélection d'articles ▪ article Caftan Trishkin. Expression populaire ▪ article Quand sont apparus les premiers acrobates ? Réponse détaillée ▪ article 4 cartes et 4 pièces. Concentration secrète
Page principale | bibliothèque | Articles | Plan du site | Avis sur le site www.diagramme.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








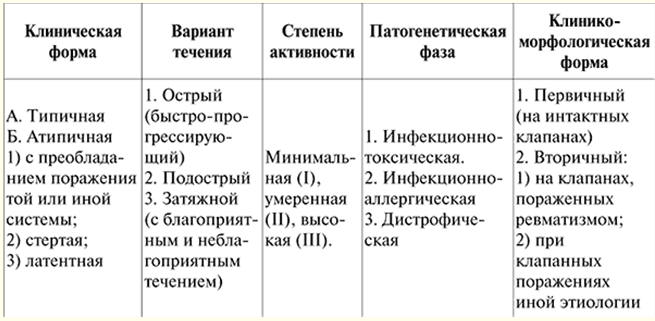








 Voir d'autres articles section
Voir d'autres articles section 