
|
Notes de cours, aide-mémoire
Anesthésiologie et réanimation. Aide-mémoire : brièvement, le plus important
Annuaire / Notes de cours, aide-mémoire table des matières
1. Le concept de réanimation La réanimation est une branche de la médecine clinique qui étudie les problèmes de réanimation du corps, développe des principes de prévention des affections terminales, des méthodes de réanimation et des soins intensifs. Les méthodes pratiques de revitalisation du corps sont unies par le concept de "réanimation". La réanimation (du latin "réveil" ou "animation") est un système de mesures visant à restaurer les fonctions vitales du corps fortement altérées ou perdues et à le sortir d'un état terminal et d'une mort clinique. Les mesures de réanimation efficaces sont le massage cardiaque indirect et la ventilation artificielle des poumons. S'ils sont inefficaces dans les 30 minutes, la mort biologique est constatée. Les soins intensifs sont un ensemble de mesures utilisées pour traiter des affections graves mettant la vie en danger et impliquent l'utilisation d'un large éventail de mesures thérapeutiques, selon les indications, y compris les perfusions intraveineuses, la ventilation mécanique prolongée, la stimulation électrique, les méthodes de dialyse, etc. Un état critique est l'impossibilité de maintenir l'intégrité des fonctions corporelles à la suite d'un dysfonctionnement aigu d'un organe ou d'un système, nécessitant un remplacement médicamenteux ou matériel-instrumental. L'état terminal est un état limite entre la vie et la mort, une extinction réversible des fonctions corporelles, y compris les stades de la préagonie, de l'agonie et de la mort clinique. La mort clinique est un état terminal dans lequel il n'y a pas de circulation sanguine et de respiration, l'activité du cortex cérébral s'arrête, mais les processus métaboliques sont préservés. Avec la mort clinique, la possibilité d'une réanimation efficace demeure. La durée de la mort clinique est de 5 à 6 minutes. La mort biologique est une cessation irréversible des processus physiologiques dans les organes et les tissus, dans laquelle la réanimation est impossible. Elle est établie par l'association de plusieurs signes : l'absence de mouvements spontanés, les contractions du cœur et du pouls sur les grosses artères, la respiration, les réactions aux stimuli douloureux, le réflexe cornéen, la dilatation maximale des pupilles et l'absence de leur réaction à la lumière. Les signes fiables du début de la mort sont une diminution de la température corporelle à 20 ° C, l'apparition de taches cadavériques et la rigidité cadavérique musculaire. 2. Manipulations de base en réanimation Ponction percutanée et cathétérisme de la veine principale (sous-clavière). Indications : gros volumes de perfusion-transfusion, nutrition parentérale, thérapie de désintoxication, antibiothérapie intraveineuse, sondage et contraste du cœur, mesure de la CVP, implantation d'un stimulateur cardiaque, impossibilité de cathétérisme des veines périphériques. Contre-indications: violation du système de coagulation sanguine, processus inflammatoire et purulent au site de ponction et de cathétérisme, traumatisme de la clavicule, syndrome de la veine cave supérieure, syndrome de Paget-Schretter. Instrumentation et accessoires pour ponction et cathétérisme : aiguille de ponction, un ensemble de cathéters en plastique, un ensemble de conducteurs, une seringue de 10 ml pour les injections intramusculaires, des ciseaux, un porte-aiguille, une aiguille chirurgicale et une ligature en soie, un pansement adhésif. Technique: le cathétérisme est effectué dans le respect des règles d'asepsie et d'antisepsie, du traitement des mains de l'opérateur, du champ opératoire et de l'emballage avec du matériel stérile. La position du patient est horizontale sur le dos avec les bras ramenés au corps et le revers de la tête dans le sens opposé. L'anesthésie locale est utilisée - solution de novocaïne à 0,5-1%. La ponction se fait mieux à droite, car lors de la ponction de la veine sous-clavière gauche, il existe un risque d'endommager le canal lymphatique thoracique. Point de ponction - sur le bord du tiers interne et moyen de la clavicule à 2 cm en dessous. L'aiguille est passée lentement à un angle de 45 par rapport à la clavicule et de 30 à 40 par rapport à la surface de la poitrine entre la clavicule et la 15ère côte en direction du bord supérieur de l'articulation sternoclaviculaire. Lors du passage de l'aiguille, le piston de la seringue est périodiquement serré pour déterminer s'il pénètre dans la veine, et la novocaïne est injectée le long de l'aiguille. Lors du perçage d'une veine, il y a parfois un sentiment d'échec. Après avoir pénétré dans la veine, la seringue est déconnectée de l'aiguille et la canule est fermée avec un doigt. Ensuite, un conducteur est inséré à travers l'aiguille sur une longueur de 20 à 6 cm et l'aiguille est retirée. Un cathéter du diamètre approprié est passé à travers le conducteur et, avec le conducteur, est inséré dans la veine de 8 à 2 cm, après quoi le conducteur est soigneusement retiré. Pour vérifier la position correcte du cathéter, une seringue y est fixée et 3 à 3 ml de sang y sont aspirés, après quoi un bouchon est placé ou un traitement par perfusion est démarré. Le cathéter est fixé avec une ligature en soie à la peau. Pour ce faire, un manchon de pansement adhésif est fabriqué sur le cathéter à 5-XNUMX mm de la peau, sur lequel la soie est nouée, puis passée à travers les oreilles du cathéter et nouée à nouveau. Après avoir fixé le cathéter, le site de ponction est fermé avec un autocollant aseptique. Complications: ponction de l'artère sous-clavière, embolie gazeuse, ponction de la cavité pleurale, lésion du plexus brachial, lésion du canal lymphatique thoracique, lésion de la trachée, du goitre et de la glande thyroïde, suppuration au site de ponction. 3. Trachéotomie. Conicostomie Trachéotomie Indications : obstruction du larynx et de la trachée supérieure due à une obstruction par une tumeur ou un corps étranger, paralysie et spasme des cordes vocales, gonflement sévère du larynx, détresse respiratoire aiguë, aspiration de vomi, prévention de l'asphyxie en cas de traumatisme thoracique grave. Outils : 2 scalpels, 2 pinces anatomiques et chirurgicales, plusieurs pinces hémostatiques, un élévateur, une sonde cannelée, 2 mousses et 1 crochet pointu à une dent, dilatateur Trousseau ou Deschamps, aiguilles chirurgicales avec porte-aiguille. Technique. Le patient est allongé sur le dos, un rouleau sous les épaules, la tête est renversée. Si le patient est en état d'asphyxie, le rouleau n'est posé qu'au dernier moment, avant l'ouverture de la trachée. L'anesthésie par infiltration locale est réalisée avec une solution à 0,5-1% de novocaïne additionnée d'adrénaline. Dans l'asphyxie aiguë, il est possible d'opérer sans anesthésie. Points d'identification : l'angle du cartilage thyroïde et le tubercule de l'arc du cartilage cricoïde. Une incision de la peau, du tissu sous-cutané et du fascia superficiel est pratiquée du bord inférieur du cartilage thyroïde à l'encoche jugulaire strictement le long de la ligne médiane du cou. La veine médiane du cou est rétractée ou ligaturée, trouvant une ligne blanche, le long de laquelle les muscles sont écartés de manière brutale et l'isthme de la glande thyroïde est exposé. Les bords de l'incision sont écartés à l'aide d'un dilatateur de Trousseau, des ligatures sont appliquées sur le bord de la plaie et la canule de trachéotomie est soigneusement insérée en veillant à ce que son extrémité pénètre dans la lumière de la trachée. La plaie chirurgicale est suturée. Le tube est fixé sur le cou du patient à l'aide d'une attelle de gaze, préalablement attachée à la protection du tube. Insérez le tube interne dans le tube externe. Conicostomie Le patient est placé sur le dos avec un rouleau transversal au niveau des omoplates. La tête du patient est inclinée vers l'arrière. Le larynx est fixé avec les doigts sur les surfaces latérales du cartilage thyroïde et l'écart entre le cartilage thyroïde et cricoïde est ressenti, là où se trouve le ligament en forme de cône. Sous anesthésie locale par infiltration au scalpel pointu, une incision cutanée transversale d'environ 2 cm de long est pratiquée, le ligament en forme de cône est palpé et disséqué ou perforé. Toute canule de trachéotomie de diamètre approprié est insérée dans le trou formé et fixée avec une bande de gaze autour du cou. En l'absence de canule, celle-ci peut être remplacée par un morceau de tube en caoutchouc ou en plastique de diamètre et de longueur appropriés. Pour éviter que ce tube ne glisse dans la trachée, son extrémité externe est percée transversalement à une distance de 2 cm du bord et fixée avec une bande de gaze. Le conicotome est une canule de trachéotomie en métal de petit diamètre avec un mandrin de perçage à l'intérieur. Après dissection de la peau au-dessus du ligament en forme de cône, celui-ci est percé avec un conicotome, le mandrin est retiré et la canule est placée dans une position qui assure la libre circulation de l'air dans la trachée et fixée. 4. Intubation trachéale Indications: rétrécissement du larynx, respiration pathologique, insuffisance respiratoire aiguë, degré coma II et III, risque élevé d'aspiration lors d'interventions chirurgicales sur les organes de la poitrine et de la cavité abdominale, de la tête et du cou, dans les maladies du pharynx, du larynx et de la trachée (inflammation aiguë, cancer, tuberculose, etc.). Un laryngoscope est utilisé pour l'intubation. Il se compose d'un manche et d'une lame. Les lames courbes les plus utilisées, car plus physiologiques. Les lames droites sont utilisées avec un long cou. La préparation à l'intubation comprend la vérification de l'équipement et le positionnement correct du patient. Le tube endotrachéal doit être vérifié. Le brassard est testé en le gonflant avec une seringue de 10 ml. Vérifier le contact de la lame avec le manche du laryngoscope et l'ampoule. Il est nécessaire de s'assurer que l'aspiration est prête en cas d'expectoration soudaine, de saignement ou de vomissement. Une intubation réussie dépend de la position correcte du patient. La tête du patient doit être au niveau du processus xiphoïde de l'intubateur. Une élévation modérée de la tête avec une extension simultanée au niveau de l'articulation atlanto-occipitale crée une meilleure position pour l'intubation. La préparation à l'intubation comprend également une pré-oxygénation obligatoire. Le laryngoscope est tenu dans la main non dominante (pour la plupart des gens, c'est la gauche) et la bouche du patient est grande ouverte avec l'autre main. La lame est insérée le long du côté droit de l'oropharynx, évitant d'endommager les dents. La langue est décalée vers la gauche et la lame est relevée jusqu'à l'arc du pharynx. La pointe d'une lame courbe est insérée dans la vallécule (une fosse située sur la face antérieure de l'épiglotte), tandis que la pointe d'une lame droite doit soulever l'épiglotte directement. La poignée du laryngoscope est poussée vers le haut et vers l'avant perpendiculairement à la mandibule jusqu'à ce que les cordes vocales soient visibles. Il faut éviter de se fier aux dents. Le tube endotrachéal est pris dans la main droite et passé à travers la glotte ouverte sous contrôle visuel. Le brassard doit être placé dans la trachée supérieure, mais sous le larynx. Le laryngoscope est retiré de la bouche, évitant à nouveau d'endommager les dents. Immédiatement après l'intubation, l'auscultation est effectuée sur les poumons des deux côtés (puisqu'il est possible de passer un tube dans une bronche) et dans l'épigastre (pour exclure l'intubation œsophagienne). Si le tube est dans la trachée, il est fixé en position avec des rubans et le brassard est gonflé. Le brassard doit être placé au-dessus du niveau du cartilage cricoïde, car son maintien prolongé dans le larynx peut entraîner un enrouement dans la période postopératoire. Complications : intubation de l'œsophage, des bronches, localisation de la manchette dans le larynx, atteinte des dents, luxation de la mâchoire inférieure, laryngospasme, troubles réflexes (hypertension, tachycardie, augmentation de la pression intracrânienne), atteinte des voies respiratoires, inflammation, etc. 5. Ponction et cathétérisme de l'espace épidural Indications : syndrome douloureux sévère, interventions chirurgicales, fournissant une analgésie postopératoire. Le niveau de réglage du bloc péridural dépend de l'organe qui doit être anesthésié. Niveaux de la colonne vertébrale et "organes cibles" en anesthésie péridurale
Instrumentation: aiguilles pour anesthésie, une aiguille spéciale pour percer l'espace épidural, une seringue à échantillon, un cathéter, un bouchon, des balles filtrantes, des serviettes, du ruban adhésif et des gants stériles. La position du patient est assise ou couchée sur le côté. Dans ce cas, les genoux et le menton doivent être rapprochés le plus possible de la poitrine. Ainsi, une flexion maximale de la colonne vertébrale est créée, à laquelle l'angle entre les apophyses épineuses des vertèbres adjacentes augmente et l'approche du ligament jaune est facilitée. Dans des conditions aseptiques et sous anesthésie locale avec une solution de novocaïne à 0,5%, une ponction de l'espace épidural est réalisée. L'aiguille est injectée strictement perpendiculairement, mais avec l'ostéochondrose, un angle d'inclinaison est possible ou lors de la ponction dans la région mi-thoracique. Lorsque l'aiguille pénètre dans l'épaisseur des ligaments, le mandrin en est retiré et une seringue contenant du liquide est attachée. L'avancement ultérieur de l'aiguille est effectué lentement et en douceur avec une pression sur le piston de la seringue. En raison de la résistance importante des ligaments, le liquide ne peut pas sortir de la seringue. La seringue est déconnectée et le cathéter est inséré 5-7 cm, il ne devrait y avoir aucune résistance. L'aiguille est retirée et le fil de guidage est fixé au dos avec un pansement adhésif, l'amenant à la surface avant de la poitrine. La fiche avec le filtre est fixée au conducteur. Un anesthésique est injecté. Après cela, le niveau d'anesthésie cutanée est déterminé. Complications : troubles respiratoires et hémodynamiques, intoxication, atteinte de la dure-mère, complications neurologiques, péridurite. 6. Troubles aigus de la conscience La conscience est la forme la plus élevée de reflet de la réalité, qui est un ensemble de processus mentaux qui permettent à une personne de naviguer dans le monde qui l'entoure, le temps, sa propre personnalité, qui assure son comportement. L'altération de la conscience est le nom général des troubles de l'activité intégrale du cerveau, exprimée par une violation de la capacité de percevoir, de comprendre et de réagir de manière adéquate à l'environnement, de le naviguer, de se souvenir des événements actuels, d'établir un contact vocal et d'effectuer des expédients arbitraires. actes comportementaux. Il existe diverses options pour la dépression de la conscience (stupeur, stupeur, coma plus ou moins profond), ainsi que pour la confusion aiguë (état délirant ou encéphalopathie métabolique). Le degré d'altération de la conscience varie d'une légère confusion au coma, et il n'y a pas de transitions claires entre ces états. En pratique, le degré d'altération de la conscience est déterminé par la réaction du patient aux stimuli. La stupéfaction est une forme d'altération de la conscience, caractérisée par une léthargie, un ralentissement et une difficulté au cours des processus mentaux, un épuisement rapide de l'attention, une augmentation du seuil de perception des stimuli externes, mais tout en maintenant un contact verbal limité. La stupéfaction est basée sur une violation de l'attention, c'est-à-dire la capacité de sélectionner les informations nécessaires et de coordonner les réponses de manière à ce que la séquence logique des pensées et des actions ne soit pas violée. Les causes les plus fréquentes de stupeur sont des troubles métaboliques et toxiques, mais parfois on l'observe également dans des lésions focales du cortex, en particulier du lobe pariétal droit. Chez ces patients, il est possible d'obtenir une réponse monosyllabique ou la mise en œuvre des instructions les plus simples uniquement après des appels persistants ou une stimulation supplémentaire. Avec une oppression supplémentaire de la conscience, la possibilité d'un contact avec la parole est perdue et le sopor se développe. Sopor est un état de dépression profonde de la conscience avec la perte de la possibilité de contact avec le patient, mais la préservation des réactions protectrices coordonnées et l'ouverture des yeux du patient en réponse à la douleur, au son ou à d'autres stimuli. Le patient ne peut pas être complètement réveillé même à l'aide de stimuli douloureux, il est allongé les yeux fermés. La réaction aux instructions verbales est faible ou complètement absente, il est impossible d'obtenir un mot ou un son de réponse du patient. Avec une oppression supplémentaire de la conscience, un coma se développe. Le coma est un état inconscient caractérisé par une insensibilité aux stimuli externes. Il s'agit d'un état potentiellement mortel de dépression des fonctions du système nerveux central et de troubles de la régulation des fonctions vitales. Le coma peut être causé par de nombreux troubles métaboliques différents et des dommages structurels. 7. Examen d'un patient dans le coma Le plan d'examen du patient est le suivant. 1. Évaluation de l'état fonctionnel des systèmes respiratoire et cardiovasculaire. 2. Examens cliniques généraux, prenant en compte les données de laboratoire, permettant d'évaluer la pathologie extracrânienne. 3. Examen neurologique. Études de laboratoire : test sanguin clinique général (signes d'une infection bactérienne ou virale) ; chimie sanguine : glucose, facteurs de coagulation (temps de coagulation, prothrombine, fibrinogène, APTT, antithrombine III, tests de paracoagulation, numération plaquettaire), urée, créatinine, bilirubine, ALT, AST, osmolarité, électrolytes (K, Na, Mg, Ca) ; dépistage toxicologique du sang, de l'urine, du contenu gastrique. Études instrumentales : radiographie du crâne et du rachis cervical. La consultation d'un neuropathologiste (neurochirurgien) détermine la direction ultérieure de la recherche diagnostique: imagerie par résonance magnétique ou calculée; EEG ; dopplerographie échographique. La ponction lombaire avec analyse du liquide céphalo-rachidien est obligatoire après : 1) consultation d'un ophtalmologiste et exclusion des signes d'augmentation de la pression intracrânienne - œdème et élévation des disques optiques ; 2) exclusion des signes de hernie du cerveau. Les localisations suivantes de la hernie du cerveau sont distinguées. Hernie diencéphalique, qui survient lorsque la localisation supratentorielle médiale est endommagée et consiste en le déplacement du diencéphale à travers l'encoche du tenon cérébelleux. Ce processus appelle : 1) Respiration de Cheyne-Stokes ; 2) constriction des pupilles tout en maintenant leur réaction à la lumière ; 3) paralysie du regard vers le haut ; 4) changements dans l'état mental. La hernie des parties médiales du lobe temporal, qui survient lorsque la localisation supratentorielle latérale est atteinte, consiste en le déplacement des parties médiales du lobe temporal à travers l'échancrure du tenon cérébelleux. La pression qui en résulte sur les structures du mésencéphale se manifeste par : 1) altération de la conscience ; 2) une pupille agrandie et non réactive du côté de la hernie, qui est associée à une compression du nerf crânien III ; 3) hémiparésie du côté opposé. Les mouvements des globes oculaires ne sont pas toujours perturbés. Hernie des amygdales du cervelet, qui est causée par une pression poussant la partie inférieure du cervelet à travers le foramen magnum, ce qui entraîne une compression de la moelle allongée. Cela implique: 1) altération de la conscience ; 2) violations du rythme respiratoire ou apnée. 8. Traitement du coma Le traitement doit être aussi agressif que possible et viser principalement à assurer une oxygénation adéquate et la stabilisation de l'hémodynamique centrale. Si la respiration spontanée est maintenue, une insufflation d'oxygène humidifié à travers un masque ou un cathéter nasal est recommandée. En l'absence de respiration spontanée ou en présence de respiration pathologique, une intubation trachéale est réalisée et le patient est transféré en ventilation pulmonaire artificielle. En cas d'agitation psychomotrice et de réaction à la ventilation mécanique, l'utilisation de sédatifs (benzodiazépines, butyrophénones) est nécessaire. La stabilisation de l'hémodynamique centrale est la normalisation de la pression artérielle. Dans un état hypertendu, la pression artérielle doit être réduite, mais pas plus de 10% de l'original par heure. Un bon effet est l'utilisation de nitroprussiate de sodium ou de sulfate de magnésium. Avec l'hypotension, la dopamine, la dopamine, le dobutrex et les médicaments hormonaux sont utilisés. En l'absence de données anamnestiques et d'un diagnostic peu clair, une thérapie exjuvantibus est réalisée (une réponse positive à l'exposition au médicament, d'une part, donne la clé du diagnostic, d'autre part, elle aide à gagner du temps pour éviter des changements irréversibles) : 1) thiamine - 100 mg par voie intraveineuse, puis - 100 mg par voie intramusculaire (surtout en cas d'antécédents d'alcoolisme, lors de la détermination de concentrations élevées d'éthanol dans le sang); 2) glucose - une solution à 40% de 60 ml par voie intraveineuse (avec un taux de glucose plasmatique inconnu ou à un taux inférieur à 3 mmol / l); 3) naloxone - 0,4-1,2 mg par voie intraveineuse, fractionnée, répétée, en particulier en présence de "signes opiacés" (traces d'injections intraveineuses, pupilles étroites, troubles respiratoires centraux); 4) anexat (flumazénil) - 0,2 mg pendant 30 secondes, au cours de la minute suivante, injecter 0,3 mg supplémentaire, au cours de chaque minute suivante - 0,5 mg jusqu'à une dose totale de 3 mg. En l'absence d'effet, on peut supposer que le coma est peu susceptible d'être causé par des médicaments à base de benzodiazépines ; 5) en cas d'empoisonnement ou de surdosage avec un médicament ou une substance connue, il est nécessaire d'administrer l'antidote approprié (s'il existe une possibilité de traitement antidote). Le traitement s'effectue : 1) contrôle du syndrome convulsif ; 2) maintien de la normothermie ; 3) prévention de l'aspiration du contenu gastrique; 4) traitement urologique ; 5) diminution de la pression intracrânienne. 9. Réanimation cardiorespiratoire La réanimation cardiorespiratoire (RCP) est un ensemble de mesures chirurgicales et thérapeutiques effectuées en l'absence de blessures potentiellement mortelles et visant à restaurer et à soutenir la fonction du système cardiorespiratoire. Indications de la réanimation cardiopulmonaire : réalisée chez des patients sans pouls efficace sur les artères carotides ou pouls filiforme, faible, inconscients et (ou) en l'absence de mouvements respiratoires efficaces. Les cas les plus courants d'arrêt cardiaque primaire, ainsi que d'insuffisance respiratoire primaire. Contre-indications : traumatismes incompatibles avec la vie, stades terminaux de maladies incurables et mort biologique. Les principes de base Les efforts principaux en RCR visent à : 1) compression thoracique ; 2) soufflage d'air dans les poumons et ventilation ; 3) préparation et administration de médicaments; 4) installation et entretien de l'accès intraveineux ; 5) activités spécialisées (défibrillation, pose de stimulateur cardiaque, intubation trachéale). Ainsi, pour compléter l'ensemble des activités, 4 personnes et un chef d'équipe sont nécessaires. Une personne devrait être en charge de la RCR. Cette personne doit intégrer toutes les informations disponibles et hiérarchiser l'impact. Il doit surveiller le moniteur ECG, l'utilisation de médicaments et s'assurer que les actions des autres membres de l'équipe sont corrigées. Il devrait être retiré de l'exécution des procédures qui nuisent au rôle de leadership. Depuis plus de 40 ans, l'alphabet de réanimation Safar est utilisé pour la RCP. Dans ce complexe, la séquence d'actions du réanimateur est maintenue; selon leur nom anglais, ils sont indiqués par les lettres correspondantes. A - Voies respiratoires - assurer la perméabilité des voies respiratoires. B - Respiration - ventilation pulmonaire artificielle (ALV) de manière accessible, par exemple lors de la respiration "bouche à bouche". C - Circulation - assurer l'hémocirculation - massage cardiaque indirect. D - Drogues - l'introduction de drogues. E - Électrocardiographie - Enregistrement ECG. F - Fibrilation - effectuer, si nécessaire, une défibrillation électrique (cardioversion). G - Jaugeage - évaluation des résultats primaires. H - Hypothermie - refroidissement de la tête. I - Soins intensifs - soins intensifs pour les syndromes post-réanimation. 10. Assurer la perméabilité des voies respiratoires. LIV A - Voies respiratoires - gestion des voies respiratoires Le patient est placé horizontalement sur le dos. La tête est rejetée en arrière autant que possible. Si un patient dont le tonus musculaire est réduit est allongé sur le dos, sa langue peut couler, comme si elle remplissait la gorge. Dans le même temps, l'épiglotte descend, bloquant davantage les voies respiratoires. Apparaissent : respiration sonore, puis violations du rythme respiratoire jusqu'à son arrêt complet. De tels phénomènes se développent particulièrement rapidement chez les patients inconscients. Pour prévenir et éliminer la rétraction de la langue, la mâchoire inférieure doit être avancée et en même temps une hyperextension de l'articulation occipito-cervicale doit être réalisée. Pour ce faire, avec la pression des pouces sur le menton, la mâchoire inférieure du patient est décalée vers le bas, puis avec les doigts placés aux coins de la mâchoire, ils la poussent vers l'avant, complétant cette technique par une surextension de la tête à l'envers (technique triple Safar). Avec la conduite correcte et opportune de ces manipulations, la perméabilité des voies respiratoires au niveau du pharynx est rapidement restaurée. La cause de l'obstruction des voies respiratoires peut être un corps étranger. Ils sont rapidement enlevés avec tout matériel improvisé (serviette). La tête du patient doit être tournée sur le côté en raison du risque d'aspiration. La restauration de la perméabilité des voies respiratoires supérieures est facilitée par l'utilisation de divers conduits d'air. Le plus pratique est l'utilisation d'un conduit d'air en forme de S. Pour son introduction, la bouche du patient est ouverte avec les doigts croisés II et I, et le tube est avancé jusqu'à la racine de la langue afin que son ouverture "glisse" le long du palais. Il faut veiller à ce que le conduit d'air ne bouge pas pendant le transport. Si toutes les procédures décrites ne sont pas efficaces, nous pouvons supposer la présence d'une obturation des voies respiratoires dans les sections sous-jacentes. Dans ces cas, une laryngoscopie directe et une aspiration active des sécrétions pathologiques sont nécessaires, suivies d'une intubation trachéale pendant 10 à 15 secondes. Il est conseillé de réaliser une conicotomie et une trachéotomie. B - Respiration - ventilation pulmonaire artificielle (ALV) de manière accessible La méthode la plus simple et la plus efficace de respiration artificielle lors de la réanimation est la méthode du bouche à bouche. Après 2-3 gonflages des poumons, la présence d'une impulsion sur l'artère carotide est déterminée, si elle n'est pas détectée, ils procèdent alors à une restauration artificielle de la circulation sanguine. La ventilation manuelle est utilisée à l'aide d'un sac auto-expansible de type Ambu. Lors de l'utilisation d'un ventilateur, la fréquence respiratoire est de 12 à 15 par minute, le volume inspiratoire est de 0,5 à 1,0 litre. Dans un hôpital, une intubation trachéale est effectuée et le patient est transféré vers un ventilateur. 11. Massage cardiaque indirect C-Circulation - assurer l'hémocirculation - compressions thoraciques Le massage à cœur fermé est le moyen le plus simple et le plus efficace d'assistance circulatoire artificielle d'urgence. Le massage à cœur fermé doit être commencé immédiatement, dès que le diagnostic d'arrêt circulatoire aigu est posé, sans en préciser les causes et les mécanismes. En cas de contractions cardiaques inefficaces, il ne faut pas attendre un arrêt cardiaque complet ou une restauration indépendante d'une activité cardiaque adéquate. Règles de base pour le massage à cœur fermé. 1. Le patient doit être en position horizontale sur une base solide (sol ou canapé bas) pour éviter la possibilité de déplacement de son corps sous le renforcement des mains massantes. 2. La zone d'application de la force des mains du réanimateur est située sur le tiers inférieur du sternum, strictement le long de la ligne médiane; le réanimateur peut être de chaque côté du patient. 3. Pour le massage, une paume est placée sur l'autre et une pression est appliquée sur le sternum dans la zone située 3-4 doigts transversaux au-dessus du lieu de fixation au sternum du processus xiphoïde; les mains du masseur, redressées au niveau des articulations du coude, sont positionnées de manière à ce que seul le poignet produise une pression. 4. La compression de la poitrine de la victime est effectuée en raison de la gravité du torse du médecin. Le déplacement du sternum vers la colonne vertébrale (c'est-à-dire la profondeur de la déviation de la poitrine) doit être de 4 à 6 cm. 5. La durée d'une compression thoracique est de 0,5 s, l'intervalle entre les compressions individuelles est de 0,5 à 1 s. Taux de massage - 60 mouvements de massage par minute. Par intervalles, les mains ne sont pas retirées du sternum, les doigts restent levés, les bras sont complètement étendus au niveau des articulations du coude. Lorsque la réanimation est effectuée par une seule personne, après deux injections rapides d'air dans les poumons du patient, 15 compressions thoraciques sont effectuées, c'est-à-dire que le rapport "ventilation: massage" est de 2 : 15. Si 2 personnes participent à la réanimation, alors ce rapport est de 1: 5, c'est-à-dire qu'il y a 5 compressions thoraciques par respiration. Une condition préalable au massage cardiaque est la surveillance constante de son efficacité. Les critères d'efficacité du massage doivent être considérés comme suit. 1. Modification de la couleur de la peau : elle devient moins pâle, grise, cyanosée. 2° Constriction des pupilles, si elles étaient dilatées, avec apparition d'une réaction à la lumière. 3. L'apparition d'un pouls sur les artères carotide et fémorale, et parfois sur l'artère radiale. 4. Détermination de la pression artérielle au niveau de 60-70 mm Hg. Art. lorsqu'il est mesuré à l'épaule. 5. Parfois, l'apparition de mouvements respiratoires indépendants. 12. L'introduction de drogues. Enregistrement ECG D - Drogues - l'introduction de drogues. En cas d'arrêt aigu de la circulation sanguine, l'introduction d'agents stimulant l'activité cardiaque doit commencer le plus tôt possible, si nécessaire, être répétée lors de la réanimation. Après le début du massage cardiaque, 0,5 à 1 ml d'adrénaline doivent être administrés dès que possible (par voie intraveineuse ou intratrachéale). Ses introductions répétées sont possibles après 2-5 minutes (jusqu'à 5-6 ml au total). Avec l'asystole, l'adrénaline tonifie le myocarde et aide à "démarrer" le cœur, avec la fibrillation ventriculaire, elle contribue à la transition de la fibrillation à petites ondes vers les grandes ondes, ce qui facilite grandement la défibrillation. L'adrénaline facilite le flux sanguin coronaire et augmente la contractilité du muscle cardiaque. Au lieu de l'épinéphrine, l'isodrine peut être utilisée, ce qui est 3 fois plus efficace que l'adrénaline en termes d'efficacité de l'effet sur le myocarde. La dose initiale est de 1 à 2 ml par injection intraveineuse, puis de 1 à 2 ml dans 250 ml d'une solution de glucose à 5 %. Dans des conditions de circulation altérée, l'acidose métabolique augmente progressivement, par conséquent, immédiatement après la perfusion d'adrénaline, une solution à 4-5% de bicarbonate de sodium est administrée par voie intraveineuse à raison de 3 ml / kg de poids corporel du patient. En train de mourir, le tonus du système nerveux parasympathique augmente considérablement, le cerveau est épuisé, par conséquent, les M-cholinolytiques sont utilisés. En cas d'asystole et de bradycardie, l'atropine est administrée par voie intraveineuse dans une solution à 0,1% - 0,5-1 ml, jusqu'à une dose maximale de 3-4 ml. Pour augmenter le tonus myocardique et réduire l'effet de l'hyperkaliémie, l'administration intraveineuse de 5 ml d'une solution à 10% de chlorure de calcium est recommandée. L'adrénaline, l'atropine et le chlorure de calcium peuvent être administrés ensemble dans la même seringue. Avec une tachycardie sévère et surtout avec le développement d'une fibrillation, l'utilisation de lidocaïne à une dose de 60 à 80 mg est indiquée, mais comme elle est à courte durée d'action, elle est perfusée à un débit de 2 mg/min. Il est également indiqué d'utiliser des glucocorticoïdes qui, en augmentant la sensibilité des structures myocardiques adrénoréactives aux catécholamines et en normalisant la perméabilité des membranes cellulaires, contribuent à la restauration d'une activité cardiaque adéquate. E - Électrocardiographie - Enregistrement ECG À l'aide d'une étude ECG, la nature de la violation de l'activité cardiaque est déterminée. Le plus souvent, il peut s'agir d'asystole - arrêt complet des contractions cardiaques, fibrillation - contraction chaotique non coordonnée des fibres myocardiques avec une fréquence de 400 à 500 battements / min, dans laquelle le débit cardiaque s'arrête pratiquement. On note initialement une fibrillation à grandes ondes qui, en 1 à 2 minutes, passe à une fibrillation à petites ondes, suivie d'une asystole. La présence de tout rythme sur l'ECG est meilleure que l'absence totale d'activité électrique du myocarde. Par conséquent, la tâche clé de la RCP est de stimuler l'activité électrique du myocarde et de la modifier ensuite en un rythme efficace (présence d'un pouls). 13. Défibrillation électrique F - Fibrilation - réalisation, si nécessaire, d'une défibrillation électrique (cardioversion) La fibrillation cardiaque peut être éliminée par l'utilisation de la défibrillation électrique. Il est nécessaire d'appliquer étroitement les électrodes sur la poitrine (en position antérolatérale, une électrode est située dans la région de l'apex du cœur, la seconde dans la région sous-clavière à droite du sternum), ce qui augmente la force du décharge et, par conséquent, l'efficacité de la défibrillation. Chez un certain nombre de patients, la position antéropostérieure (apex du cœur - espace interscapulaire) des électrodes est plus efficace. N'appliquez pas d'électrodes sur les recouvrements du moniteur ECG. Il convient de noter que la défibrillation électrique n'est efficace que lorsque des oscillations de grande onde d'une amplitude de 0,5 à 1 mV ou plus sont enregistrées sur l'ECG. Ce type de fibrillation myocardique indique la sécurité de ses ressources énergétiques et la possibilité de rétablir une activité cardiaque adéquate. Si les oscillations sont faibles, arythmiques et polymorphes, ce qui est observé dans l'hypoxie myocardique sévère, la possibilité de rétablir l'activité cardiaque après la défibrillation est minime. Dans ce cas, à l'aide d'un massage cardiaque, d'une ventilation mécanique, d'une administration intraveineuse d'adrénaline, d'atropine, de chlorure de calcium, il est nécessaire de réaliser le transfert de la fibrillation vers les grandes ondes, et seulement après cela, la défibrillation doit être effectuée. La première tentative de défibrillation est effectuée avec une décharge de 200 J, avec les tentatives suivantes, la charge est augmentée à 360 J. Les électrodes doivent être humidifiées et fermement pressées contre la surface de la poitrine. Les erreurs les plus courantes lors de la défibrillation, qui entraînent l'inefficacité de cette dernière, sont les suivantes. 1. Longues interruptions du massage cardiaque ou absence totale de réanimation lors de la préparation du défibrillateur pour la sortie. 2. Pression lâche ou humidification insuffisante des électrodes. 3. Application d'une décharge dans le contexte d'une fibrillation à ondes basses sans prendre de mesures qui augmentent les ressources énergétiques du myocarde. 4. Appliquer une décharge de tension faible ou excessivement élevée. Il convient de noter que la défibrillation électrique du cœur est une méthode efficace pour corriger des arythmies cardiaques telles que la tachycardie ventriculaire paroxystique, le flutter auriculaire, la tachycardie nodale et supraventriculaire, la fibrillation auriculaire. L'indication de la défibrillation électrique, au stade préhospitalier, est le plus souvent la tachycardie ventriculaire paroxystique. Une caractéristique de la défibrillation dans ces conditions est la présence de conscience chez le patient et la nécessité d'éliminer la réaction à la douleur lors de l'application d'une décharge électrique. 14. Soins intensifs des syndromes post-réanimation I-Réanimation - soins intensifs pour les syndromes post-réanimation 1. Correction du CBS et de l'équilibre eau-électrolyte. Souvent, après la RCP, une alcalose métabolique, une hypokaliémie, une hypochlorémie et d'autres troubles électrolytiques se développent. Il y a un changement de pH vers un environnement acide ou alcalin. La clé de la correction du pH est une ventilation adéquate. L'utilisation de bicarbonate doit être effectuée sous le contrôle de la composition gazeuse du sang. En règle générale, il n'est pas nécessaire d'introduire du HCO3 avec une restauration rapide de la circulation sanguine et de la respiration. Avec un cœur fonctionnel, un niveau de pH d'environ 7,15 est suffisant pour le fonctionnement du système cardiovasculaire. 2. Normalisation du système de défense antioxydant. La thérapie intensive comprend un complexe de médicaments antioxydants à action multidirectionnelle - mafusol, unitiol, vitamine C, multibiont, tocophérol, probucol, etc. 3. L'utilisation d'antioxydants aide à réduire l'intensité des processus métaboliques et, par conséquent, à réduire les besoins en oxygène et en énergie, ainsi que l'utilisation maximale de la quantité réduite d'oxygène disponible pendant l'hypoxie. Ceci est réalisé grâce à l'utilisation de médicaments de protection neurovégétative et d'antihypoxants (seduxen, dropéridol, bloqueurs de ganglions, mexamine, oxybutyrate de sodium, cytochrome, gutimine, etc.). 4. Une augmentation des ressources énergétiques est apportée par l'administration intraveineuse de solutions concentrées de glucose avec de l'insuline et les principaux coenzymes impliqués dans l'utilisation de l'énergie (vitamine B6, cocarboxylase, ATP, riboxine, etc.). 5. La stimulation de la synthèse des protéines et des acides nucléiques - substrats absolument nécessaires au fonctionnement normal des cellules, la synthèse des enzymes, des immunoglobulines et autres, est réalisée par l'utilisation d'hormones anabolisantes (rétabolil, nérabolil, insuline, rétinol ), l'acide folique, ainsi que l'introduction de solutions d'acides aminés. 6. L'activation du métabolisme aérobie est obtenue en introduisant une quantité suffisante de substrats d'oxydation (glucose), ainsi qu'en utilisant l'oxygénation hyperbolique (HBO) - cette méthode garantit l'apport de la quantité d'oxygène requise même dans des conditions de violation brutale de sa livraison . 7. Amélioration des processus redox (acide succinique, riboxine, tocophérol, etc.). 8. La thérapie de désintoxication active contribue à la normalisation des processus métaboliques. Pour cela, diverses méthodes de thérapie par perfusion (gélatinol, albumine, plasma), diurèse forcée, etc. sont utilisées.Dans les cas graves, des méthodes de détoxification extracorporelle sont utilisées (hémosorption, hémodialyse, plasmaphérèse). 9. Élimination des violations des processus de microcirculation. Pour cela, une thérapie à l'héparine est effectuée. 15. Laryngospasme Le laryngospasme est la fermeture des vraies et des fausses cordes vocales. Dans les deux cas, des agents de contrôle (eufillin) sont obligatoirement utilisés. Si cela n'aide pas, il est nécessaire d'introduire des myorelaxants à action brève, d'intuber et de transférer le patient sous ventilation mécanique. Les relaxants musculaires provoquent une insuffisance respiratoire dans la période postopératoire si une décurarisation suffisante n'est pas effectuée. Il est généralement produit par des médicaments anticholinestérasiques (prozérine). Au moment de l'extubation, il est nécessaire de s'assurer que la force et le tonus musculaire ont récupéré (demander à lever la main, serrer la main, lever la tête). Avec de multiples fractures des côtes, une partie de la poitrine s'enfonce lors de l'inspiration, la respiration dite paradoxale se développe, il est donc nécessaire de restaurer le cadre thoracique. Pour ce patient, il est nécessaire d'intuber, après introduction de relaxants, avec un nouveau transfert en ventilation mécanique (jusqu'à ce que l'intégrité du thorax soit restaurée). Les éléments suivants entraînent une diminution du fonctionnement du parenchyme pulmonaire: atélectasie, collapsus pulmonaire, pneumonie, suites d'une intervention chirurgicale, pneumo-, hémo-, pyothorax. Différences entre atélectasie et collapsus : l'atélectasie est une obstruction à l'état redressé. Cette affection se caractérise par la présence d'un poumon non ventilé par lequel passe la moitié du sang circulant, ce dernier n'étant pas oxygéné. En conséquence, une insuffisance respiratoire aiguë se développe. Lorsque le poumon s'effondre, il est comprimé par l'air ou le liquide dans la cavité pleurale. Dans le même temps, la circulation sanguine dans le poumon comprimé diminue fortement et la circulation sanguine dans le poumon sain augmente. Par conséquent, l'effondrement n'est pas une complication aussi dangereuse en termes de développement d'une insuffisance respiratoire aiguë que l'atélectasie. Avant la chirurgie, la fonction du poumon intact doit être évaluée (spirographie séparée). Selon le stade de développement, l'insuffisance respiratoire aiguë est divisée en: 1) dysfonctionnement ; 2) insuffisance ; 3) défaillance de la fonction prothétique. Selon le taux de développement, l'insuffisance respiratoire aiguë est divisée en: 1) rapide comme l'éclair (se développe en une minute); 2) aigu (se développe en quelques heures); 3) subaiguë (se développe en quelques jours); 4) chronique (dure des années). Les principaux éléments de la réanimation pour insuffisance respiratoire aiguë : oxygénothérapie, position de drainage du patient, fibrobronchoscopie, trachéotomie, intubation et ventilation mécanique, bronchodilatation, hormonothérapie, OHB. 16. Embolie pulmonaire L'embolie pulmonaire (EP) est un blocage du tronc principal ou moyen, des petits troncs vasculaires de l'artère pulmonaire, entraînant une augmentation de la pression dans la circulation pulmonaire, une insuffisance ventriculaire droite. Classification clinique de l'EP Forme : lourde, moyenne et légère. En aval : fulminant, aigu, récurrent. Selon le niveau d'atteinte de l'artère pulmonaire : tronc ou branches principales, branches lobaires (segmentaires), petites branches. L'évolution clinique de l'EP est assez variable. Les symptômes les plus fréquents sont l'apparition soudaine d'un essoufflement (RR allant de 30 à plus de 50 par minute), une respiration rapide, une pâleur, le plus souvent une cyanose, un gonflement des veines jugulaires, une tachycardie, une hypotension artérielle (jusqu'au choc), une douleur, toux et hémoptysie. L'auscultation détermine souvent le renforcement du tonus II sur l'artère pulmonaire. Signes radiographiques - augmentation de la taille de l'artère pulmonaire proximale, épuisement du motif périphérique, ainsi que soulèvement du dôme du diaphragme. L'ECG peut révéler une surcharge des bons services (cœur pulmonaire) : 1) l'apparition d'ondes Q avec augmentation simultanée de l'amplitude des ondes R et S (syndrome QS) ; 2) rotation du cœur autour de l'axe longitudinal avec le ventricule droit vers l'avant (décalage de la zone de transition vers les dérivations thoraciques gauches) ; 3) sus-décalage du segment ST avec onde négative dans les dérivations III, aUR, V1-V3 ; 4) l'apparition ou l'augmentation du degré de blocage de la jambe droite du faisceau de His; 5) dent "pulmonaire" pointue haute P avec une déviation de son axe électrique vers la droite; 6) tachycardie sinusale ou forme tachysystolique de fibrillation auriculaire. L'échocardiographie permet de détecter le cœur pulmonaire aigu, de déterminer la sévérité de l'hypertension dans la circulation pulmonaire, d'évaluer l'état structurel et fonctionnel du ventricule droit, de détecter une thromboembolie dans les cavités cardiaques et dans les principales artères pulmonaires, de visualiser un foramen ovale ouvert, qui peut affecter la sévérité des troubles hémodynamiques et être à l'origine d'embolies paradoxales. Cependant, un résultat échocardiographique négatif n'exclut nullement le diagnostic d'embolie pulmonaire. La méthode de diagnostic la plus informative est l'angiographie de l'artère pulmonaire. traitement 1. Traitement anticoagulant. 2. Thérapie thrombolytique. 3. Traitement chirurgical. 17. Traitement d'urgence de l'état de mal asthmatique Oxygénothérapie. L'oxygène humidifié est inhalé2à travers des cathéters nasaux ou à travers un masque à un débit de 1-2 l / min. L'adrénaline stimuleα1-,β., - et β2-récepteurs adrénergiques, dilate les bronches et réduit la résistance des voies respiratoires. Eufillin inhibe la phosphodiestérase, qui contribue à l'accumulation d'AMP cyclique et à l'élimination du bronchospasme. Lors de la prescription d'aminophylline, il convient de prendre en compte les contre-indications, notamment le tabagisme et l'enfance, l'insuffisance cardiaque et le syndrome coronarien aigu, les maladies chroniques des poumons, du foie et des reins. Avec la SA, la dose de charge d'aminophylline est de 3 à 6 mg/kg, elle est administrée par voie intraveineuse en 20 minutes. Effectuez ensuite une perfusion goutte à goutte d'entretien du médicament. L'effet de la corticothérapie est associé à la suppression de l'inflammation des voies respiratoires et à une sensibilité accrue aux agents β-adrénergiques. Plus la SA est sévère, plus l'indication d'une corticothérapie immédiate est importante. Une dose élevée de corticostéroïdes doit être administrée initialement. Si le traitement est inefficace, la dose est augmentée. Au moins toutes les 6 heures, des doses équivalentes appropriées de ces médicaments sont administrées. La plupart des patients reçoivent un traitement par inhalation avec des b - adrénométiques; (fénotérol, alupent, salbutamol). Les exceptions sont les cas de surdosage médicamenteux de sympathomimétiques. Si le traitement en cours ne donne pas d'effet, l'administration intraveineuse d'agonistes β-adrénergiques, tels que l'isoprotérénol, dilués dans une solution de glucose à 5%, est indiquée. Les contre-indications sont les maladies cardiaques (cardiosclérose coronarienne, infarctus du myocarde), la tachycardie sévère et les symptômes de tachyphylaxie, la vieillesse. Le débit d'administration de l'isoprotérénol est de 0,1 μg/kg par 1 min jusqu'à l'apparition de la tachycardie (HR 130 par 1 min ou plus). La thérapie par perfusion est le composant le plus important du traitement de la SA, visant à reconstituer la carence en liquide et à éliminer l'hypovolémie, le volume total de la thérapie par perfusion est de 3 à 5 litres par jour. L'hydratation est réalisée en introduisant des solutions contenant une quantité suffisante d'eau libre (solutions de glucose), ainsi que des solutions d'électrolytes hypo- et isotoniques contenant du sodium et du chlore. Les indicateurs d'une hydratation adéquate sont l'arrêt de la soif, une langue humide, le rétablissement d'une diurèse normale, une meilleure évacuation des expectorations et une diminution de l'hématocrite à 0,30-0,40. L'anesthésie à l'halothane peut être utilisée dans le traitement d'une crise d'asthme sévère qui ne se prête pas à une thérapie conventionnelle. Ventilation artificielle des poumons. Les indications pour le transfert des patients atteints de SA à la ventilation mécanique doivent être très strictes, car dans cet état, elles entraînent souvent des complications et se caractérisent par une mortalité élevée. Dans le même temps, la ventilation mécanique, si elle est pratiquée selon des indications strictes, est la seule méthode pouvant empêcher la progression ultérieure de l'hypoxie et de l'hypercapnie. 18. Infarctus du myocarde L'infarctus du myocarde est un écart entre la demande en oxygène du myocarde et son apport, entraînant une nécrose limitée du muscle cardiaque. La cause la plus fréquente est un thrombus, moins souvent une embolie, moins souvent un spasme des artères coronaires. La thrombose est le plus souvent observée dans le contexte de lésions athéroscléreuses des artères coronaires. Classiquement, l'infarctus du myocarde commence par une douleur croissante derrière le sternum, qui est de nature brûlante et pressante. Caractérisé par une irradiation étendue de la douleur dans les bras (généralement à gauche), le dos, l'abdomen, la tête, sous l'omoplate gauche, dans la mâchoire inférieure gauche, etc. Les patients sont agités, anxieux, parfois ils notent un sentiment de peur de décès. Il existe des signes d'insuffisance cardiaque et vasculaire - extrémités froides, sueur moite, etc. Le syndrome douloureux se prolonge et n'est pas soulagé par la nitroglycérine pendant 30 minutes ou plus. Il existe divers troubles du rythme cardiaque, une baisse de la tension artérielle ou son élévation. Les patients notent subjectivement la sensation de manque d'air. Les signes ci-dessus sont typiques de la période I - douloureuse ou ischémique, dont la durée varie de plusieurs heures à 2 jours. Objectivement, une augmentation de la tension artérielle (puis une diminution) ; augmentation de la fréquence cardiaque ou perturbation du rythme ; à l'auscultation, une tonalité IV anormale est entendue; les bruits cardiaques sont étouffés ; sur le ton de l'accent II de l'aorte ; il n'y a pratiquement pas de changements biochimiques dans le sang, des signes caractéristiques sur l'ECG. La deuxième période est aiguë (fiévreuse, inflammatoire), caractérisée par la survenue d'une nécrose du muscle cardiaque au site de l'ischémie. La douleur disparaît généralement. La durée de la période aiguë peut aller jusqu'à 2 semaines. Le bien-être du patient s'améliore progressivement, mais une faiblesse générale, un malaise et une tachycardie persistent. Les bruits cardiaques sont étouffés. L'augmentation de la température corporelle provoquée par le processus inflammatoire du myocarde, généralement faible, jusqu'à 38°C, apparaît généralement au 3ème jour de la maladie. À la fin de la première semaine, la température revient généralement à la normale. La troisième période (subaiguë ou période de cicatrisation) dure de 4 à 6 semaines. Caractéristique pour cela est la normalisation des paramètres sanguins (enzymes), la température corporelle se normalise, tous les autres signes d'un processus aigu disparaissent: l'ECG change, une cicatrice du tissu conjonctif se développe au site de la nécrose. La quatrième période (période de rééducation, récupération) dure de 6 mois à 1 an. Il n'y a pas de signes cliniques. Au cours de cette période, une hypertrophie compensatoire des fibres musculaires myocardiques intactes se produit et d'autres mécanismes compensatoires se développent. Il y a une restauration progressive de la fonction myocardique. Mais l'onde Q pathologique persiste à l'ECG. Le traitement vise à prévenir les complications, à limiter la zone d'infarctus, à soulager la douleur et à corriger l'hypoxie. 19. Choc cardiogénique Le choc cardiogénique est un trouble circulatoire critique avec hypotension artérielle et signes de détérioration aiguë de la circulation sanguine dans les organes et les tissus. Le principal signe diagnostique est une diminution significative de la pression artérielle systolique, inférieure à 90 mm Hg. Art. La différence entre la pression systolique et diastolique (pression pulsée) est de 20 mm Hg. Art. ou devenir encore plus petit. De plus, une clinique d'une forte détérioration de la perfusion des organes et des tissus se développe: 1) troubles de la conscience allant d'une légère léthargie à la psychose ou au coma, des symptômes neurologiques focaux peuvent apparaître ; 2) diurèse inférieure à 20 ml/h. Symptômes de détérioration de la circulation périphérique : peau pâle cyanosée, marbrée, brique, moite ; veines périphériques effondrées, forte diminution de la température de la peau des mains et des pieds; diminution du flux sanguin. La valeur du CVP peut être différente. Les indicateurs normaux de CVP sont 5-8 cm d'eau. Art.; indicateur en dessous de 5 cm d'eau. Art. indique une hypovolémie et une pression artérielle basse, et au-dessus de 8 cm d'eau. Art. indique une insuffisance ventriculaire droite. traitement L'oxygénothérapie avec de l'oxygène humidifié à travers un masque ou des cathéters nasaux est indiquée. Anticoagulants douloureusement administrés à une dose de 10 000 UI, suivis d'un infusomat intraveineux de 1000 1 UI par heure. Il est nécessaire d'administrer des antalgiques : morphine 1,0 % 50 ml par voie sous-cutanée ou intraveineuse en bolus ; analgin 2% XNUMX ml par voie intramusculaire, intraveineuse. Toniques vasculaires : Cordiamine 1-4 ml par voie intraveineuse ; mezaton 1% 1,0 g par voie sous-cutanée, intraveineuse, dans une solution saline ; norépinéphrine 0,2 % 1,0 g par voie intraveineuse. Le véritable choc cardiogénique est traité comme suit. Pour augmenter l'activité contractile du myocarde, on utilise: strophanthine 0,05% 0,5-0,75 g par voie intraveineuse lentement par 20,0 de solution isotonique, korglucon 0,01 g par voie intraveineuse, également dans une solution isotonique ou dans un mélange polarisant, glucagon 2-4 mg par voie intraveineuse goutte à goutte sur une solution polarisante. Normalisation de la tension artérielle : noradrénaline 0,2 % 2 à 4 ml pour 1 litre de solution de glucose à 5 % ou de solution isotonique. La TA est maintenue à 100 mm Hg. Art., mezaton 1 % 1,0 g par voie intraveineuse ; cordiamine 2-4 ml, dopamine 200 mg dans 400 ml de rhéopolyglucine ou glucose à 5%. Avec un effet instable des médicaments ci-dessus, l'hydrocortisone 200 mg, la prednisolone 90-120 mg sont utilisées. Normalisation des propriétés rhéologiques du sang. Élimination de l'hypovolémie, car il y a transpiration de la partie liquide du sang: reopoliglyukin, polyglukin - dans un volume allant jusqu'à 100 ml à un débit de 50,0 ml par minute. Correction de l'équilibre acido-basique (lutte contre l'acidose) : bicarbonate de sodium 5 % à 200,0 ml. Réintroduction d'analgésiques. Restauration des troubles du rythme et de la conduction. 20. Crise hypertensive Une crise hypertensive est une augmentation brutale de la pression artérielle à un niveau habituellement non caractéristique de ce patient, entraînant des troubles circulatoires régionaux aigus et des lésions des organes cibles (cœur, cerveau, reins, intestins). Les facteurs externes provoquant une crise peuvent être : 1) stress psycho-émotionnel; 2) influences météorologiques ; 3) consommation excessive de sel de table. Les symptômes cliniques d'une crise se manifestent par le bruit dans les oreilles, mouches clignotantes devant les yeux, maux de tête éclatants dans la région occipitale, aggravés par la flexion, les efforts, la toux, les nausées, les vomissements, les troubles du rythme cardiaque. Pendant une crise, des violations dangereuses de la circulation coronarienne cérébrale, moins souvent rénale et abdominale, se produisent, ce qui entraîne un accident vasculaire cérébral, un infarctus du myocarde et d'autres complications graves. L'ECG révèle une hypertrophie ventriculaire gauche. La radiographie thoracique montre une hypertrophie du cœur, une déformation de l'aorte sous la forme du chiffre "3", une usure des côtes résultant d'une augmentation du flux sanguin collatéral dans les artères intercostales. L'aortographie confirme le diagnostic. La forme neurovégétative de la crise se caractérise par une apparition soudaine, une excitation, une hyperémie et une humidité de la peau, une tachycardie, des mictions abondantes fréquentes, une augmentation prédominante de la pression systolique avec une augmentation de l'amplitude du pouls. Ces crises sont autrement appelées crises surrénales ou crises de type I. Les crises de type I ont généralement une évolution relativement bénigne, bien qu'elles puissent entraîner des arythmies paroxystiques ou une angine de poitrine et, dans les cas graves, un infarctus du myocarde. Avec la forme eau-sel de la crise, l'état s'aggrave progressivement, on note somnolence, faiblesse, léthargie, désorientation, pâleur et gonflement du visage et gonflement. La pression systolique et diastolique augmente uniformément ou avec la prédominance de cette dernière et une diminution de la pression différentielle. Ces crises sont appelées crises de type II. Les crises de type II, en règle générale, sont graves et peuvent être compliquées par un infarctus du myocarde, un accident vasculaire cérébral, une insuffisance ventriculaire gauche aiguë. Il faut souligner les crises hypertensives qui se développent à la suite d'un arrêt brutal d'un traitement antihypertenseur permanent, en particulier la prise de b-bloquants, de nifédipine, de sympatholytiques et surtout de clonidine. Le traitement d'une crise hypertensive consiste en une diminution urgente de la pression artérielle à un niveau normal, nécessaire pour prévenir ou limiter les dommages aux organes cibles dans l'hypertension artérielle, pour prévenir des complications pouvant aller jusqu'au décès dans les cas les plus graves, ou une incapacité permanente dans le développement de accident vasculaire cérébral, infarctus du myocarde. 21. Arythmie. Paroxysme de fibrillation auriculaire Une arythmie est un rythme cardiaque autre que sinusal. Classification des arythmies 1. Violation de la formation des impulsions : 1) dans le nœud sinusal : a) tachycardie sinusale ; b) bradycardie sinusale ; c) arythmie sinusale ; d) maladie des sinus (SSS) ; 2) arythmies ectopiques : a) extrasystole ; b) tachycardie paroxystique ; c) fibrillation et flutter auriculaires ; d) scintillement et flutter des ventricules. 2. Violation de la conduction des impulsions : 1) voies supplémentaires (faisceaux de Kent); 2) bloc cardiaque : a) auriculaire (intra-auriculaire); b) auriculo-ventriculaire ; c) intraventriculaire. Mécanismes des arythmies Une diminution du potentiel de repos, le seuil d'excitabilité se produit uniquement sur la base d'une carence en potassium cellulaire, le rapport "plasma - cellule" (normalement 80 meq de potassium est dans la cellule et 5 meq dans le plasma). Asymétrie du foyer électrophysiologique-métabolique du myocarde due à l'ischémie, l'inflammation, la reperfusion lors de la thrombolyse. Faiblesse électrophysiologique du stimulateur supérieur. Voies de conduction accessoires congénitales. La tachycardie supraventriculaire paroxystique est une crise cardiaque soudaine avec une fréquence de 150 à 250 battements par minute. Il existe 3 formulaires : 1) auriculaire ; 2) nodal ; 3) ventriculaire. L'étiologie de la tachycardie paroxystique supraventriculaire est plus souvent associée à une augmentation de l'activité du système nerveux sympathique. Elle se manifeste cliniquement par une attaque soudaine de palpitations, les vaisseaux du cou palpitent, l'activité cardiaque passe à un rythme différent. La durée de l'attaque est de quelques minutes à plusieurs jours. Le nombre de battements cardiaques dans la forme ventriculaire est généralement compris entre 150 et 180 battements par minute, avec des formes supraventriculaires - 180-240 battements par minute. Lors d'une attaque, un rythme pendulaire est caractéristique auscultatoire, il n'y a pas de différence entre le ton I et II. Il augmente la demande en oxygène du myocarde et peut provoquer une crise d'insuffisance coronarienne aiguë. Signes ECG 1. Les complexes QRS ne sont pas modifiés. 2. Dans la forme supraventriculaire, l'onde P fusionne avec T. 22. Extrasystole ventriculaire. Trouble de la conduction AV L'extrasystole ventriculaire est la survenue d'un complexe QRS déformé extraordinairement large, d'un décalage ST et T discordant, d'une pause compensatoire complète (l'intervalle entre l'onde P pré et post-extrasystolique est égal à deux fois l'intervalle RR normal). Le médicament de choix est la lidocaïne, qui est administrée selon le schéma ci-dessus. Peut-être l'utilisation de cordarone à une dose de 300 à 450 mg goutte à goutte par voie intraveineuse. Violation de la conduction AV avec développement de syncope (syndrome de Morgagni-Adams-Stokes) Lorsque la conduction est perturbée, divers types de blocs cardiaques se produisent, il y a un ralentissement ou un arrêt complet de la conduction de l'impulsion à travers le système de conduction du cœur. Le blocage sino-auriculaire est caractérisé par un dysfonctionnement des lymphocytes T et une altération de la conduction des impulsions du nœud sinusal aux oreillettes. Il y a 3 degrés. Je degré - ralentir l'impulsion. Sur l'ECG - allongement de l'intervalle PQ de plus de 0,20 s. Prolapsus du complexe QRS. L'intervalle RR est stable. II degré - perte d'une partie des impulsions, conduction incomplète. Mobitz type I - au fur et à mesure que les impulsions sont réalisées, l'intervalle PQ s'allonge progressivement jusqu'à la perte complète de l'onde de pouls. Le QRS n'est pas modifié. Au site du prolapsus QRS, la plus grande distance est RR. Pronostiquement, ce type est relativement favorable. Mobitz de type II avec un intervalle PQ constant et un complexe QRS inchangé. Dans le même temps, toutes les impulsions n'atteignent pas les ventricules - dans certains cas, une impulsion sur deux est effectuée, dans d'autres - tous les tiers, etc., c'est-à-dire qu'il y a un prolapsus périodique du complexe QRS 3: 2, 4: 3 , 5: 6, etc. d. III degré - blocage complet de la conduction. Dans le même temps, la conduction des impulsions vers les ventricules s'arrête complètement, dans les ventricules leur propre foyer hétérotopique de rythme idioventriculaire est né, et plus l'automatisme est faible, plus la clinique est difficile. Une dissociation complète est observée: le rythme auriculaire est proche de la normale et les ventricules ont leur propre fréquence - 40 battements par minute ou moins. Ce dernier dépend du niveau de dommage: si le nœud AV souffre, 40 à 50 battements par 1 minute, si la jambe du faisceau de His - 20 battements par 1 minute ou moins. Le niveau de dommage est également indiqué par le degré de déformation du complexe QRS. Les sons cardiaques sont affaiblis, il y a périodiquement un ton "canon" I, lorsque la systole des oreillettes et des ventricules coïncide presque dans le temps. Peut être III tonalité supplémentaire. Des souffles d'éjection systolique peuvent apparaître à la base du cœur. On trouve souvent une pulsation des veines associée à la contraction auriculaire, particulièrement distincte avec le ton canon de Strazhesko. Клиника Défaillance du cœur, si une impulsion tombe. Vertige si plusieurs impulsions tombent. Syndrome de Morgagni-Adams-Stokes (perte de conscience), si 6-8 complexes tombent. traitement Pour rétablir un rythme adéquat, l'atropine est administrée à une dose de 0,5-1 mg à 3 mg. Toutes les 3 minutes, 1 mg jusqu'à une dose totale de 0,4 mg/kg. Antagonistes calciques - isoptine 0,04 mg/kg. Avec des pertes de conscience fréquentes, le patient est transféré à une thérapie électropulsive permanente. Mais le plus souvent, la stimulation doit être effectuée "à la demande". 23. Causes de l'insuffisance rénale aiguë L'insuffisance rénale aiguë (IRA) est une complication d'un certain nombre de maladies rénales et extrarénales caractérisées par une forte détérioration ou un arrêt de la fonction rénale et se manifestant par le complexe de symptômes suivant : oligoanurie, azotémie, hyperhydratation, altération du CBS et de l'équilibre hydrique et électrolytique. Les formes de POO comprennent : 1) prérénal (hémodynamique); 2) rénal (parenchymateux); 3) postrénale (obstructive); 4) arénal. Raisons du développement de l'insuffisance rénale aiguë prérénale. 1. Diminution du débit cardiaque (choc cardiogénique, arythmie paroxystique, tamponnade cardiaque, embolie pulmonaire, insuffisance cardiaque congestive). 2. Tonus vasculaire réduit (septicémie, choc infectieux-toxique, choc anaphylactique, surdosage d'antihypertenseurs). 3. Diminution du volume intravasculaire efficace (perte de sang, perte de plasma, déshydratation - perte de 7 à 10 % du poids corporel). 4. Violation de l'hémodynamique intrarénale (prise d'AINS, d'inhibiteurs de l'ECA, de médicaments radio-opaques, de sandimmune). 5. Empoisonnement à l'eau - hyperhydratation (production incontrôlée d'ADH dans les tumeurs malignes, maladies inflammatoires du système nerveux central, surdosage de médicaments - médicaments, barbituriques, antidiabétiques sulfanilamides, indométhacine, amitriptyline, cyclophosphamide). Raisons du développement de l'insuffisance rénale aiguë rénale. 1. Ischémie du rein. 2. Dommages néphrotoxiques dus à l'exposition à : 1) médicaments (aminoglycosides, AINS, médicaments radio-opaques, etc. ; 2) néphrotoxines industrielles (sels de métaux lourds) ; 3) les néphrotoxines ménagères (éthylène glycol, alcool méthylique, dichloroéthane, tétrachlorure de carbone). 3. Obstruction intratubulaire par des pigments : 1) hémoglobine ; 2) urates ; 3) myoglobine ; 4) processus inflammatoires ; 5) papillite nécrotique (diabète sucré, analgésique, néphropathie alcoolique); 6) pathologie vasculaire. Raisons du développement de l'insuffisance rénale aiguë post-rénale. 1. Pathologie des uretères : 1) obstruction ; 2) compression. 2. Pathologie de la vessie. 3. Rétrécissement urétral. 24. Clinique et traitement de l'insuffisance rénale aiguë L'évolution clinique de l'insuffisance rénale aiguë comporte cinq stades. Le stade I de l'insuffisance rénale aiguë est initial, il dure depuis l'apparition du facteur étiologique jusqu'à l'apparition des premiers signes. A ce stade, les tactiques thérapeutiques visent à éliminer ou à atténuer l'impact du facteur étiologique: thérapie anti-choc, reconstituer le BCC, lutter contre l'insuffisance cardiaque, thérapie alcalinisante de l'hémolyse intravasculaire, combattre la douleur, traiter les affections septiques, etc. thérapie, le spasme des vaisseaux rénaux est éliminé sous le contrôle de la diurèse horaire. Plus la stimulation de la diurèse est débutée tôt, plus le pronostic est favorable. Le stade II de l'insuffisance rénale aiguë, ou oligoanurique, est caractérisé par un dysfonctionnement de 70 % des néphrons. Un débit urinaire inférieur à 500 ml par jour indique le développement d'une oligurie, et une diminution à 50 ml par jour ou moins indique une anurie. Outre la capacité altérée des reins à excréter de l'eau, les fonctions de concentration et d'excrétion de l'azote en souffrent également. La quantité d'électrolytes et d'azote dans l'urine diminue fortement. À ce stade, les changements les plus prononcés dans l'hémostase se produisent. Le traitement doit viser la constance de l'environnement interne afin de laisser le temps et la possibilité à l'épithélium rénal de se régénérer. Un état d'hyperhydratation se développe en raison de la perte d'électrolytes lors de vomissements et de diarrhée. Par conséquent, il est nécessaire de stimuler la diurèse, mais uniquement sous le contrôle du CVP. Améliorer le flux sanguin rénal. Puisqu'il est nécessaire d'effectuer un contrôle strict de la diurèse, un cathétérisme vésical est effectué. La violation de la fonction d'excrétion d'azote des reins entraîne une azotémie. Par conséquent, pour maximiser la prévention de la dégradation des protéines dans le corps, il est nécessaire d'introduire une quantité suffisante de glucides. Si l'évolution est sévère et non traitable, des séances d'hémodialyse sont effectuées. Si le facteur étiologique est supprimé, après 5 à 7 jours de traitement, la diurèse commence à augmenter. La durée maximale de cette étape est de 2 semaines. Stade III de l'insuffisance rénale aiguë - polyurique précoce. Elle se caractérise par une augmentation progressive de la diurèse (de 200 à 300 ml par jour) jusqu'à 3 litres. Les fonctions d'excrétion et de concentration d'azote des reins ne se sont pas encore complètement rétablies, mais la concentration de potassium, de magnésium et de phosphates se normalise progressivement. La thérapie intensive au stade polyurique précoce devrait inclure les mêmes mesures que dans la précédente, à l'exception de la stimulation de la diurèse. Souvent, une hémodialyse est nécessaire. Le risque de déshydratation est élevé. Stade IV de l'insuffisance rénale aiguë - polyurie tardive. L'augmentation quotidienne de l'urine atteint 500 à 1000 8 ml et la diurèse peut atteindre 10 à XNUMX litres par jour ou plus. Dans les reins, les processus d'échange d'ions commencent à se rétablir. Les pertes de potassium, de magnésium, de phosphore et d'autres électrolytes augmentent fortement, les patients sont à risque de déshydratation et de déminéralisation. Par conséquent, les électrolytes et le liquide sont administrés par voie intraveineuse à ce stade. Stade V OPN, ou stade de récupération. La fonction de concentration des reins est restaurée. La diurèse commence à diminuer progressivement jusqu'à la normale (2-3 litres par jour) et la densité de l'urine augmente (1008-1028). 25. Insuffisance hépatique aiguë L'insuffisance hépatique aiguë est un complexe de symptômes caractérisé par une violation d'une ou plusieurs fonctions hépatiques due à des lésions aiguës ou chroniques de son parenchyme. Les manifestations cliniques de l'ARF sont les suivantes. 1. La coagulopathie est causée par une déficience en facteurs de coagulation et une augmentation de l'activité fibrinolytique. Il prédispose aux saignements spontanés des muqueuses: des saignements gastro-intestinaux, utérins, nasaux peuvent être observés. Des hémorragies cérébrales sont possibles. Pour évaluer l'état du système d'hémostase, le temps de prothrombine est déterminé. 2. L'hypoglycémie se caractérise par un taux élevé d'insuline dans le plasma, qui est dû à une diminution de son absorption par le foie. Elle entraîne une détérioration rapide de l'état neurologique et la mort des patients. 3. Violations de l'équilibre eau-électrolyte et acido-basique. L'insuffisance rénale aiguë terminale se caractérise par une hyponatrémie, une hypophosphatémie, une hypocalcémie et une hypomagnésémie. Le changement d'état acido-basique n'a pas de sens univoque. L'alcalose respiratoire associée à la stimulation du centre respiratoire par des substances toxiques peut être remplacée par une acidose respiratoire due à l'augmentation de la pression intracrânienne et à la suppression de l'activité respiratoire. Dans le développement du coma hépatique en tant qu'évolution sévère de la maladie, les stades du précoma, du coma menaçant et du coma proprement dit sont distingués. Il existe également un coma hépatocellulaire (endogène), résultant d'une nécrose massive du parenchyme, porto-cave (pontage, shunt, exogène), dû à une exclusion importante du foie des processus métaboliques en raison de la présence d'anastomoses porto-caves prononcées, et coma mixte, survenant principalement dans la cirrhose du foie. Dans la période précomateuse, une anorexie progressive, des nausées, une diminution de la taille du foie, une augmentation de la jaunisse, une hyperbilirubinémie et une augmentation de la teneur en acides biliaires dans le sang se développent. À l'avenir, les troubles neuropsychiques, le ralentissement de la pensée, la dépression et parfois l'euphorie augmentent. Caractérisé par l'instabilité de l'humeur, l'irritabilité, la mémoire est perturbée, le sommeil est perturbé. Les réflexes tendineux augmentent, un petit tremblement des membres est caractéristique. L'azotémie se développe. Avec un traitement rapide, les patients peuvent sortir de cet état, mais le plus souvent, avec des modifications irréversibles graves du foie, un coma survient. Pendant la période de coma, une excitation est possible, qui est alors remplacée par une dépression (stupeur) et une altération progressive de la conscience jusqu'à sa perte complète. Des phénomènes méningés, des réflexes pathologiques, une agitation motrice, des convulsions se développent. La respiration est perturbée (comme Kussmaul, Cheyne-Stokes); le pouls est petit, arythmique; il y a hypothermie. Le visage du patient est hagard, les extrémités sont froides, une odeur de foie sucrée caractéristique se dégage de la bouche et de la peau, les phénomènes hémorragiques s'intensifient (hémorragies cutanées, saignements du nez, des gencives, varices de l'œsophage, etc.). 26. Traitement de l'insuffisance hépatique aiguë Un soutien inotrope opportun est un élément essentiel des soins intensifs. Prévention des complications infectieuses - la nomination d'antibiotiques céphalosporines en association avec des médicaments antifongiques (amphotéricine-B). Hépatoprotecteurs et médicaments stabilisateurs de membrane : prednisolone jusqu'à 300 mg, vitamine C 500 mg, troxevasine 5 ml, étamsylate de sodium 750 mg, Essentiale 30 ml, tocophérol 4 ml par voie intramusculaire, cytomak 35 mg, cocarboxylase 300 mg, acide nicotinique 30-40 mg, com-plamin 900 mg, sirepar 5-10 ml, acide glutamique 1% 400 ml, vikasol 10 ml par voie intraveineuse, vitamines B. Inhibiteurs de la protéase, qui comprennent 100 400 unités cortri-cal, trasylol XNUMX XNUMX unités, antagonosan, go-dox. Stimulation de la diurèse : reogluman 400 ml, mannitol, lasix jusqu'à 200 mg par voie intraveineuse, eufillin 240 mg. Pour corriger la coagulopathie, l'administration intraveineuse de vitamine K (10 mg par jour pendant 3 jours) est utilisée. L'effet se produit après 3 heures.Dans ce cas, l'élimination de l'hypoprothrombinémie associée à une mauvaise absorption de la vitamine K, résultant d'une carence en acides biliaires. En cas d'hémorragie ou de gestes invasifs suspectés (cathétérisme vasculaire, dialyse péritonéale), une masse plaquettaire ou du plasma frais congelé est administré par voie intraveineuse. L'œdème cérébral est une cause fréquente de décès. Le mannitol est administré à raison de 1 g/kg de poids corporel. Chez les insuffisants rénaux, le mannitol est prescrit en association avec l'ultrafiltration pour éviter l'hyperosmolarité et la surhydratation. Avec le développement du coma hépatique, le chlorure de potassium est prescrit (solution à 0,4-0,5% dans une solution de glucose à 5% avec un volume de 500 ml goutte à goutte par voie intraveineuse) ou une solution de bicarbonate de sodium (avec acidose métabolique); Les patients respirent de l'oxygène humidifié à travers un cathéter nasal. Avec une diminution de la pression artérielle et veineuse, la polyglucine et l'albumine sont administrées par voie intraveineuse. En présence de saignements massifs, des mesures appropriées sont prises pour les arrêter, du sang d'un groupe est transfusé et des médicaments contenant des facteurs de coagulation du sang sont administrés. Avec des signes significatifs de coagulation intravasculaire disséminée, l'héparine est administrée par voie intraveineuse à une dose de bolus de 10 000 à 15 000 UI. En cas d'insuffisance rénale, une hémodialyse péritonéale et une plasmaphérèse sont réalisées, qui donnent un bon résultat, mais l'introduction d'héparine est contre-indiquée avant ces manipulations. Pour arrêter l'agitation psychomotrice et les convulsions, la diprazine, l'halopéridol, l'oxybutyrate de sodium sont prescrits. Dans les cas graves, recourir à l'intubation et à la ventilation mécanique. Il est important de se rappeler qu'il existe un risque élevé de saignement, donc toutes les manipulations doivent être effectuées avec une extrême prudence. Lors du retrait du patient du coma, l'étape suivante consiste à mener une thérapie intensive pour la maladie sous-jacente. 27. Choc Le choc est une forme d'état critique du corps, se manifestant par un dysfonctionnement de plusieurs organes, qui se déchaîne sur la base d'une crise de circulation généralisée et, en règle générale, se termine par la mort sans traitement. Un facteur de choc est tout effet sur le corps qui dépasse les mécanismes adaptatifs en force. En état de choc, les fonctions de la respiration, du système cardiovasculaire et des reins changent, les processus de microcirculation des organes et des tissus et les processus métaboliques sont perturbés. Le choc est une maladie de nature polyétiologique. Selon l'étiologie de la survenue, les types de choc peuvent être différents. 1. Choc traumatique : 1) avec des blessures mécaniques - fractures osseuses, plaies, compression des tissus mous, etc.; 2) avec des brûlures (brûlures thermiques et chimiques); 3) sous l'influence d'une basse température - choc froid; 4) en cas de blessures électriques - décharge électrique. 2. Choc hémorragique ou hypovolémique : 1) se développe à la suite d'un saignement, d'une perte de sang aiguë; 2) à la suite d'une violation aiguë de l'équilibre hydrique, une déshydratation du corps se produit. 3. Choc septique (bactérien toxique) (processus purulents généralisés causés par une microflore gram-négative ou gram-positive). 4. Choc anaphylactique. 5. Choc cardiogénique (infarctus du myocarde, insuffisance cardiaque aiguë). Considéré dans la section conditions d'urgence en cardiologie. Dans tous les types de choc, le principal mécanisme de développement est la vasodilatation et, par conséquent, la capacité du lit vasculaire augmente, l'hypovolémie - le volume de sang circulant (BCC) diminue, car il existe divers facteurs: perte de sang, redistribution de liquide entre le sang et les tissus, ou une inadéquation du volume sanguin normal augmentant la capacité vasculaire. L'écart qui en résulte entre le BCC et la capacité du lit vasculaire est à l'origine de la diminution du débit cardiaque et des troubles de la microcirculation. Ce dernier entraîne de graves changements dans le corps, car c'est ici que s'effectue la fonction principale de la circulation sanguine - l'échange de substances et d'oxygène entre la cellule et le sang. Il s'ensuit un épaississement du sang, une augmentation de sa viscosité et une microthrombose intracapillaire. Par la suite, les fonctions cellulaires sont perturbées jusqu'à leur mort. Dans les tissus, les processus anaérobies commencent à prédominer sur les processus aérobies, ce qui conduit au développement d'une acidose métabolique. L'accumulation de produits métaboliques, principalement l'acide lactique, augmente l'acidose. 28. Choc anaphylactique Le choc anaphylactique est un complexe de diverses réactions allergiques de type immédiat, atteignant un degré de gravité extrême. Il existe les formes suivantes de choc anaphylactique : 1) forme cardiovasculaire, dans laquelle se développe une insuffisance circulatoire aiguë, se manifestant par une tachycardie, souvent accompagnée de troubles du rythme cardiaque, de fibrillation ventriculaire et auriculaire et d'une diminution de la pression artérielle; 2) forme respiratoire, accompagnée d'insuffisance respiratoire aiguë : essoufflement, cyanose, stridor, respiration bouillonnante, râles humides dans les poumons. Cela est dû à une violation de la circulation capillaire, un gonflement du tissu pulmonaire, du larynx, de l'épiglotte; 3) forme cérébrale due à l'hypoxie, à la microcirculation altérée et à l'œdème cérébral. Selon la gravité de l'évolution, on distingue 4 degrés de choc anaphylactique. I degré (léger) se caractérise par des démangeaisons de la peau, l'apparition d'une éruption cutanée, des maux de tête, des étourdissements, une sensation de rougeur à la tête. Degré II (modéré) - L'œdème de Quincke, la tachycardie, la baisse de la pression artérielle, l'augmentation de l'indice d'Algover rejoignent les symptômes précédemment indiqués. Le grade III (sévère) se manifeste par une perte de conscience, une insuffisance respiratoire et cardiovasculaire aiguë (essoufflement, cyanose, respiration stridorée, petit pouls rapide, forte diminution de la pression artérielle, indice d'Algover élevé). Le degré IV (extrêmement sévère) s'accompagne d'une perte de conscience, d'une insuffisance cardiovasculaire sévère: le pouls n'est pas déterminé, la pression artérielle est basse. Traitement 1. Perfusion intraveineuse d'adrénaline jusqu'à stabilisation hémodynamique. Vous pouvez utiliser dopmin 10-15 mcg / kg / min, et avec des symptômes de bronchospasme et b - adrénernomimétiques: alupent, brikanil goutte à goutte par voie intraveineuse. 2. Thérapie par perfusion dans un volume de 2500 3000 à 4 400 ml avec inclusion de polyglucine et de rhéopolyglucine, à moins que la réaction ne soit provoquée par ces médicaments. Bicarbonate de sodium XNUMX% XNUMX ml, solutions de glucose pour restaurer le CBC et l'hémodynamique. 3. Stabilisateurs de membrane par voie intraveineuse : prednisolone jusqu'à 600 mg, acide ascorbique 500 mg, troxevasine 5 ml, étamsylate de sodium 750 mg, cytochrome C 30 mg (les doses quotidiennes sont indiquées). 4. Bronchodilatateurs : eufillin 240-480 mg, noshpa 2 ml, alupent (brikanil) goutte à goutte 0,5 mg. 5. Antihistaminiques : diphenhydramine 40 mg (suprastin 60 mg, tavegil 6 ml), cimétidine 200-400 mg par voie intraveineuse (les doses quotidiennes sont indiquées). 6. Inhibiteurs de la protéase : trasylol 400 100 U, contrical XNUMX XNUMX U. 29. Choc traumatique Le choc traumatique est un état pathologique et critique du corps qui est apparu en réponse à une blessure, dans lequel les fonctions des systèmes et organes vitaux sont altérées et inhibées. Lors d'un choc traumatique, on distingue les phases torpides et érectiles. Au moment de l'apparition, le choc peut être primaire (1-2 heures) et secondaire (plus de 2 heures après la blessure). Stade érectile ou phase d'occurrence. La conscience reste, le patient est pâle, agité, euphorique, inadéquat, peut crier, courir quelque part, éclater, etc. À ce stade, l'adrénaline est libérée, grâce à laquelle la pression et le pouls peuvent rester normaux pendant un certain temps. La durée de cette phase est de quelques minutes et heures à plusieurs jours. Mais dans la plupart des cas, il est court. La phase torpide remplace la phase érectile, lorsque le patient devient léthargique et adynamique, la pression artérielle diminue et une tachycardie apparaît. Les estimations de la gravité des blessures sont données dans le tableau. Évaluation de l'étendue de la gravité des blessures
Après avoir calculé les points, le nombre résultant est multiplié par un coefficient (de 1,2 à 2,0). Traitement. Les principales orientations du traitement. 1. Élimination de l'action de l'agent traumatique. 2. Élimination de l'hypovolémie. 3. Élimination de l'hypoxie. 30. Choc hémorragique Le choc hémorragique est un état d'insuffisance cardiovasculaire aiguë qui se développe après qu'une quantité importante de sang a été perdue et entraîne une diminution de la perfusion des organes vitaux. Étiologie : blessures avec atteinte des gros vaisseaux, ulcères gastriques et duodénaux aigus, rupture d'un anévrisme de l'aorte, pancréatite hémorragique, rupture de la rate ou du foie, rupture de la trompe ou grossesse extra-utérine, présence de lobules placentaires dans l'utérus, etc. Selon les données cliniques et l'ampleur de la déficience du volume sanguin, les degrés de gravité suivants sont distingués. 1. Non exprimé - il n'y a pas de données cliniques, le niveau de pression artérielle est normal. Le volume de sang perdu peut atteindre 10% (500 ml). 2. Faible - tachycardie minimale, légère diminution de la tension artérielle, quelques signes de vasoconstriction périphérique (mains et pieds froids). Le volume de sang perdu est de 15 à 25% (750-1200 ml). 3. Modéré - tachycardie jusqu'à 100-120 battements par minute, diminution de la pression différentielle, pression systolique 1-90 mm Hg. Art., anxiété, transpiration, pâleur, oligurie. Le volume de sang perdu est de 100 à 25% (35-1250 ml). 4. Sévère - tachycardie supérieure à 120 battements par minute, pression systolique inférieure à 60 mm Hg. Art., souvent non déterminé par le tonomètre, stupeur, pâleur extrême, extrémités froides, anurie. Le volume de sang perdu est supérieur à 35% (plus de 1750 ml). Laboratoire dans l'analyse générale du sang, une diminution du taux d'hémoglobine, des érythrocytes et de l'hématocrite. L'ECG montre des modifications non spécifiques du segment ST et de l'onde T, qui sont dues à une circulation coronarienne insuffisante. Le traitement du choc hémorragique comprend l'arrêt du saignement, l'utilisation d'une thérapie par perfusion pour restaurer le CBC, l'utilisation de vasoconstricteurs ou de vasodilatateurs, selon la situation. La thérapie par perfusion implique l'administration intraveineuse de liquide et d'électrolytes dans un volume de 4 litres (solution saline, glucose, albumine, polyglucine). En cas d'hémorragie, une transfusion de sang et de plasma d'un seul groupe est indiquée dans un volume total d'au moins 4 doses (1 dose correspond à 250 ml). L'introduction de médicaments hormonaux, tels que les stabilisateurs de membrane (prednisolone 90-120 mg), est montrée. Selon l'étiologie, une thérapie spécifique est effectuée. 31. Choc septique Le choc septique est la pénétration d'un agent infectieux depuis sa source d'origine dans le système sanguin et sa propagation dans tout le corps. Les agents responsables peuvent être : des bactéries staphylococciques, streptococciques, pneumococciques, méningococciques et entérococciques, ainsi que Escherichia, Salmonella et Pseudomonas aeruginosa, etc. Le choc septique s'accompagne d'un dysfonctionnement des systèmes pulmonaire, hépatique et rénal, d'une violation de la coagulation sanguine. système, ce qui conduit à l'apparition d'un syndrome thrombohémorragique (syndrome de Machabeli), qui se développe dans tous les cas de sepsis. L'évolution de la septicémie est influencée par le type d'agent pathogène, ce qui est particulièrement important avec les méthodes de traitement modernes. Les résultats de laboratoire indiquent une anémie progressive (due à l'hémolyse et à l'inhibition de l'hématopoïèse). Leucocytose jusqu'à 12 χ 109/l, cependant, dans les cas graves, lorsqu'une forte dépression des organes hématopoïétiques se forme, une leucopénie peut également être observée. Symptômes cliniques du choc bactérien : frissons, forte fièvre, hypotension, peau sèche et chaude - au début, puis plus tard - froide et humide, pâleur, cyanose, trouble de l'état mental, vomissements, diarrhée, oligurie. Caractérisé par une neutrophilie avec un déplacement de la formule leucocytaire vers la gauche jusqu'aux myélocytes ; L'ESR augmente à 30-60 mm/h ou plus. Le niveau de bilirubine sanguine est augmenté (jusqu'à 35-85 µmol/l), ce qui s'applique également à la teneur en azote résiduel dans le sang. La coagulation sanguine et l'indice de prothrombine sont abaissés (jusqu'à 50-70%), la teneur en calcium et en chlorures est réduite. La protéine sanguine totale est réduite, ce qui est dû à l'albumine, et le niveau de globulines (alpha globulines et β - globulines) augmente. Dans l'urine, les protéines, les leucocytes, les érythrocytes et les cylindres. Le niveau de chlorures dans l'urine est réduit et l'urée et l'acide urique sont élevés. Le traitement est principalement de nature étiologique. Par conséquent, avant de prescrire un traitement antibactérien, il est nécessaire de déterminer l'agent pathogène et sa sensibilité aux antibiotiques. Les agents antimicrobiens doivent être utilisés aux doses maximales. Pour traiter le choc septique, il est nécessaire d'utiliser des antibiotiques couvrant tout le spectre des micro-organismes à Gram négatif. La plus rationnelle est l'association de ceftazidime et d'impinem, qui se sont révélées efficaces contre Pseudomonas aeruginosa. Des médicaments tels que la clindamycine, le métronidazole, la ticarcilline ou l'imipinem sont utilisés comme médicaments de choix lorsqu'un agent pathogène résistant apparaît. Si des staphylocoques sont cultivés à partir du sang, il est impératif de commencer un traitement avec des médicaments à base de pénicilline. Le traitement de l'hypotension consiste dans la première étape du traitement à déterminer l'adéquation du volume de liquide intravasculaire. Utiliser des solutions cristalloïdes (solution isotonique de chlorure de sodium, Ringerlactate) ou des colloïdes (albumine, dextrane, polyvinylpyrrolidone). L'avantage des colloïdes est que lors de leur introduction, les pressions de remplissage requises sont atteintes le plus rapidement possible et le restent longtemps. S'il n'y a aucun effet, un soutien inotrope et (ou) des médicaments vasoactifs sont utilisés. 32. Intoxication à l'alcool méthylique L'alcool méthylique est absorbé par toutes les voies : respiratoire, digestive et transdermique. La dose mortelle de méthanol lorsqu'elle est prise par voie orale varie de 40 à 250 ml, mais même en prendre 10 à 20 ml peut provoquer la cécité. L'empoisonnement survient également après la prise de divers mélanges alcoolisés contenant de 1,5 à 2,5 % de méthanol. Une fois absorbé, le méthanol est distribué dans tous les tissus en raison de sa solubilité dans l’eau. La plus grande quantité s’accumule dans les reins et le tractus gastro-intestinal, la plus petite quantité dans le cerveau, les muscles et le tissu adipeux. Les lésions anatomiques pathologiques comprennent un œdème cérébral et des lésions de la nature initialement inflammatoire, puis dystrophique, des cellules ganglionnaires rétiniennes. Dans certains cas, en plus des dommages au système nerveux, des lésions dégénératives du foie, des reins, des poumons et du muscle cardiaque sont découvertes. Dans l'effet toxique du méthanol, une action en deux phases peut être distinguée. Dans la période initiale (phase I), le méthanol agit sur l'organisme comme une molécule entière et a un effet majoritairement narcotique, mais plus faible que celui de l'alcool éthylique. Par la suite (phase II), l'effet néfaste des produits d'oxydation se manifeste. Dans le tableau clinique, on distingue les périodes: intoxication, bien-être latent ou relatif (d'une durée de plusieurs heures à 1-2 jours), les principales manifestations d'intoxication et, avec une évolution favorable, un développement inverse. Selon la gravité, on distingue légère, modérée (ou ophtalmique) et sévère (ou généralisée). En cas d'intoxication légère, on note une fatigue rapide, des maux de tête, des nausées et un état d'intoxication légère, qui surviennent après une période de latence de 30 minutes à plusieurs heures. L'absorption simultanée d'alcool éthylique et méthylique augmente la période de latence et réduit la gravité de l'intoxication. Traitement 1. Arrêter l'entrée de poison dans le corps. Cessation de l'utilisation de poison, élimination de l'atmosphère contaminée, élimination du poison de la peau. 2. Élimination du poison non absorbé (du tractus gastro-intestinal): 1) sonde de lavage gastrique ; 2) l'utilisation d'adsorbants ou de laxatifs salins ; 3) lavement nettoyant ou siphon. 3. Élimination du poison absorbé : 1) forcer la diurèse ; 2) méthodes de désintoxication extracorporelle (hémosorption, hémodialyse, dialyse péritonéale, chirurgie de remplacement du sang). 4. Traitement antidote, c'est-à-dire neutralisation du poison par neutralisation physique ou chimique, ainsi que compétition avec le poison pour les points d'application. 5. Maintenir les fonctions vitales du corps. 6. Normalisation de l'état eau-électrolyte, acido-basique du corps. 7. Traitement des conséquences à long terme et des complications. 33. Intoxication à l'alcool éthylique et à l'éthylène glycol Lors de la prise de doses toxiques - agitation, ataxie, stupeur, coma avec inhibition des réflexes, odeur d'alcool de la bouche, rougeur du visage, conjonctivite, "jeu" des pupilles, vomissements, miction involontaire, tachycardie, respiration "rauque" , collapsus, vomissements avec aspiration possible de masse émétique. traitement Lavage gastrique à travers une sonde épaisse, suivi de l'introduction d'un laxatif salin, lavement au siphon. Par voie sous-cutanée 1 ml d'une solution à 0,1% d'atropine, 2 ml de cordiamine, 1 ml d'une solution à 20% de caféine, avec collapsus - par voie intramusculaire 1 ml d'une solution à 1% de mezaton. En l'absence de réflexes pharyngés - intubation trachéale et ventilation mécanique. Forcer la diurèse avec l'administration simultanée d'une solution de bicarbonate de sodium à 4% dans un volume calculé selon la formule d'Astrup, de solutions de glucose hypertoniques (10 et 20%) avec insuline, vitamines B et C, cocarboxylase, acide nicotinique. Avec dépression respiratoire - lentement par voie intraveineuse 3-5 ml d'une solution à 1,5% d'étimizol, 10 ml d'une solution à 2,4% d'aminophylline, 1 ml d'une solution à 5% d'éphédrine, inhalation d'oxygène. Avec aspiration - bronchoscopie d'assainissement d'urgence. Antibiotiques parentéraux. Intoxication à l'éthylène glycol (antigel) La dose létale moyenne est d'environ 100 ml. Il est rapidement absorbé dans le tube digestif et distribué dans tous les tissus, créant une concentration maximale dans le cerveau. Le principal effet toxique est observé dans le parenchyme rénal, où se développent une nécrose de l'épithélium tubulaire, un œdème interstitiel et des foyers de nécrose hémorragique dans la couche corticale. L'œdème se trouve dans le cerveau. Dans la clinique de l'intoxication, on distingue 3 périodes : 1) initial - durant jusqu'à 12 heures, les symptômes de lésions du SNC par le type d'intoxication alcoolique prédominent; 2) neurotoxique - lorsque les symptômes de l'atteinte du SNC progressent et que les troubles des systèmes respiratoire et cardiovasculaire se rejoignent ; 3) néphrotoxique - du 2e au 5e jour, les lésions rénales prédominent dans le tableau clinique de l'intoxication. traitement Lavage gastrique avec de l'eau ou une solution de bicarbonate de sodium à 2 %, suivi de l'introduction de 30 g de sulfate de magnésium dans 200 ml d'eau. À l'intérieur de 200 ml d'une solution à 30% d'alcool éthylique. 3-5 g de bicarbonate de sodium dans 100 ml d'eau. Boisson abondante. Par voie intramusculaire 1-2 ml de cordiamine, 1 ml d'une solution de caféine à 20%. Par voie intraveineuse 400 ml de solution de glucose à 5% avec 5 ml de solution d'acide ascorbique à 5% et 8 UI d'insuline, mélange glucosone-vocaïne, 400 ml de polyglucine, 400 ml d'hémodez, 80-120 g de furosémide, 60-100 mg de prednisolone. 34. Empoisonnement au dichloroéthane Les principales voies d'entrée sont le tube digestif, les voies respiratoires et la peau. La dose létale de DCE pour l'homme lorsqu'il est administré par voie orale est de 10 à 20 ml. L'effet toxique du DCE est dû à l'effet narcotique sur le système nerveux central, aux dommages au foie, aux reins, au tractus gastro-intestinal et à un effet prononcé sur le système cardiovasculaire. Dans le tableau clinique, les principaux symptômes sont les suivants : encéphalopathie toxique, gastrite et gastro-entérite aiguë toxique, altération de la respiration externe, hépatite toxique, altération de la fonction rénale. Dans les premières heures suivant l'administration, apparaissent des vertiges, une ataxie, une agitation psychomotrice, des convulsions toniques cloniques, une dépression de la conscience, pouvant aller jusqu'au coma. L'un des premiers signes d'empoisonnement sont des troubles gastro-intestinaux sous forme de nausées, de vomissements répétés avec un mélange de bile. La violation de la fonction de la respiration externe se produit souvent selon le type d'aspiration obstructive et est associée à une augmentation de la salivation, de la bronchorrhée et de l'aspiration. On note l'inhibition de la fonction du centre respiratoire, le développement de l'hypertonicité des muscles respiratoires et la rigidité de la poitrine. traitement En cas d'empoisonnement aux vapeurs - éloignement de la victime de la zone touchée, avec dépression respiratoire IVL. Si le poison pénètre à l'intérieur - lavage gastrique à travers une sonde épaisse, suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre dans 200 ml d'eau et 150-200 ml d'huile de vaseline, lavement au siphon. Par voie intraveineuse 20-40 ml de solution de thiosulfate de sodium à 30%, par voie intramusculaire 5 ml de solution d'unitiol à 5%. par voie intraveineuse 400 ml de polyglucine, 400 ml d'hémodez, 400 ml de solution de glucose à 5%, 80-120 mg de furosémide (lasix), 6-8 ml de solution à 5% d'acide ascorbique. Par voie intramusculaire 2 ml de cordiamine, avec collapsus - 1 ml d'une solution à 1% de mezaton, 1 ml d'une solution à 20% de caféine, 100-150 mg de prednisolone. Avec une augmentation de l'insuffisance hépatique-rénale, un traitement spécifique est effectué. Bolus intraveineux 400 ml de polyglucine, 400 ml d'hémodez, 400 ml de glucose à 5%, 80-120 mg de furosémide, 6-8 ml d'acide ascorbique à 5%, 100-150 mg de prednisolone, pour collapsus 1 ml de 1% mésatone. Par voie intramusculaire, 2 à 4 ml de bromure de thiamine à 6 % et 2 à 4 ml de pyridoxine à 5 %. Pour l'agitation psychomotrice, 1 ml de solution de phénozépam à 3%. Inhalation d'oxygène, en cas de dépression respiratoire - ventilation mécanique par un tube respiratoire. Lors du premier jour, la méthode la plus efficace et la plus économe est la dialyse péritonéale. La composition de la solution de dialyse standard comprend : chlorure de potassium 0,3 g, chlorure de sodium 8,3 g, chlorure de magnésium 0,1 g, chlorure de calcium 0,3 g, glucose 6 g pour 1 litre d'eau. Dans le même temps, jusqu'à 2 litres de solution d'électrolyte additionnés de 500 1000 unités de pénicilline et XNUMX XNUMX unités d'héparine sont injectés dans la cavité abdominale du patient. 35. Empoisonnement au poison de champignon et au venin de serpent Après une période de latence d'une durée de 1-2 à 36 heures, des crampes abdominales, une salivation, des nausées, des vomissements indomptables, une diarrhée, une déshydratation, un collapsus, un délire, des hallucinations, des convulsions apparaissent. Le 2-3ème jour - les phénomènes d'insuffisance rénale-hépatique avec anurie, azotémie, jaunisse. En cas d'intoxication grave aux lignes et aux morilles, une hémolyse est possible. traitement Lavage gastrique à travers une sonde épaisse, suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre dans 200 ml d'eau et 30 g de sulfate de magnésium (sodium) dans 100 ml d'eau, lavement au siphon. En sous-cutané 1 ml d'une solution à 0,1% d'atropine, 2 ml de cordiamine. Dans l'empoisonnement aux morilles, l'atropine n'est pas utilisée comme antidote. Par voie intraveineuse 400 ml de polyglucine, 400 ml de gemodez, 400 ml de solution de glucose à 5% avec 4-6 ml de solution d'acide ascorbique à 5%, 80-120 mg de furosémide (lasix). Par voie intramusculaire 1-2 ml d'une solution à 6% de bromure de thiamine et 2 ml d'une solution à 5% de chlorhydrate de pyridoxine (ne pas injecter dans une seule seringue). Soulagement du syndrome douloureux par voie intramusculaire avec l'introduction de 1 ml d'une solution à 0,2% de platifilline, 2 ml d'une solution à 2% de papavérine. Avec convulsions, agitation psychomotrice - par voie intramusculaire 1-2 ml d'une solution à 3% de fénozépam ou d'un mélange lytique (1-2 ml d'une solution à 2,5% de chlorpromazine, 1-2 ml d'une solution à 1% de diphenhydramine, 5-10 ml de solution à 25 % de sulfate de magnésium) sous contrôle de la pression artérielle. Forcer la diurèse. Dans les cas graves - hémosorption, hémodialyse précoce. Thérapie symptomatique. Empoisonnement au venin de serpent Douleur et gonflement se propageant rapidement au site de la morsure, somnolence, dépression respiratoire, collapsus, hémolyse intravasculaire avec hémoglobinurie, hémorragies sous-cutanées sévères, parfois convulsions. Possible insuffisance rénale. Avec une morsure de cobra, les changements locaux sont moins prononcés, les troubles bulbaires (troubles de la parole et de la déglutition, ptosis, paralysie des muscles moteurs) et la dépression respiratoire prédominent. traitement Aspiration du sang et de la lymphe de la plaie (au plus tard 30 à 60 minutes après la morsure) formée au site de la morsure à l'aide d'un pot suceur de sang. Rincer la plaie avec une solution à 1% de permanganate de potassium. Injection dans la plaie de 0,3 à 0,5 ml d'une solution à 0,1% d'adrénaline. Si possible, administration urgente de sérum spécifique antiserpent mono- ou polyvalent après administration intraveineuse préalable de 100-150 ml d'hydrocortisone ou 50-100 ml de prednisolone. En cas de morsures de cobra - sérum Anticobra par voie intraveineuse à la dose de 300 ml en association avec 1 ml d'une solution à 0,05% de prozérine et administration répétée toutes les 30 minutes avec 1 ml d'une solution à 0,1% d'atropine. 36. Empoisonnement à l'acide et à l'arsenic L'inhalation de vapeurs provoque une irritation des yeux et des voies respiratoires supérieures (larmoiement, nez qui coule, toux, essoufflement). Un arrêt respiratoire réflexe est possible. Après une période de latence (de 2 à 24 heures), une pneumonie toxique ou un œdème pulmonaire toxique se forme. Au coup dans les yeux, sur la peau - les brûlures chimiques. En cas d'ingestion - brûlure chimique de la cavité buccale, du pharynx, de l'œsophage, de l'estomac, gonflement possible du larynx avec insuffisance respiratoire. Vomissements répétés avec du sang, irritation péritonéale et parfois perforation de l'œsophage ou de l'estomac. Effondrement, choc, syndrome hémorragique. Hémolyse intravasculaire possible, néphrose hémoglobinurique avec insuffisance rénale aiguë (réno-hépatique). Le lavage gastrique sans tube et les vomissements artificiels sont dangereux en raison de la possibilité de rebrûler l'œsophage et d'aspiration acide. Ne pas injecter de solutions salines laxatives et alcalines. traitement Lavage gastrique à travers une sonde épaisse avec de l'eau froide après une injection intraveineuse ou intramusculaire préalable de 1-2 ml d'une solution à 2% de promedol. A l'intérieur des morceaux de glace, Almagel A 15-20 ml toutes les heures. Par voie intraveineuse 800 ml de polyglucine, 400 ml d'hémodez, mélange glucosone-vocaïne (400 ml de solution de glucose à 5% avec 25 ml de solution de novocaïne à 2%), 50-150 mg de prednisolone ou 150-250 mg d'hydrocortisone, 10 80 unités d'héparine, 120-XNUMX mg de furosémide (Lasix). Le soulagement de la douleur est obtenu par injection intraveineuse de 1 à 2 ml de solution de fentanyl à 0,005 % et de 2 à 4 ml de solution de dropéridol à 0,25 %, en cas de douleurs abdominales persistantes - injection intramusculaire de 1 à 2 ml de solution de platyphylline à 0,2 %, 2 ml de 2 % solution de papavérine. Inhalation d'oxygène avec agent antimousse. Avec gonflement croissant du larynx - par voie intraveineuse 200 à 400 mg de prednisolone, 1 à 2 ml d'une solution à 1% de diphenhydramine, 10 à 20 ml d'une solution à 2,4% d'aminophylline, 1 à 2 ml d'une solution à 5% d'éphédrine . S'il n'y a aucun effet, trachéotomie, inhalation d'oxygène et, si indiqué, ventilation mécanique. Intoxication à l'arsenic et à ses composés : goût métallique dans la bouche, douleurs abdominales, vomissements, selles molles, déshydratation sévère, convulsions, tachycardie, diminution de la tension artérielle, coma, insuffisance rénale aiguë. L'hémolyse intravasculaire et l'hémoglobinurie se développent en cas d'intoxication par l'arsenic et l'hydrogène. traitement Lavage gastrique à travers un tube épais (2-3 fois par jour) avec introduction au début et à la fin du lavage de 50 ml d'une solution à 5% d'unithiol, lavements répétés au siphon avec addition d'unithiol. Poursuite du traitement antidote par voie intraveineuse ou intramusculaire avec l'introduction d'une solution à 5% d'unitiol (jusqu'à 300 ml par jour), goutte à goutte intraveineuse de 20 ml de tétacine de calcium à 10% (ED1A) dans 400 ml d'une solution de glucose à 5%. 37. Empoisonnement avec alcali, atropine, cannabis empoisonnement alcalin En cas d'ingestion, une brûlure chimique de la membrane muqueuse de la cavité buccale, de l'œsophage et de l'estomac se développe. Douleur le long de l'œsophage et dans l'abdomen, vomissements avec du sang, saignement œsophagien-gastrique. Perforation possible de l'œsophage, de l'estomac avec développement d'une médiastinite, d'une péritonite. Avec une brûlure du larynx - enrouement de la voix, aphonie, difficulté à respirer (stridor). Dans les cas graves - choc de brûlure, oligurie. Le contact avec la peau provoque des brûlures chimiques. Traiter comme dans un empoisonnement acide. Empoisonnement à l'atropine Bouche sèche, enrouement, peau sèche et hyperémique, pupilles dilatées, essoufflement, palpitations, tachycardie, soif, nausées, difficulté à uriner. En cas d'intoxication grave - agitation psychomotrice, délire, hallucinations, convulsions, troubles du rythme cardiaque, coma, collapsus sont possibles. traitement Si nécessaire - lavage gastrique à travers une sonde épaisse, richement lubrifiée avec de l'huile de vaseline, l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre dans 200 ml d'eau et 30 mg de sulfate de magnésium dans 100 ml d'eau. par voie intraveineuse 2-4 ml de solution de prosérine à 0,05%, 400-800 ml de solution de glucose à 5%, 40-80 mg de furosémide (lasix). Boisson abondante. Soulagement de l'agitation psychomotrice et des convulsions par voie intramusculaire en administrant 1 à 2 ml d'une solution à 3 % de phénozépam ou un mélange lytique (2 ml d'une solution d'aminazine à 2,5 %, 2 ml d'une solution à 1 % de diphenhydramine et 10 ml d'une solution à 25 % solution de sulfate de magnésium ) ou 1-2 g d'hydrate de chloral dans un lavement avec 1-2 g d'amidon pour 25-50 ml d'eau, par voie intraveineuse 10-15 ml d'une solution à 20 % d'hydroxybutyrate de sodium, 2-4 ml d'une solution à 0,5% de seduxen. Avec tachycardie sévère, extrasystole - anapriline par voie intraveineuse (1-2 ml d'une solution à 0,25%) ou un comprimé d'anapriline (40 mg) sous la langue. Avec collapsus - par voie intraveineuse 1 ml d'une solution à 1% de mezaton dans 10 ml d'une solution à 0,9% de chlorure de sodium. Avec une hyperthermie aiguë - par voie intramusculaire 2 ml d'une solution à 50% d'analgine, des packs de glace sur les gros vaisseaux et la tête, des enveloppements humides. Intoxication au cannabis (haschisch, marijuana, marijuana, plan) Il y a euphorie, agitation psychomotrice, hallucinations visuelles vives, pupilles dilatées, acouphènes. Par la suite, faiblesse, léthargie, dépression de l'humeur, somnolence, bradycardie, hypothermie. traitement En cas d'empoisonnement oral - lavage gastrique à travers une sonde épaisse, suivi de l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre dans 200 ml d'eau. Par voie intraveineuse 400-800 ml d'une solution de glucose à 5% avec 5-10 ml d'une solution à 5% d'acide ascorbique et 8-16 unités d'insuline, 40-80 mg de furosémide (lasix), par voie intramusculaire 2 ml d'une solution à 6% de bromure de thiamine. 38. Empoisonnement à la cocaïne, à la dicaïne, aux analgésiques narcotiques empoisonnement à la cocaïne Elle se manifeste cliniquement par une agitation générale, des maux de tête, une rougeur du visage, des pupilles dilatées, une tachycardie, une respiration accrue, une augmentation de la pression artérielle, des hallucinations. Dans les cas graves - convulsions, coma, paralysie respiratoire, collapsus. Lavage gastrique répété à travers une sonde épaisse avec une solution à 0,1% de permanganate de potassium, suivi de l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre dans 200 ml d'eau et 30 g de sulfate de magnésium dans 100 ml d'eau. Par voie intraveineuse 400 ml de gemodez, 400 ml de solution de glucose à 5% avec 5-10 ml de solution d'acide ascorbique à 5%, 40-80 mg de furosémide (lasix). Lorsqu'il est excité - fixation de la victime, par voie intramusculaire 1-2 ml d'une solution à 3% de fénozépam ou d'un mélange lytique (1-2 ml d'une solution à 2,5% de chlorpromazine, 2 ml d'une solution à 1% de diphenhydramine et 5-10 ml de 25% - une solution de sulfate de magnésium) sous le contrôle de la pression artérielle. Avec des convulsions, 1-2 g d'hydrate de chloral sont administrés dans un lavement avec 1-2 g d'amidon dans 25-50 ml d'eau, par voie intraveineuse lentement 15-20 ml d'une solution d'oxybutyrate de sodium à 20%, s'il n'y a pas d'effet, lentement par voie intramusculaire jusqu'à 20 ml d'une solution à 2,5% de thiopental sodique ou d'hexenal. Avec le développement d'un coma - un sac de glace sur la tête, par voie intraveineuse 40 ml d'une solution de glucose à 40% avec 4-6 ml d'une solution à 5% d'acide ascorbique et 8 unités d'insuline, par voie intraveineuse lente ou intramusculaire 2-4 ml d'une solution à 6% de bromure de thiamine et 2-4 ml d'une solution à 5% de chlorhydrate de pyridoxine, 80-120 mg de furosémide. En cas de dépression respiratoire sévère, une ventilation mécanique est effectuée, par voie intraveineuse lentement 2 ml de cordiamine, inhalation d'oxygène. Intoxication par des analgésiques narcotiques (morphine, omnopon, dropéridol) Somnolence ou inconscience, constriction pupillaire, hypertonicité musculaire (parfois convulsions), dépression respiratoire, bradycardie, collapsus. Une paralysie respiratoire est possible avec la conscience du patient préservée. Lavage gastrique à travers une sonde épaisse (tout en maintenant la conscience), suivi de l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre et 30 g de sulfate de sodium, lavement au siphon. Par voie intraveineuse 400 ml de gemodez, 400 ml de polyglucine, 400 ml de solution de glucose à 5%, 60-80 mg de furosémide (lasix). Par voie sous-cutanée 1-2 ml d'une solution à 0,1% d'atropine, 1-2 ml de cordiamine, 1 ml d'une solution à 20% de caféine. Avec le développement d'un coma - un sac de glace sur la tête, par voie intraveineuse 40 ml d'une solution de glucose à 40% avec 5-10 ml d'une solution à 5% d'acide ascorbique et 8 unités d'insuline, par voie intraveineuse lente ou intramusculaire 2-4 ml d'une solution à 6% de bromure de thiamine et 2-4 ml d'une solution à 5% de chlorhydrate de pyridoxine, 80-120 mg de furosémide (lasix). Si nécessaire - cathétérisme de la vessie et extraction d'urine. Avec dépression respiratoire - IVL, inhalation d'oxygène. Hémosorption (2-3 fois par jour jusqu'à ce que la conscience soit restaurée). 39. Douleur La douleur est un état sensoriel et émotionnel désagréable dû à des effets pathologiques réels ou potentiels sur les tissus. Dans le SNC, la douleur est conduite selon deux voies principales. Chemin spécifique - les cornes postérieures de la moelle épinière, les noyaux spécifiques du thalamus, le cortex du gyrus central postérieur. Cette voie est bas-neuronale, rapide, conductrice de seuil, émotionnellement incolore, précisément localisée (douleur épicritique). Voie non spécifique - les cornes postérieures de la moelle épinière, les noyaux non spécifiques du thalamus, le cortex des lobes frontal et pariétal de manière diffuse. Conduit des douleurs sous-liminaires, émotionnellement colorées, mal localisées. Il est lent, multineuronal, car il forme de nombreuses collatérales au bulbe rachidien, à la formation réticulaire, au système limbique et à l'hippocampe. Les impulsions douloureuses inférieures au seuil subissent une sommation dans le thalamus. Les impulsions conduites le long de la voie de la douleur non spécifique excitent les centres émotionnels du système limbique, les centres autonomes de l'hypothalamus et le bulbe rachidien. Par conséquent, la douleur s'accompagne de peur, d'expériences douloureuses, d'une respiration accrue, d'un pouls, d'une augmentation de la pression artérielle, d'une dilatation des pupilles, de troubles dyspeptiques. L'action du système nociceptif de la douleur est contrecarrée par le système antinoceceptif dont les principaux neurones sont localisés dans la matière grise périaqueducale (l'aqueduc de Sylvius relie les ventricules III et IV). Leurs axones forment des voies descendantes vers le bulbe rachidien et la moelle épinière et des voies ascendantes vers la formation réticulaire, le thalamus, l'hypothalamus, le système limbique, les ganglions de la base et le cortex. Les médiateurs de ces neurones sont des pentapeptides : la méthenképhaline et la leuenképhaline, qui ont respectivement la méthionine et la leucine comme acides aminés terminaux. Les enképhalines excitent les récepteurs opiacés. Dans les synapses enképhalinergiques, les récepteurs opiacés sont situés sur la membrane postsynaptique, mais la même membrane est présynaptique pour les autres synapses. Les récepteurs opiacés sont associés à l'adénylate cyclase et provoquent son inhibition en perturbant la synthèse de l'AMPc dans les neurones. En conséquence, l'entrée de calcium et la libération de médiateurs, y compris les médiateurs de la douleur - les peptides diminuent : substance P, cholécystokinine, somatostatine, acide glutamique. Les récepteurs opiacés sont excités non seulement par des médiateurs - les enképhalines, mais également par d'autres composants du système antinoceceptif - les hormones cérébrales (endorphines). Des agonistes peptidiques des récepteurs opiacés se forment lors de la protéolyse des substances peptidiques du cerveau : proopiocortine, proenképhalines A et B. Tous ces peptides se forment dans l'hypothalamus. Les récepteurs opiacés excitent les récepteurs de toutes les structures cérébrales impliquées dans la conduction et la perception de la douleur, la formation de réactions émotionnellement colorées à la douleur. Dans le même temps, la libération de médiateurs de la douleur diminue et toutes les réactions accompagnant la douleur sont affaiblies. 40. Médicaments analgésiques Un antalgique (acide acétylsalicylique, paracétamol, morphine) est un médicament qui diminue les douleurs d'origines diverses. Les médicaments qui réduisent la douleur provoquée uniquement par un certain facteur causal ou éliminent un syndrome douloureux spécifique, par exemple les antiacides, l'ergotamine (migraine), la carbamazépine (névralgie), la nitroglycérine (angine de poitrine), n'appartiennent pas aux analgésiques classiques. Les corticostéroïdes suppriment la réponse inflammatoire et la douleur qui en résulte, mais malgré leur utilisation répandue à ces fins, ils ne représentent pas non plus des analgésiques classiques. Les analgésiques sont classés en narcotiques, agissant sur les structures du SNC et provoquant une somnolence, comme les opioïdes, et non narcotiques, agissant principalement sur les structures périphériques, comme le paracétamol, l'acide acétylsalicylique. Médicaments supplémentaires qui renforcent l'effet des analgésiques Les médicaments de ce groupe ne sont pas des analgésiques eux-mêmes, mais sont utilisés en association avec des analgésiques contre la douleur, car ils peuvent modifier l'attitude envers la douleur, sa perception et le niveau d'anxiété, de peur, de dépression (les antidépresseurs tricycliques peuvent même entraîner une diminution du besoin de morphine chez un patient en phase terminale). Ces médicaments peuvent être des médicaments psychotropes, ainsi que ceux qui affectent les mécanismes de la douleur, par exemple en éliminant les spasmes des muscles lisses et striés. Les analgésiques narcotiques sont des médicaments à base de plantes et synthétiques qui réduisent sélectivement la perception de la douleur, augmentent la tolérance à la douleur en réduisant la coloration émotionnelle de la douleur et son accompagnement végétatif, provoquent l'euphorie et la toxicomanie. Classification des analgésiques narcotiques et de leurs antagonistes 1. Dérivés de pipéridine-phénanthrène : 1) morphinique ; 2) codéine (méthylmorphine, 5 à 7 fois plus faible que la morphine comme analgésique) ; 3) éthylmorphine (dionine, égale en force à la morphine). 2. Dérivés de phénylpipéridine : 1) promedol (3-4 fois plus faible que la morphine) ; 2) fentanyl (100 à 400 fois plus fort que la morphine). 3. Dérivés du diphénylméthane : 1) pyritramide (dipidolor) - égal à la morphine; 2) tramadol (tramal) - quelque peu inférieur à la morphine. 4. Agonistes-antagonistes : 1) agonistes des récepteurs opiacés et antagonistes des récepteurs opiacés - buprénorphine (norphine) (25 à 30 fois plus puissante que la morphine); 2) agonistes des récepteurs opiacés et antagonistes des récepteurs opiacés - pentazocine (lexir) (2 à 3 fois plus faible que la morphine) et butorphanol (moradol) (égal à la morphine). 41. Étapes de l'anesthésie L'anesthésie générale, ou anesthésie, est un état du corps qui se caractérise par un arrêt temporaire de la conscience d'une personne, de sa sensibilité à la douleur et de ses réflexes, ainsi que par un relâchement des muscles des muscles squelettiques, provoqué par l'action d'analgésiques narcotiques sur le système nerveux central. Selon les voies d'administration des substances narcotiques dans le corps, on distingue l'anesthésie par inhalation et sans inhalation. Il y a 4 étapes d'anesthésie : 1) analgésie ; 2) excitation ; 3) stade chirurgical, subdivisé en 4 niveaux ; 4) stade d'éveil. Stade de l'analgésie Le patient est conscient, mais une certaine léthargie est notée, il somnole, répond aux questions par monosyllabes. Les sensibilités superficielles et douloureuses sont absentes, mais quant aux sensibilités tactile et thermique, elles sont préservées. À ce stade, des interventions chirurgicales à court terme sont effectuées, telles que l'ouverture du phlegmon, des abcès, des études diagnostiques, etc. Le stade est à court terme et dure 3 à 4 minutes. Stade d'excitation À ce stade, les centres du cortex cérébral sont inhibés et les centres sous-corticaux sont à ce moment dans un état d'excitation. Dans le même temps, la conscience du patient est complètement absente, une excitation motrice et vocale prononcée est notée. Les patients commencent à crier, tentent de se lever de la table d'opération. On note une hyperémie de la peau, le pouls devient fréquent, la pression artérielle systolique augmente. La pupille de l'œil s'élargit, mais la réaction à la lumière persiste, on note un larmoiement. Il y a souvent une toux, une sécrétion bronchique accrue, parfois des vomissements. Une intervention chirurgicale dans le contexte de l'excitation ne peut pas être effectuée. Pendant cette période, vous devez continuer à saturer le corps avec un narcotique pour améliorer l'anesthésie. La durée de l'étape dépend de l'état général du patient et de l'expérience de l'anesthésiste. Typiquement, la durée d'excitation est de 7 à 15 minutes. Stade chirurgical Avec le début de cette étape de l'anesthésie, le patient se calme, la respiration devient calme et régulière, la fréquence cardiaque et la tension artérielle approchent de la normale. Pendant cette période, des interventions chirurgicales sont possibles. Selon la profondeur de l'anesthésie, on distingue 4 niveaux et le stade III d'anesthésie. Premier niveau : le patient est calme, le nombre de mouvements respiratoires, le nombre de battements cardiaques et la tension artérielle se rapprochent des valeurs initiales. La pupille commence progressivement à se rétrécir, sa réaction à la lumière est préservée. Deuxième niveau : le mouvement des globes oculaires est arrêté, ils sont fixés en position centrale. Les pupilles se dilatent et leur réaction à la lumière s'affaiblit. Le tonus musculaire est réduit, ce qui permet des opérations abdominales. Le troisième niveau est caractérisé comme une anesthésie profonde. Dans le même temps, les pupilles des yeux se dilatent en réaction à un fort stimulus lumineux. L'anesthésie au quatrième niveau met la vie du patient en danger, car un arrêt respiratoire et circulatoire peut survenir. Phase d'éveil Dès que l'introduction de stupéfiants s'arrête, que leur concentration dans le sang diminue et que le patient traverse toutes les étapes de l'anesthésie dans l'ordre inverse, le réveil se produit. 42. Préparation du patient pour l'anesthésie L'anesthésiste joue un rôle direct et souvent principal dans la préparation du patient à l'anesthésie et à la chirurgie. Un moment obligatoire est l'examen du patient avant l'opération, mais en même temps, non seulement la maladie sous-jacente, pour laquelle la chirurgie doit être effectuée, mais aussi la présence de maladies concomitantes, que l'anesthésiste demande en détail, est important . Il est nécessaire de savoir comment le patient a été traité pour ces maladies, l'effet du traitement, la durée du traitement, la présence de réactions allergiques, l'heure de la dernière exacerbation. Si le patient subit une intervention chirurgicale de manière planifiée, alors, si nécessaire, une correction des maladies concomitantes existantes est effectuée. L'assainissement de la cavité buccale est important en présence de dents mobiles et cariées, car elles peuvent être une source d'infection supplémentaire et indésirable. L'anesthésiste découvre et évalue l'état psychoneurologique du patient. Ainsi, par exemple, dans la schizophrénie, l'utilisation de drogues hallucinogènes (kétamine) est contre-indiquée. La chirurgie pendant la période de psychose est contre-indiquée. En présence d'un déficit neurologique, il est préalablement corrigé. Les antécédents allergiques sont d'une grande importance pour l'anesthésiste, pour cela, l'intolérance aux médicaments, ainsi qu'aux aliments, aux produits chimiques ménagers, etc. est spécifiée. Si le patient présente une anamnèse allergique aggravée, même pas aux médicaments, pendant l'anesthésie, une réaction allergique pouvant aller jusqu'au choc anaphylactique peut se développer. Par conséquent, des agents désensibilisants (diphénhydramine, suprastine) sont introduits en grande quantité dans la prémédication. Un point important est la présence d'un patient dans les opérations et l'anesthésie passées. Il s'avère quelle était l'anesthésie et s'il y a eu des complications. L'attention est attirée sur l'état somatique du patient: la forme du visage, la forme et le type de la poitrine, la structure et la longueur du cou, la sévérité de la graisse sous-cutanée, la présence d'œdèmes. Tout cela est nécessaire pour choisir la bonne méthode d'anesthésie et de médicaments. La première règle pour préparer un patient à l'anesthésie lors de toute opération et lors de l'utilisation de toute anesthésie est le nettoyage du tractus gastro-intestinal (l'estomac est lavé à travers la sonde, des lavements nettoyants sont effectués). Pour supprimer la réaction psycho-émotionnelle et supprimer l'activité du nerf vague, avant la chirurgie, le patient reçoit un médicament - une prémédication. La nuit, le phénazépam est prescrit par voie intramusculaire. Les patients ayant un système nerveux labile se voient prescrire des tranquillisants (seduxen, relanium) un jour avant la chirurgie. 40 minutes avant l'intervention, des analgésiques narcotiques sont injectés par voie intramusculaire ou sous-cutanée : 1 ml d'une solution à 1-2 % de promolol ou 1 ml de pentozocine (lexir), 2 ml de fentanyl ou 1 ml de morphine à 1 %. Pour supprimer la fonction du nerf vague et réduire la salivation, 0,5 ml d'une solution à 0,1% d'atropine est administrée. 43. Anesthésie intraveineuse et par inhalation Les avantages de l'anesthésie générale intraveineuse sont l'introduction rapide du patient en anesthésie. Avec ce type d'anesthésie, il n'y a pas d'excitation et le patient s'endort rapidement. Mais les stupéfiants utilisés pour l'administration intraveineuse créent une anesthésie à court terme, ils ne peuvent donc pas être utilisés sous leur forme pure comme mononarcose pour des opérations à long terme. Les barbituriques - thiopental sodique et hexénal - sont capables d'induire rapidement un sommeil narcotique, alors qu'il n'y a pas de stade d'excitation et que le réveil est rapide. Les tableaux cliniques de l'anesthésie réalisée par le thiopental sodique et l'hexénal sont similaires. Geksenal a un effet moins inhibiteur sur le centre respiratoire. Des solutions fraîchement préparées de dérivés d'acide barbiturique sont utilisées. En chirurgie, l'anesthésie avec des barbituriques comme mononarcose est utilisée pour des opérations de courte durée qui ne dépassent pas 20 minutes (par exemple, ouverture d'abcès, phlegmon, réduction de luxations, manipulations diagnostiques et repositionnement de fragments osseux). Les dérivés de l'acide barbiturique sont également utilisés pour l'anesthésie par induction. L'hydroxybutyrate de sodium est administré par voie intraveineuse très lentement. Le médicament crée une anesthésie superficielle, il est donc souvent utilisé en association avec d'autres stupéfiants, tels que les barbituriques - propanidide. Il est souvent utilisé pour l'anesthésie par induction. La kétamine peut être utilisée pour la mononarcose et pour l'anesthésie par induction. Le médicament provoque un sommeil superficiel, stimule l'activité du système cardiovasculaire (la pression artérielle augmente, le pouls s'accélère). L'anesthésie par inhalation est réalisée à l'aide de liquides (volatils) qui s'évaporent facilement - éther, halothane, méthoxy-flurane (pentran), trichloroéthylène, chloroforme ou substances narcotiques gazeuses - protoxyde d'azote, cyclopropane. Avec la méthode d'anesthésie endotrachéale, la substance narcotique pénètre dans le corps à partir de la machine d'anesthésie par un tube inséré dans la trachée. L'avantage de la méthode est qu'elle offre une perméabilité libre des voies respiratoires et peut être utilisée dans des opérations sur le cou, le visage, la tête, élimine la possibilité d'aspiration de vomi, de sang; réduit la quantité de drogue utilisée; améliore les échanges gazeux en réduisant l'espace "mort". L'anesthésie endotrachéale est indiquée pour les interventions chirurgicales majeures, elle est utilisée comme une anesthésie à plusieurs composants avec des myorelaxants (anesthésie combinée). L'utilisation totale de plusieurs médicaments à petites doses réduit les effets toxiques sur l'organisme de chacun d'eux. L'anesthésie mixte moderne est utilisée pour fournir une analgésie, éteindre la conscience, la relaxation. L'analgésie et l'extinction de la conscience sont réalisées en utilisant une ou plusieurs substances narcotiques - inhalées ou non inhalées. L'anesthésie est réalisée au premier niveau de la phase chirurgicale. La relaxation musculaire, ou relaxation, est obtenue par l'administration fractionnée de relaxants musculaires. 44. Étapes de l'anesthésie Il y a trois étapes d'anesthésie. 1. Introduction à l'anesthésie. L'anesthésie d'introduction peut être réalisée avec n'importe quelle substance narcotique, contre laquelle un sommeil anesthésique assez profond se produit sans stade d'éveil. On utilise principalement des barbituriques, du fentanyl en combinaison avec du sombrevin, moulu avec du sombrevin. Le thiopental sodique est également souvent utilisé. Les médicaments sont utilisés sous la forme d'une solution à 1%, ils sont administrés par voie intraveineuse à une dose de 400-500 mg. Dans le contexte de l'anesthésie par induction, des relaxants musculaires sont administrés et une intubation trachéale est réalisée. 2. Maintien de l'anesthésie. Pour maintenir l'anesthésie générale, vous pouvez utiliser n'importe quel narcotique capable de protéger le corps contre les traumatismes chirurgicaux (halothane, cyclopropane, protoxyde d'azote avec oxygène), ainsi que la neurolepta-nalgésie. L'anesthésie est maintenue aux premier et deuxième niveaux de la phase chirurgicale et des relaxants musculaires sont administrés pour éliminer les tensions musculaires, qui provoquent une myoplégie de tous les groupes musculaires squelettiques, y compris les respiratoires. Par conséquent, la condition principale de la méthode d'anesthésie combinée moderne est la ventilation mécanique, qui est réalisée en pressant rythmiquement un sac ou une fourrure, ou en utilisant un appareil de respiration artificielle. Récemment, la neuroleptanalgésie la plus répandue. Avec cette méthode, l'oxyde nitreux avec de l'oxygène, du fentanyl, du dropéridol, des relaxants musculaires sont utilisés pour l'anesthésie. Anesthésie d'introduction intraveineuse. L'anesthésie est maintenue par inhalation de protoxyde d'azote avec de l'oxygène dans un rapport de 2: 1, administration intraveineuse fractionnée de fentanyl et de dropéridol 1-2 ml toutes les 15-20 minutes. Avec une fréquence cardiaque accrue, le fentanyl est administré, avec une augmentation de la pression artérielle - dropéridol. Ce type d'anesthésie est plus sûr pour le patient. Le fentanyl améliore le soulagement de la douleur, le dropéridol supprime les réactions végétatives. 3. Retrait de l'anesthésie. À la fin de l'opération, l'anesthésiste arrête progressivement l'administration de substances narcotiques et de relaxants musculaires. La conscience revient au patient, la respiration indépendante et le tonus musculaire sont restaurés. Les critères d'évaluation de l'adéquation de la respiration spontanée sont les indicateurs de PO2, PCO2 et pH. Après réveil, rétablissement de la respiration spontanée et du tonus musculaire squelettique, l'anesthésiste peut extuber le patient et le transporter pour une observation plus approfondie en salle de réveil. Pendant l'anesthésie générale, les principaux paramètres de l'hémodynamique sont constamment déterminés et évalués. Mesurez la tension artérielle, le pouls toutes les 10 à 15 minutes. Chez les personnes atteintes de maladies du système cardiovasculaire, ainsi que lors d'opérations thoraciques, il est nécessaire de surveiller en permanence la fonction du muscle cardiaque. L'observation électroencéphalographique peut être utilisée pour déterminer le niveau d'anesthésie. Pour contrôler la ventilation pulmonaire et les changements métaboliques pendant l'anesthésie et la chirurgie, il est nécessaire d'étudier l'état acido-basique (PO2, PCO2, pH, BE). 45. Complications de l'anesthésie Des complications pendant l'anesthésie peuvent survenir en raison d'une mauvaise technique d'anesthésie ou de l'effet des anesthésiques sur les organes vitaux. Une de ces complications est le vomissement. Au début de l'introduction de l'anesthésie, les vomissements peuvent être associés à la nature de la maladie dominante (sténose pylorique, occlusion intestinale) ou à l'effet direct du médicament sur le centre du vomissement. Dans le contexte des vomissements, l'aspiration est dangereuse - l'entrée du contenu gastrique dans la trachée et les bronches. Le contenu gastrique qui a une réaction acide prononcée, tombant sur les cordes vocales puis pénétrant dans la trachée, peut entraîner un laryngospasme ou un bronchospasme, entraînant une insuffisance respiratoire avec hypoxie ultérieure - c'est ce que l'on appelle le syndrome de Mendelssohn, accompagné de cyanose, bronchospasme, tachycardie. La régurgitation peut être dangereuse - rejet passif du contenu gastrique dans la trachée et les bronches. Des complications du système respiratoire peuvent survenir en raison d'une altération de la perméabilité des voies respiratoires. Cela peut être dû à des défauts de l'appareil d'anesthésie. Les complications de l'intubation trachéale réalisée par laryngoscopie directe peuvent être regroupées comme suit : 1) dommages aux dents par la lame du laryngoscope; 2) dommages aux cordes vocales ; 3) introduction d'un tube endotrachéal dans l'œsophage ; 4) introduction d'un tube endotrachéal dans la bronche droite ; 5) sortie du tube endotrachéal de la trachée ou en le pliant. Les troubles du rythme cardiaque (tachycardie ventriculaire, extrasystole, fibrillation ventriculaire) peuvent survenir pour plusieurs raisons : 1) hypoxie et hypercapnie résultant d'une intubation prolongée ou d'une ventilation insuffisante pendant l'anesthésie ; 2) surdosage de substances narcotiques - barbituriques, halothane; 3) l'utilisation d'adrénaline sur fond de fluorotane, ce qui augmente la sensibilité du fluorotane aux catécholamines. Lésions nerveuses périphériques Cette complication survient un jour ou plus après l'anesthésie. Le plus souvent, les nerfs des membres supérieurs et inférieurs et le plexus brachial sont endommagés. Ceci est la conséquence d'une mauvaise position du patient sur la table d'opération (abduction du bras à plus de 90 du corps, placer le bras derrière la tête, fixer le bras à l'arc de la table d'opération, poser les jambes sur le supports sans rembourrage). La position correcte du patient sur la table élimine la tension des troncs nerveux. Le traitement est effectué par un neuropathologiste et un physiothérapeute. 46. Anesthésie locale Anesthésie de surface Ce type d'anesthésie est réalisé par contact de la substance anesthésique avec l'un ou l'autre organe, sa surface. A cet effet, une solution à 1-3% de cocaïne, une solution à 0,25-2% de dicaïne, une solution à 1-2% de lidocaïne, une solution à 1-5% de trimécaïne et une solution à 0,5-2% de solution de pyromécaïne. La plupart des anesthésiques locaux se lient aux canaux sodiques inactivés, empêchant leur activation et l'entrée du sodium dans la cellule lors de la dépolarisation membranaire, obtenant ainsi un effet analgésique. La technique d'anesthésie de surface est simple et consiste à lubrifier, instiller une solution ou la pulvériser à l'aide de pistolets pulvérisateurs spéciaux. Le début d'action de l'anesthésique dépend du pH, un pH bas prenant plus de temps à agir qu'un pH élevé. La durée d'action de l'anesthésique dépend du degré de sa liaison aux protéines. Ce type d'anesthésie est utilisé dans les manipulations diagnostiques et en ophtalmologie, oto-rhino-laryngologie. Anesthésie régionale L'anesthésie régionale comprend le plexus, la conduction, la péridurale, la paravertébrale et d'autres types d'anesthésie. Contrairement à l'anesthésie générale, l'anesthésie régionale fournit une analgésie chirurgicale adéquate en raison du blocage périphérique des impulsions douloureuses tout en maintenant des fonctions vitales normales. L'anesthésie locorégionale est techniquement difficile, et nécessite une connaissance précise de la localisation anatomique et topographique du plexus nerveux ou du conducteur nerveux, une orientation claire dans les points d'identification permanents (protrusions osseuses, artères, muscles), la capacité d'évaluer la résistance des tissus et les sensations du patient. Pour désactiver la sensibilité à la douleur, il suffit d'introduire une solution à 1% de trimécaïne (lidocaïne), et pour désactiver la sensibilité proprioceptive et obtenir une relaxation musculaire, des solutions anesthésiques locales plus concentrées doivent être utilisées (par exemple, trimécaïne 2-2,5%) . La restauration de la sensibilité se fait dans l'ordre inverse, c'est-à-dire qu'apparaissent d'abord le tonus musculaire et les sensations proprioceptives, puis les sensations de douleur et de température. L'effet de l'anesthésie dépend de la quantité d'anesthésique pénétrant par voie transpérineurale et provoquant un bloc seuil adéquat. Doubler la concentration de l'anesthésique injecté prolonge l'anesthésie de 1/3 et l'introduction d'un double volume - seulement de 3 à 9%. Les anesthésiques locaux entraînent souvent des réactions anaphylactiques. Trimécaïne : la durée d'action est de 1 à 1,5 heure, la dose unique maximale est de 800 à 1000 1 mg. La lidocaïne (xicaïne) est utilisée dans une solution à 2-2,5%, la durée de l'anesthésie peut aller jusqu'à 3-0,5 heures. La bupivocaïne (marcaïne) est utilisée dans une solution à 0,75-150% à une dose unique maximale de 170-8 mg , la durée d'action est de 12 à XNUMX heures.Pour l'utilisation d'anesthésiques à action prolongée, l'ajout de lidocaïne accélère nettement l'apparition de l'effet, réduisant ainsi la période de latence. 47. Anesthésie du plexus cervical (ASP) L'ACS, réalisé d'un ou des deux côtés, vous permet d'effectuer toutes les opérations sur le cou, la glande thyroïde, les vaisseaux brachiocéphaliques en cas de blessures par balle, de blessures et de maladies tumorales. Le plexus cervical (us cervicalis) est formé à partir des branches antérieures des quatre nerfs cervicaux supérieurs (C1-C4) à leur sortie des foramens intervertébraux. Il est situé sur la face antérieure du muscle scalène moyen et du muscle qui soulève l'omoplate, latéralement aux apophyses transverses des vertèbres cervicales. Les nerfs moteurs du plexus cervical innervent les muscles du cou et les nerfs sensoriels - la peau de la région occipitale de la tête, les surfaces antérieure et latérale du cou, la région sous-clavière jusqu'au niveau des côtes I et II et l'oreillette. Le plus grand nerf du plexus cervical est le phrénique (p. prenicus), qui est formé à partir de C3-C4 et moins souvent en raison d'une branche supplémentaire à partir de C5. La plupart des nerfs sensoriels sortent au milieu sous le bord postérieur du muscle sternocléidomastoïdien et divergent dans les couches superficielles du cou, de la peau de la région occipitale de la tête et du haut de la poitrine. Technique d'anesthésie 2 cm sous l'angle de la mâchoire inférieure, en avant du muscle sternocléidomastoïdien, la pulsation de l'artère carotide interne est déterminée. La branche horizontale de l'os hyoïde correspond au niveau de l'apophyse transverse de la vertèbre C3. Le point d'injection de l'aiguille est situé à l'intersection de la ligne, qui prolonge la branche horizontale de l'os hyoïde, avec le bord antérieur du muscle sternocléidomastoïdien. À ce point d'intersection, dans des conditions aseptiques, une «écorce de citron» se forme et une aiguille d'injection est dirigée à travers celle-ci de l'extérieur vers l'intérieur et d'avant en arrière, en la faisant avancer médialement vers le muscle sternocléidomastoïdien et derrière la carotide interne. (dans l'espace entre le muscle sternocléidomastoïdien et l'artère carotide interne palpable) jusqu'à ce que le patient développe une paresthésie ou que l'aiguille touche l'apophyse transverse de la vertèbre C3. La profondeur de l'injection ne dépasse pas 2 à 5 cm, l'aiguille est solidement fixée dans cette position et un test d'aspiration est effectué, déterminant si l'extrémité de l'aiguille se trouve dans la lumière du vaisseau. Pour l'anesthésie, 10 à 12 ml d'une solution de trimécaïne à 2% sont injectés des deux côtés. Pour améliorer l'anesthésie du plexus cervical, vous pouvez également bloquer les branches superficielles qui vont à la face antérieure du cou. Le lieu de leur sortie est le milieu du bord postérieur du muscle sternocléidomastoïdien. L'aiguille est injectée au point de sortie sous le fascia superficiel du cou. Une solution de trimécaïne à 2% est administrée en une quantité de 3 à 5 ml par voie crânienne et caudale (en forme d'éventail). Une anesthésie adéquate se produit après 8 à 12 minutes et procure un soulagement efficace de la douleur chez la plupart des patients en 1,5 à 2 heures. 48. Anesthésie du plexus brachial (APS) L'APS vous permet d'effectuer toutes les opérations du membre supérieur, de l'articulation de l'épaule, de l'épaule, de l'avant-bras et de la main : amputations, traitement chirurgical des plaies avec repositionnement et fixation des fragments osseux, opérations des vaisseaux sanguins et des nerfs, réduction de la luxation de l'épaule, etc. La fréquence des interventions chirurgicales du membre supérieur, notamment en temps de guerre, pose la question des méthodes rationnelles d'anesthésie lors de ces interventions. Anesthésie du plexus brachial par Winnie Le patient est allongé sur le dos, sa tête est tournée dans la direction opposée au site de ponction, le menton est amené à la ceinture scapulaire controlatérale. La main du côté de la ponction repose le long du corps, légèrement tirée vers le bas. Repères : muscle sternocléidomastoïdien, scalène antérieur, espace interstitiel, veine jugulaire externe, clavicule, cartilage cricoïde. Technique d'anesthésie. La peau est traitée avec une solution antiseptique. En arrière du muscle sternocléidomastoïdien, qui dessine clairement avec une légère élévation de la tête, au niveau du cartilage cricoïde, poser le bout des doigts de la main gauche sur le muscle scalène antérieur. Avec un déplacement supplémentaire des doigts latéralement de 0,5 à 1,5 cm, l'espace interscalénique est ressenti entre les muscles scalènes antérieur et moyen. Cela devient plus prononcé avec une respiration profonde, à mesure que les muscles scalènes se tendent. Dans les profondeurs de l'espace interscalénique, les apophyses transverses des vertèbres cervicales se font sentir (une sensation de résistance solide), et avec une pression accrue du bout du doigt, des paresthésies au niveau de l'épaule ou de la ceinture scapulaire sont souvent provoquées ; caudalement, dans l'espace interscalénique, l'artère sous-clavière peut être palpée. L'espace interscalénique dans la partie supérieure est traversé par la veine jugulaire externe. Le point d'insertion de l'aiguille se situe dans la partie supérieure de l'espace interscalénique au niveau du cartilage cricoïde. À ce stade, une « peau de citron » se forme et à travers elle, l'aiguille est dirigée médialement et légèrement vers le bas, d'avant en arrière (dorsalement) jusqu'à l'apophyse transverse de C6 selon un angle de 30 par rapport au plan sagittal. Lorsque l'aiguille se déplace vers l'intérieur sur une distance de 1,5 à 4 cm, une paresthésie se produit et la pointe de l'aiguille repose sur l'apophyse transverse de la 6e vertèbre cervicale. Dans cette position, l'aiguille est fixée ou tirée vers le haut de 1 à 2 mm, et après un test d'aspiration, 30 à 40 ml d'une solution à 2 % de trimécaïne (lidocaïne) ou une solution à 0,5 à 0,75 % de bupivocaïne (marcaïne) est injecté. Lors de l’injection des premiers millilitres de solution anesthésique locale, le patient ressent une douleur de courte durée (« choc électrique »), indiquant le bon placement de la pointe de l’aiguille. En l'absence de paresthésie, vous pouvez vérifier la position de la pointe de l'aiguille en injectant 0,5 ml d'une solution de chlorure de sodium à 0,9 % sortie du réfrigérateur. L'apparition d'une sensation de douleur au niveau du membre supérieur indique un contact de la solution froide avec le nerf. 49. Anesthésie des nerfs périphériques dans la région du poignet Pour les opérations de la main, il est nécessaire d'anesthésier les nerfs cubital, médian et radial. Dans tous les cas, l'aiguille est injectée au niveau du pli proximal du poignet. Pendant l'anesthésie, le patient est allongé sur le dos, au niveau du poignet, le bras est en supination et légèrement plié. Repères : cubitus styloïde, pisiforme, tendon fléchisseur ulnaire du carpe et tendon long fléchisseur du carpe. Anesthésie du nerf cubital Technique d'anesthésie de la branche palmaire du nerf cubital. Le point d’insertion de l’aiguille se situe au niveau du pli carpien proximal, médial par rapport au tendon fléchisseur ulnaire du carpe. L'aiguille est insérée à une profondeur de 1 à 2 cm à travers le tissu sous-cutané en direction de l'os pisiforme. Après l'apparition des paresthésies et si le test d'aspiration est négatif, fixer l'aiguille et injecter 3 à 5 ml d'une solution de trimécaïne à 2 %. En l'absence de paresthésie, l'aiguille est avancée jusqu'à ce qu'elle entre en contact avec l'os et lorsqu'elle est retirée, une infiltration tissulaire est réalisée avec une solution de trimécaïne à 2%. Technique d'anesthésie de la branche dorsale du nerf cubital. Le point d'injection de l'aiguille se situe au niveau de l'intersection du pli proximal du poignet avec le bord médial du tendon du muscle fléchisseur ulnaire. L'aiguille est dirigée vers le processus styloïde de l'ulna. Pour obtenir une paresthésie, 3 à 5 ml d'une solution à 2% de trimécaïne sont injectés. En l'absence de paresthésie, l'aiguille est retirée et 5 à 10 ml d'une solution de trimécaïne à 2% sont infiltrés dans les tissus. anesthésie du nerf médian Technique d'anesthésie. Le point d'injection de l'aiguille est situé sur la ligne du pli cutané proximal du poignet entre le tendon du muscle long palmaire et le fléchisseur radial de la main. Après avancement perpendiculaire de l'aiguille à travers le tissu sous-cutané jusqu'à une profondeur de 0,5 à 1 cm et obtention d'une paresthésie, l'aiguille est fixée et 3 à 5 ml d'une solution de lidocaïne à 2% sont injectés. S'il n'est pas possible d'obtenir une paresthésie à une profondeur de 1 cm, les tissus sont infiltrés en éventail avec 5 à 10 ml d'une solution de trimécaïne à 2 % tout en retirant lentement l'aiguille. Anesthésie du nerf radial Technique d'anesthésie. Le point d'injection se situe au niveau du pli cutané proximal du poignet latéral à l'artère radiale sur la projection du haut de la " tabatière anatomique ".Une injection est faite, et l'aiguille est dirigée vers la " tabatière ". En cas de paresthésie, l'aiguille est fixée, avec un test d'aspiration négatif, 3 à 5 ml d'une solution de trimécaïne à 2% sont injectés. En l'absence de paresthésie, 5 à 10 ml d'une solution à 2% de trimécaïne sont injectés en éventail dans les tissus sous-jacents, créant un "bracelet" d'infiltration de 3 à 3,5 cm de long à partir des tendons du court extenseur et du long abducteur du pouce d'un côté, au long extenseur du pouce - avec un autre. 50. Anesthésie des membres inférieurs Pour effectuer des interventions chirurgicales sur le membre inférieur, il est nécessaire d'anesthésier les quatre nerfs principaux. Trois d'entre eux - le fémoral, l'obturateur et le nerf cutané externe de la cuisse - proviennent du plexus lombaire, et le nerf sciatique est formé en partie du lombaire et de trois branches du plexus sacré. Technique d'anesthésie. La peau est traitée avec une solution désinfectante. Une "pelure de citron" est formée avec une solution anesthésique, après quoi l'aiguille est injectée sous le ligament inguinal à 1-1,5 cm sous ce dernier et à 0,5-1 cm latéralement à l'artère fémorale palpable. L'aiguille est dirigée à travers le tissu sous-cutané quelque peu dans la direction proximale sous le ligament inguinal, où à une profondeur de 3-4 cm après la ponction du fascia, l'aiguille échoue avec une perte de résistance et une paresthésie peut se produire, s'étendant jusqu'à la surface antérieure de la cuisse. Dans cette position, l'aiguille est fixée avec le pouce et l'index de la main gauche, et le bord de la paume de la main gauche est pressé avec force sur les tissus mous de la cuisse distale de l'aiguille et 35-40 ml d'un Une solution de trimécaïne à 1,5 % est injectée. La pression sur les tissus mous dure 1,5 à 2 minutes. Ainsi, l'anesthésie du nerf fémoral avec clampage se transforme en anesthésie du plexus lombaire, réalisée à partir de l'abord antérieur. L'action de l'anesthésie dure 2 à 2,5 heures. L'anesthésie du plexus lombaire peut être réalisée par voie postérieure, en anesthésiant simultanément les nerfs fémoral (L2-L4) et obturateur (L2-L3), le nerf génito-fémoral (L1-L2) et le nerf cutané fémoral latéral (L2-L3) . La position du patient pendant l'anesthésie est du côté sain avec les jambes fléchies. Repères : apophyse épineuse de la 4ème vertèbre lombaire (ligne reliant les crêtes iliaques en arrière) ; 3 cm caudale le long des crêtes des apophyses épineuses à partir de l'apophyse épineuse de la 4e vertèbre lombaire et 5 cm latéralement à partir du dernier point. Technique d'anesthésie. À partir de l'apophyse épineuse de la 4e vertèbre lombaire dans la direction caudale, une ligne de 3 cm de long est tracée, à partir de laquelle une perpendiculaire de 5 cm de long est restaurée latéralement vers le haut.Le point final de la perpendiculaire, situé près de la crête iliaque, est le point d'injection de l'aiguille. Après avoir créé une "écorce de citron", une aiguille de 12 à 15 cm de long est insérée perpendiculairement à la peau jusqu'à ce qu'elle entre en contact avec l'apophyse transverse de la 5e vertèbre lombaire. Crânialement, glissant hors de l'apophyse transverse de la 5e vertèbre lombaire, l'aiguille pénètre dans l'épaisseur du muscle psoas carré. Dans le même temps, une résistance se fait sentir à l'introduction d'une solution avec une seringue (ou une résistance élastique se produit avec la déformation de la bulle d'air dans la seringue). L'aiguille est passée à une profondeur où il y a une sensation de "perte de résistance" (ou la bulle d'air n'est pas déformée). Ce test indique que l'aiguille est dans le fascia entre le psoas carré et le psoas majeur. L'aiguille est fixée à cette profondeur et 35 à 40 ml d'une solution de trimécaïne à 1,5 à 2 % (lidocaïne) sont injectés pour réaliser l'anesthésie. 51. Anesthésie du nerf sciatique Anesthésie du nerf sciatique par voie antérieure Technique d'anesthésie. Le patient est allongé sur le dos. L'épine iliaque antéro-supérieure et le point le plus saillant du grand trochanter du fémur sont reliés l'un à l'autre par une ligne droite, et à partir de ce dernier point une perpendiculaire est restituée à la face antérieure de la cuisse. La longueur de la perpendiculaire est égale à la distance entre l'épine iliaque antéro-supérieure et le grand trochanter du fémur. L'extrémité de cette perpendiculaire est le point de projection. Dans la position physiologique du membre inférieur, après avoir traité la peau avec une solution désinfectante et créé une « peau de citron », une aiguille de 12 à 15 cm de long est dirigée verticalement vers le bas jusqu'à ce qu'elle repose sur le petit trochanter du fémur. Une fois que l'aiguille a glissé du petit trochanter, sans changer la direction principale, l'aiguille est introduite encore plus profondément - 4 à 5 cm jusqu'à l'apparition d'une paresthésie. S'il n'est pas possible d'obtenir une paresthésie, l'aiguille est ramenée dans l'os et, en tournant le membre vers l'intérieur de 7 à 10, l'aiguille est à nouveau avancée jusqu'à ce qu'une paresthésie apparaisse chez le patient. Anesthésie du nerf sciatique par voie postérieure Technique d'anesthésie. Le patient est allongé sur le côté sain, le membre anesthésié est plié au niveau des articulations de la hanche et du genou selon un angle de 45-60. De la partie la plus saillante du grand trochanter du fémur, une ligne droite est tracée jusqu'à l'épine iliaque postéro-supérieure, à partir du milieu de laquelle une perpendiculaire de 4 à 5 cm de long est abaissée dans la direction caudale. L'extrémité de la perpendiculaire sert comme point de projection du nerf sciatique. L'aiguille est insérée selon un angle de 90 par rapport au plan frontal du corps du patient et avancée jusqu'à obtention d'une paresthésie ou d'un contact avec l'os. Si nécessaire, l'aiguille est tirée vers le haut et insérée à environ 0,5 cm latéralement ou médialement par rapport à l'injection initiale. L'obtention de paresthésies est obligatoire. 20 à 25 ml d'une solution à 2 % de lidocaïne (trimécaïne) sont administrés. La technique d'anesthésie ne changera pas si le patient est allongé sur le ventre. Anesthésie dans la fosse poplitée Technique d'anesthésie. Le coin supérieur de la fosse rhomboïde se situe au niveau du bord supérieur de la rotule. Le point d'injection se situe à 1-1,5 cm sous l'angle supérieur sur la bissectrice abaissée de cet angle, formée de l'extérieur par le tendon du biceps fémoral, de l'intérieur par les tendons des muscles semi-membraneux et semi-tendineux de la cuisse. Le sens de déplacement de l'aiguille est strictement vertical avec le patient en décubitus ventral jusqu'à obtention d'une paresthésie du nerf tibial. En l'absence de paresthésie, l'aiguille est dirigée en éventail, en la remontant à chaque fois au niveau du tissu sous-cutané. Après un test d'aspiration, 5 à 10 ml d'une solution à 2 % de trimécaïne sont injectés. Pour bloquer le nerf péronier commun à partir du même point, l'aiguille est dirigée latéralement à un angle de 30-45 par rapport au plan frontal. Après avoir reçu une paresthésie, 5 à 10 ml d'une solution à 2% de trimécaïne sont injectés. Il n'y a pas de complications ni de contre-indications. 52. Complications de l'anesthésie régionale Au cours de la PR, les complications surviennent assez rarement et peuvent être divisées en deux groupes. 1. Spécifiques, qui sont davantage liés aux erreurs techniques de la méthodologie : 1) injection erronée d'un anesthésique local dans le canal rachidien ou l'espace épidural, par voie intraveineuse ou intra-artérielle (avec anesthésie du plexus cervical, anesthésie du plexus lombaire avec accès inguinal); 2) ponction de cavités et d'organes (cavité pleurale, poumon); 3) la formation d'un hématome avec négligence de la ponction et lésion d'un gros vaisseau; l'hématome comprime le tissu environnant ou le faisceau neurovasculaire; 4) hypotension prolongée et sévère qui se produit avec une résorption rapide de l'anesthésique local ; 5) traumatisme du plexus nerveux ou du conducteur avec l'extrémité de l'aiguille d'injection lors d'une manipulation brutale ; 6) l'absence d'effet analgésique après anesthésie plexique ou conductive. 2. Non spécifique, se manifestant principalement par des réactions générales et locales du corps à l'action d'un anesthésique local sous forme de réactions toxiques et allergiques. Des complications non spécifiques peuvent se développer en fonction du moment, de la dose et du site d'administration de l'anesthésique. Dans ce cas, les lésions du système nerveux central ou cardiovasculaire prédominent. Les complications du côté du système nerveux central peuvent être légères (limitées uniquement à l'excitation centrale) ou graves, ce qui se manifeste par une inhibition du système nerveux central avec une éventuelle paralysie totale. La nature des complications non spécifiques : 1) un surdosage d'anesthésique avec l'administration simultanée d'une dose importante (plus de 1 g) de trimécaïne ou de lidocaïne par voie intra-artérielle ou intraveineuse ; 2) réactions allergiques à l'introduction d'un anesthésique local, caractérisées par un complexe de symptômes de troubles des systèmes nerveux central et cardiovasculaire: anxiété, troubles de la conscience, troubles de la parole, contractions musculaires, convulsions, respiration profonde, perturbation du rythme cardiaque, expansion QR, abaissement de la pression artérielle, tachycardie , apnée, asystole; 3) complications infectieuses dues à un traitement de mauvaise qualité du champ opératoire sur le site de l'anesthésie ; 4) le développement de l'hypotension avec l'anesthésie du plexus et de la conduction est beaucoup moins fréquent qu'avec l'anesthésie péridurale et rachidienne ; 5) avec l'introduction de solutions concentrées d'anesthésiques locaux dans un petit pourcentage de cas, on note le développement d'une bradycardie. 53. Anesthésie lombaire Blocus selon Vishnevsky Ce type d'anesthésie est réalisé en injectant un anesthésique dans le canal rachidien. La technique de ponction lombaire est décrite dans la conférence n ° 2. Les particularités sont que le niveau de ponction est plus élevé (T12-1_1, L1-L2) et après avoir retiré le mandrin de l'aiguille, un anesthésique est immédiatement injecté. Le volume d'anesthésique est de 3 à 5 ml. Naropin est administré à une concentration de 0,5%, la lidocaïne - à 2%, la marcaïne - à 0,5%. La durée de l'anesthésie est de 4 à 6 heures.Ce type d'anesthésie provoque également une hypotension sévère. À haut niveau d'anesthésie (T12-L1), une insuffisance respiratoire est possible. La complication la plus fréquente est le mal de tête. Blocage vagosympathique cervical selon A. V. Vishnevsky Le patient est placé sur la table sur le dos de manière à ce que la main du côté du blocage proposé pende au-dessus du bord de la table. Le muscle sternocléidomastoïdien doit être relâché. Un rouleau est placé sous la ceinture scapulaire, la tête est rétractée dans le sens opposé; dans cette position, les contours anatomiques du cou sont bien dessinés. Le champ est traité avec une lubrification à l'alcool et à l'iode. Le médecin se tient du côté du blocus du même nom. Le site d'injection est l'angle formé par l'intersection du bord postérieur du muscle sternocléidomastoïdien avec une veine. L'index de la main gauche est placé au bord postérieur du muscle sternocléidomastoïdien, au-dessus de l'endroit où il croise la veine jugulaire externe. En appuyant fortement sur un doigt à cet endroit, ils essaient de déplacer le faisceau neurovasculaire vers la ligne médiane. Dans ce cas, le doigt sent facilement la surface antérieure des vertèbres cervicales. L'injection de l'aiguille et son avancement doivent se faire lentement, vers le haut et vers l'intérieur, tout en se concentrant sur la face antérieure de la colonne vertébrale. L'aiguille se déplace le long de la solution de novocaïne à 2% envoyée par petites portions (3-0,25 cm), ce qui assure la sécurité de l'injection. La seringue pendant l'injection est retirée à plusieurs reprises de l'aiguille à des fins de contrôle. Ayant amené l'aiguille à la vertèbre, ils sentent comment elle s'y appuie. Ensuite, la pression sur l'aiguille est affaiblie, en raison de laquelle elle s'éloigne de 1 à 2 mm, après quoi 40 à 60 ml d'une solution sont injectés, qui, se répandant dans un infiltrat rampant le long de l'aponévrose prévertébrale, recouvre le nerf vague, sympathique , et souvent les nerfs phréniques, interrompant (bloquant) la transmission des irritations de la région pleuro-pulmonaire. L'efficacité du blocage vagosympathique est mise en évidence par l'apparition du symptôme de Horner (rétrécissement de la pupille, rétrécissement de la fissure palpébrale et rétraction du globe oculaire). Le rythme respiratoire et le pouls deviennent moins fréquents, l'essoufflement et la cyanose diminuent et l'état général s'améliore. Pour éviter que l'aiguille ne pénètre dans les vaisseaux du cou, le muscle sternocléidomastoïdien avec le faisceau neurovasculaire sous-jacent doit être déplacé suffisamment fort avec l'index vers la ligne médiane. Il est important de diriger l'aiguille vers le haut et vers l'intérieur, car la déplacer dans une direction horizontale menace d'introduire une solution sous l'aponévrose prévertébrale et une complication ultérieure sous la forme d'un syndrome douloureux qui ne s'arrête pas pendant la journée. 54. Évaluation de la gravité du patient Évaluation de l'état somatique du patient. 1 point - patients dont la maladie est localisée et, en règle générale, ne provoque pas de troubles systémiques, c'est-à-dire des personnes pratiquement en bonne santé. 2 points - cela inclut les patients présentant des troubles inexprimés qui perturbent modérément l'activité vitale du corps sans changements prononcés de l'homéostasie. 3 points - patients présentant des troubles systémiques vitaux qui perturbent de manière significative le fonctionnement du corps, mais n'entraînent pas d'invalidité. 4 points - patients atteints de troubles systémiques graves qui présentent un danger élevé pour la vie humaine et entraînent une invalidité. 5 points - patients dont l'état est considéré comme critique, le risque de décès dans les 24 heures est élevé. Le volume et la nature de l'intervention chirurgicale : 1 point - petites opérations pour: ablation de tumeurs superficielles et localisées, ouverture de petits abcès, amputation des doigts et des orteils, ligature et ablation des hémorroïdes, appendicectomie et herniotomie non compliquées. 2 points - opérations de gravité modérée : ablation de tumeurs malignes superficielles nécessitant une intervention prolongée ; ouverture d'abcès localisés dans des cavités ; amputation et désarticulation des membres supérieurs et inférieurs; opérations sur navires périphériques; appendicectomie et herniotomie compliquées nécessitant une intervention importante ; thoracotomie et laparotomie d'essai; d'autres similaires en termes de complexité et de portée d'intervention. 3 points - interventions chirurgicales étendues : opérations radicales sur les organes abdominaux (sauf celles énumérées ci-dessus) ; opérations radicales sur les organes de la cavité thoracique. les amputations étendues des membres, telles que l'amputation transiliosacrée ; chirurgie cérébrale. 4 points - opérations sur le cœur, les gros vaisseaux et autres interventions complexes réalisées dans des conditions particulières (circulation artificielle, hypothermie, etc.). Classification de l'état objectif du patient, développée par l'American Society of Anesthesiologists (ASA). 1. Il n'y a pas de troubles systémiques. 2. Troubles systémiques légers sans altération fonctionnelle. 3. Maladies systémiques modérées et sévères avec dysfonctionnement. 4. Maladie systémique grave qui constitue constamment une menace pour la vie et entraîne une défaillance des fonctions. 5. Etat terminal, risque élevé de décès dans la journée, quelle que soit l'opération. 6. Mort cérébrale, don d'organes pour transplantation. 55. Ventilation pulmonaire artificielle La ventilation pulmonaire artificielle (ALV) assure l'échange de gaz entre l'air ambiant (ou un certain mélange de gaz) et les alvéoles des poumons, est utilisée comme moyen de réanimation en cas d'arrêt soudain de la respiration, en tant que composant de l'anesthésie et comme moyen de soins intensifs pour l'insuffisance respiratoire aiguë, ainsi que certaines maladies des systèmes nerveux et musculaire. Les méthodes modernes de ventilation pulmonaire artificielle (VLA) peuvent être divisées en méthodes simples et matérielles. Une méthode simple de ventilation mécanique est généralement utilisée dans les situations d'urgence (apnée, rythme pathologique, respiration agonale, hypoxémie croissante et (ou) hypercapnie et troubles métaboliques macroscopiques). Les plus simples sont les méthodes expiratoires de ventilation mécanique (respiration artificielle) de bouche à bouche et de bouche à nez. Les méthodes matérielles sont utilisées lorsqu'une ventilation mécanique à long terme est nécessaire (d'une heure à plusieurs mois, voire plusieurs années). Le respirateur Phase-50 possède de grandes capacités. L'appareil Vita-1 est produit pour la pratique pédiatrique. Le respirateur est relié aux voies respiratoires du patient via une sonde endotrachéale ou une canule de trachéotomie. La ventilation matérielle est effectuée en mode fréquence normale, qui varie de 12 à 20 cycles par minute. En pratique, il existe des ventilations à haute fréquence (plus de 1 cycles par minute), dans lesquelles le volume courant est considérablement réduit (jusqu'à 60 ml ou moins), la pression positive dans les poumons en fin d'inspiration est réduite, ainsi que la pression intrathoracique. la pression artérielle et le flux sanguin vers le cœur sont améliorés. De plus, avec le mode haute fréquence, l’adaptation (adaptation) du patient au respirateur est facilitée. Il existe trois méthodes de ventilation à haute fréquence : volumétrique, oscillatoire et à jet. Le volume est généralement effectué avec une fréquence respiratoire de 80-100 par 1 min, IVL oscillatoire - 600-3600 par 1 min, ce qui assure la vibration d'un flux de gaz continu ou intermittent. La ventilation à haute fréquence par jet la plus répandue avec une fréquence respiratoire de 100 à 300 par minute, dans laquelle un jet d'oxygène à une pression de 1 à 2 atm est soufflé dans les voies respiratoires à travers une aiguille ou un cathéter d'un diamètre de 2 à 4 mm. Une ventilation auxiliaire est également réalisée, mais dans ce cas la respiration spontanée du patient est maintenue. Le gaz est fourni après que le patient ait fait une faible tentative d'inhalation ou que le patient soit synchronisé sur un mode de fonctionnement de l'appareil sélectionné individuellement. Il existe également un mode de ventilation obligatoire intermittente (PPVL), qui est utilisé dans le processus de transition progressive de la ventilation artificielle à la respiration spontanée. Dans ce cas, le patient respire seul, mais un flux continu de mélange gazeux est en outre introduit dans les voies respiratoires. Dans ce contexte, avec une fréquence définie (de 10 à 1 fois par minute), l'appareil effectue une inhalation artificielle, coïncidant (PPVL synchronisé) ou ne coïncidant pas (PPVL non synchronisé) avec l'inhalation spontanée du patient. Une réduction progressive des respirations artificielles prépare le patient à une respiration indépendante. 56. Thérapie par perfusion La thérapie par perfusion est une injection goutte à goutte ou une infusion par voie intraveineuse ou sous la peau de médicaments et de liquides biologiques afin de normaliser l'équilibre eau-électrolyte, acido-basique du corps, ainsi que pour la diurèse forcée (en association avec des diurétiques). Indications de la thérapie par perfusion : tous types de choc, perte de sang, hypovolémie, perte de liquide, d'électrolytes et de protéines à la suite de vomissements indomptables, diarrhée intense, refus de boire, brûlures, maladie rénale ; violations de la teneur en ions basiques (sodium, potassium, chlore, etc.), acidose, alcalose et empoisonnement. Les solutions cristalloïdes sont capables de compenser la carence en eau et en électrolytes. Appliquer une solution de chlorure de sodium à 0,85 %, des solutions Ringer et Ringer-Locke, une solution de chlorure de sodium à 5 %, des solutions de glucose à 5-40 % et d'autres solutions. Ils sont administrés par voie intraveineuse et sous-cutanée, par jet (avec déshydratation sévère) et goutte à goutte, dans un volume de 10 à 50 ml/kg ou plus. Les objectifs de la thérapie par perfusion sont : la restauration du BCC, l'élimination de l'hypovolémie, la garantie d'un débit cardiaque adéquat, le maintien et la restauration d'une osmolarité plasmatique normale, la garantie d'une microcirculation adéquate, la prévention de l'agrégation des cellules sanguines, la normalisation de la fonction de transport de l'oxygène du sang. Les solutions colloïdales sont des solutions de substances macromoléculaires. Ils contribuent à la rétention de liquide dans le lit vasculaire. Hemodez, polyglucine, reopoliglyukin, reogluman sont utilisés. Avec leur introduction, des complications sont possibles, qui se manifestent sous la forme d'une réaction allergique ou pyrogène. Voies d'administration - par voie intraveineuse, moins souvent sous-cutanée et goutte à goutte. La dose quotidienne ne dépasse pas 30-40 ml/kg. Ils ont une qualité détoxifiante. En tant que source de nutrition parentérale, ils sont utilisés en cas de refus prolongé de manger ou d'incapacité à se nourrir par la bouche. Les dextranes sont des substituts colloïdaux du plasma, ce qui les rend très efficaces pour la récupération rapide du BCC. Les dextranes ont des propriétés protectrices spécifiques contre les maladies ischémiques et la reperfusion, dont le risque est toujours présent lors d'interventions chirurgicales majeures. Le plasma frais congelé est un produit prélevé sur un seul donneur. Le PFC est séparé du sang total et congelé immédiatement dans les 6 heures suivant le prélèvement sanguin. Stocké à 30 C dans des sacs plastiques pendant 1 an. Compte tenu de la labilité des facteurs de coagulation, le FFP doit être transfusé dans les 2 premières heures après une décongélation rapide à 37 C. La transfusion de plasma frais congelé (FFP) présente un risque élevé de contracter des infections dangereuses telles que le VIH, les hépatites B et C, etc. La fréquence des réactions anaphylactiques et pyrogènes lors de la transfusion de FFP est très élevée, la compatibilité selon le système ABO doit donc être prise en compte. Et pour les jeunes femmes, il faut tenir compte de la compatibilité Rh. Auteur : Kolesnikova M.A.
▪ Sociologie générale. Lit de bébé ▪ Fondamentaux de la sociologie et des sciences politiques. Lit de bébé ▪ Droit des contrats. Lit de bébé
L'existence d'une règle d'entropie pour l'intrication quantique a été prouvée
09.05.2024 Mini climatiseur Sony Reon Pocket 5
09.05.2024 L'énergie de l'espace pour Starship
08.05.2024
▪ Le Groenland perd de la glace de façon catastrophique ▪ Système de climatisation qui ne nécessite pas d'électricité ▪ Trouvé une différence importante entre le cerveau humain et les autres primates ▪ Modems Qualcomm MDM9207-1 et MDM9206 LTE pour IoT ▪ Premier écran 4K pour smartphones
▪ section du site Puzzles drôles. Sélection d'articles ▪ article Incendie au siège ! Expression populaire ▪ article Malpighia nue. Légendes, culture, méthodes d'application ▪ article Stabilisateurs économiques. Encyclopédie de l'électronique radio et de l'électrotechnique
Page principale | bibliothèque | Articles | Plan du site | Avis sur le site www.diagramme.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

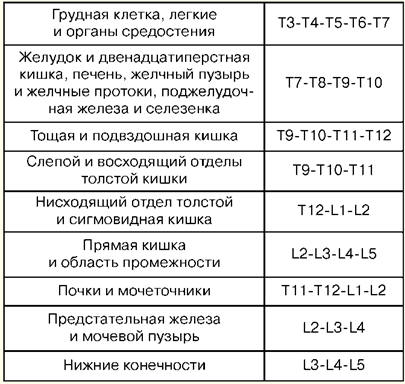


 Voir d'autres articles section
Voir d'autres articles section 