
|
Notes de cours, aide-mémoire
Anesthésiologie et réanimation. Notes de cours : brièvement, les plus importantes
Annuaire / Notes de cours, aide-mémoire table des matières
Conférence numéro 1. Le concept de réanimation La réanimation est une branche de la médecine clinique qui étudie les problèmes de réanimation du corps, développe des principes de prévention des affections terminales, des méthodes de réanimation et des soins intensifs. Les méthodes pratiques de revitalisation du corps sont unies par le concept de "réanimation". La réanimation (du latin "réveil" ou "animation") est un système de mesures visant à restaurer les fonctions vitales du corps fortement altérées ou perdues et à le sortir d'un état terminal et d'une mort clinique. Les mesures de réanimation efficaces sont le massage cardiaque indirect et la ventilation artificielle des poumons. S'ils sont inefficaces dans les 30 minutes, la mort biologique est constatée. Les soins intensifs sont un ensemble de mesures utilisées pour traiter des affections graves mettant la vie en danger et impliquent l'utilisation d'un large éventail de mesures thérapeutiques, selon les indications, y compris les perfusions intraveineuses, la ventilation artificielle prolongée des poumons, la stimulation, les méthodes de dialyse, etc. Un état critique est l'impossibilité de maintenir l'intégrité des fonctions corporelles à la suite d'un dysfonctionnement aigu d'un organe ou d'un système, nécessitant un remplacement médicamenteux ou matériel-instrumental. L'état terminal est un état limite entre la vie et la mort, une extinction réversible des fonctions corporelles, y compris les stades de la préagonie, de l'agonie et de la mort clinique. La mort clinique est un état terminal dans lequel il n'y a pas de circulation sanguine et de respiration, l'activité du cortex cérébral s'arrête, mais les processus métaboliques sont préservés. Avec la mort clinique, la possibilité d'une réanimation efficace demeure. La durée de la mort clinique est de 5 à 6 minutes. La mort biologique est une cessation irréversible des processus physiologiques dans les organes et les tissus, dans laquelle la réanimation est impossible. Elle est établie par une combinaison de plusieurs signes : l'absence de mouvements spontanés, les contractions du cœur et du pouls dans les grosses artères, la respiration, les réactions aux stimuli douloureux, le réflexe cornéen, la dilatation maximale des pupilles et l'absence de leur réaction à la lumière. Les signes fiables du début de la mort sont une diminution de la température corporelle à 20 ° C, l'apparition de taches cadavériques et la rigidité cadavérique musculaire. Conférence numéro 2. Manipulations de base en soins intensifs Ponction percutanée et cathétérisme de la veine principale (sous-clavière). Indications : gros volumes de thérapie par perfusion-transfusion, nutrition parentérale, thérapie de désintoxication, antibiothérapie intraveineuse, sondage et contraste du cœur, mesure de CVP, implantation d'un stimulateur cardiaque, impossibilité de cathétérisme des veines périphériques. Contre-indications: violation du système de coagulation sanguine, processus inflammatoire et purulent au site de ponction et de cathétérisme, traumatisme de la clavicule, syndrome de la veine cave supérieure, syndrome de Paget-Schretter. Instrumentation et accessoires pour ponction et cathétérisme: aiguille de ponction, un jeu de cathéters en plastique, un jeu de conducteurs, une seringue de 10 ml pour les injections intramusculaires, des ciseaux, un porte-aiguille, une aiguille chirurgicale et une ligature en soie, un pansement adhésif. Technique. Le cathétérisme est effectué dans le respect des règles d'asepsie et d'antisepsie, de traitement des mains de l'opérateur, du champ opératoire et d'emballage avec du matériel stérile. La position du patient est horizontale sur le dos avec les bras ramenés au corps et le revers de la tête dans le sens opposé. L'anesthésie locale est utilisée - solution de novocaïne à 0,5-1%. La ponction se fait mieux à droite, car lors de la ponction de la veine sous-clavière gauche, il existe un risque d'endommager le canal lymphatique thoracique. Point de ponction - sur le bord du tiers interne et moyen de la clavicule à 2 cm en dessous. L'aiguille est passée lentement sous un angle de 45° par rapport à la clavicule et de 30-40° par rapport à la surface du thorax entre la clavicule et la 15ère côte en direction du bord supérieur de l'articulation sterno-claviculaire. Lors du passage de l'aiguille, le piston de la seringue est périodiquement serré pour déterminer s'il pénètre dans la veine, et la novocaïne est injectée le long de l'aiguille. Lors du perçage d'une veine, il y a parfois un sentiment d'échec. Après avoir pénétré dans la veine, la seringue est déconnectée de l'aiguille et la canule est fermée avec un doigt. Ensuite, un conducteur est inséré à travers l'aiguille sur une longueur de 20 à 6 cm et l'aiguille est retirée. Un cathéter du diamètre approprié est passé à travers le conducteur et, avec le conducteur, est inséré dans la veine de 8 à XNUMX cm, après quoi le conducteur est soigneusement retiré. Pour vérifier la position correcte du cathéter, une seringue y est fixée et 2 à 3 ml de sang y sont aspirés, après quoi un bouchon est placé ou un traitement par perfusion est démarré. Le cathéter est fixé avec une ligature de soie à la peau. Pour ce faire, sur un cathéter à 3-5 mm de la peau, un manchon est fait de pansement adhésif, sur lequel la soie est nouée, puis passée à travers les oreilles du cathéter et nouée à nouveau. Après avoir fixé le cathéter, le site de ponction est fermé avec un autocollant aseptique. Complications: ponction de l'artère sous-clavière, embolie gazeuse, ponction de la cavité pleurale, lésion du plexus brachial, lésion du canal lymphatique thoracique, lésion de la trachée, du goitre et de la glande thyroïde, suppuration au site de ponction. 1. Trachéotomie Indications : obstruction du larynx et de la trachée supérieure due à une obstruction par une tumeur ou un corps étranger, paralysie et spasme des cordes vocales, gonflement sévère du larynx, détresse respiratoire aiguë, aspiration de vomi, prévention de l'asphyxie en cas de traumatisme thoracique grave. Outils : 2 scalpels, 2 pinces anatomiques et chirurgicales, plusieurs pinces hémostatiques, un élévateur, une sonde cannelée, 2 mousses et 1 crochet pointu à une dent, dilatateur Trousseau ou Deschamps, aiguilles chirurgicales avec porte-aiguille. Technique Le patient est allongé sur le dos, un rouleau sous les épaules, la tête est renversée. Si le patient est en état d'asphyxie, le rouleau n'est posé qu'au dernier moment, avant l'ouverture de la trachée. L'anesthésie par infiltration locale est réalisée avec une solution à 0,5-1% de novocaïne additionnée d'adrénaline. Dans l'asphyxie aiguë, il est possible d'opérer sans anesthésie. Points d'identification : l'angle du cartilage thyroïde et le tubercule de l'arc du cartilage cricoïde. Une incision de la peau, du tissu sous-cutané et du fascia superficiel est pratiquée du bord inférieur du cartilage thyroïde à l'encoche jugulaire strictement le long de la ligne médiane du cou. La veine médiane du cou est rétractée ou ligaturée, trouvant une ligne blanche, le long de laquelle les muscles sont écartés de manière brutale et l'isthme de la glande thyroïde est exposé. Les bords de l'incision sont écartés à l'aide d'un dilatateur de Trousseau, des ligatures sont appliquées sur le bord de la plaie et la canule de trachéotomie est soigneusement insérée en veillant à ce que son extrémité pénètre dans la lumière de la trachée. La plaie chirurgicale est suturée. Le tube est fixé sur le cou du patient à l'aide d'une attelle de gaze, préalablement attachée à la protection du tube. Insérez le tube intérieur dans le tube extérieur. 2. Conicotomie Le patient est placé sur le dos avec un rouleau transversal au niveau des omoplates. La tête du patient est inclinée vers l'arrière. Après avoir traité la peau de la face avant du cou avec une solution antiseptique, le larynx est fixé avec les doigts sur les surfaces latérales du cartilage thyroïde et l'écart entre le cartilage thyroïde et le cartilage cricoïde, où se trouve le ligament en forme de cône, est feutre. Sous anesthésie locale par infiltration au scalpel pointu, une incision cutanée transversale d'environ 2 cm de long est pratiquée, le ligament en forme de cône est palpé et disséqué ou perforé. Toute canule de trachéotomie de diamètre approprié est insérée dans le trou formé et fixée avec une bande de gaze autour du cou. En l'absence de canule, celle-ci peut être remplacée par un morceau de tube en caoutchouc ou en plastique de diamètre et de longueur appropriés. Pour éviter que ce tube ne glisse dans la trachée, son extrémité externe est percée transversalement à une distance de 2 cm du bord et fixée avec une bande de gaze. Le conicotome est une canule de trachéotomie en métal de petit diamètre avec un mandrin de perçage à l'intérieur. Après dissection de la peau au-dessus du ligament en forme de cône, celui-ci est percé d'un conicotome, le mandrin est retiré et la canule est placée dans une position qui assure la libre circulation de l'air dans la trachée et fixée. Dans les cas extrêmes, avec une obstruction de l'entrée du larynx et une violation aiguë des voies respiratoires, il peut être restauré en injectant 1 à 2 aiguilles épaisses d'un diamètre interne de 2 à 2,5 mm dans la trachée sur la ligne médiane sous le niveau de le cartilage thyroïde. Les aiguilles sont insérées à angle aigu par rapport à l'axe trachéal, parfois sans anesthésie locale, à une profondeur de 1-1,5-2 cm. . 3. Ponction de la cavité pleurale Indications : essoufflement aigu dû à la compression des poumons par un épanchement massif avec pleurésie ou hydrothorax, ainsi que de l'air avec pneumothorax valvulaire. Technique La ponction est réalisée en position assise, dans des conditions aseptiques. Pour l'anesthésie du site de ponction, une solution à 0,5% de novocaïne est utilisée. Une aiguille épaisse reliée à un tube en caoutchouc est utilisée pour la ponction. La ponction est faite le long du bord supérieur de la côte, car les vaisseaux intercostaux sont situés le long du bord inférieur. La pénétration de l'aiguille dans la cavité pleurale est ressentie comme un « échec dans le vide ». L'aspiration de liquide le long de l'aiguille confirme que l'extrémité de l'aiguille se trouve dans la cavité pleurale. Chaque fois qu'une seringue remplie est séparée du tube en caoutchouc, ce dernier doit être serré avec une pince hémostatique pour empêcher l'air atmosphérique d'être aspiré dans la cavité pleurale. En fin d'aspiration, un pansement aseptique est appliqué sur le site de ponction. Complications: lésion de l'artère intercostale, des vaisseaux du diaphragme du poumon, ponction de l'estomac ou des intestins. Intubation trachéale. Indications: rétrécissement du larynx, respiration pathologique, insuffisance respiratoire aiguë, degré coma II et III, risque élevé d'aspiration lors d'interventions chirurgicales sur les organes de la poitrine et de la cavité abdominale, de la tête et du cou, dans les maladies du pharynx, du larynx et de la trachée (inflammation aiguë, cancer, tuberculose, etc.). Un laryngoscope est utilisé pour l'intubation. Il se compose d'un manche et d'une lame. Les lames courbes les plus utilisées, car plus physiologiques. Les lames droites sont utilisées avec un long cou. La préparation à l'intubation comprend la vérification de l'équipement et le positionnement correct du patient. Le tube endotrachéal doit être vérifié. Le brassard est testé en le gonflant avec une seringue de 10 ml. Vérifier le contact de la lame avec le manche du laryngoscope et l'ampoule. Il est nécessaire de s'assurer que l'aspiration est prête en cas d'expectoration soudaine, de saignement ou de vomissement. Une intubation réussie dépend de la position correcte du patient. La tête du patient doit être au niveau du processus xiphoïde de l'intubateur. Une élévation modérée de la tête avec une extension simultanée au niveau de l'articulation atlanto-occipitale crée une meilleure position pour l'intubation. La préparation à l'intubation comprend également une pré-oxygénation obligatoire. Le laryngoscope est tenu dans la main non dominante (pour la plupart des gens, c'est la gauche) et la bouche du patient est grande ouverte avec l'autre main. La lame est insérée le long du côté droit de l'oropharynx, évitant d'endommager les dents. La langue est décalée vers la gauche et la lame est relevée jusqu'à l'arc du pharynx. La pointe d'une lame courbe est insérée dans la vallécule (une fosse située sur la face antérieure de l'épiglotte), tandis que la pointe d'une lame droite doit soulever l'épiglotte directement. La poignée du laryngoscope est poussée vers le haut et vers l'avant perpendiculairement à la mandibule jusqu'à ce que les cordes vocales soient visibles. Il faut éviter de se fier aux dents. Le tube endotrachéal est pris dans la main droite et passé à travers la glotte ouverte sous contrôle visuel. Le brassard doit être placé dans la trachée supérieure, mais sous le larynx. Le laryngoscope est retiré de la bouche, évitant à nouveau d'endommager les dents. Immédiatement après l'intubation, l'auscultation est effectuée sur les poumons des deux côtés (puisqu'il est possible de passer un tube dans une bronche) et dans l'épigastre (pour exclure l'intubation œsophagienne). Si le tube est dans la trachée, il est fixé en position avec des rubans et le brassard est gonflé. Le brassard doit être placé au-dessus du niveau du cartilage cricoïde, car son maintien prolongé dans le larynx peut entraîner un enrouement dans la période postopératoire. Complications : intubation de l'œsophage, des bronches, localisation de la manchette dans le larynx, atteinte des dents, luxation de la mâchoire inférieure, laryngospasme, troubles réflexes (hypertension, tachycardie, augmentation de la pression intracrânienne), atteinte des voies respiratoires, inflammation, etc. 4. Ponction et cathétérisme de l'espace épidural Indications : syndrome douloureux sévère, interventions chirurgicales, procurant une analgésie postopératoire. Le niveau de réglage du bloc péridural dépend de l'organe qui doit être anesthésié. Le tableau n°1 donne des exemples d'"organes cibles" pour la ponction péridurale. Tableau 1 Niveaux de la colonne vertébrale et "organes cibles"
Instrumentation: aiguilles pour l'anesthésie, une aiguille spéciale pour percer l'espace épidural, une seringue à échantillon, un cathéter, un bouchon, des balles filtrantes, des serviettes, du ruban adhésif et des gants stériles. La position du patient est assise ou couchée sur le côté. Dans ce cas, les genoux et le menton doivent être rapprochés le plus possible de la poitrine. Ainsi, une flexion maximale de la colonne vertébrale est créée, à laquelle l'angle entre les apophyses épineuses des vertèbres adjacentes augmente et l'approche du ligament jaune est facilitée. Dans des conditions aseptiques et sous anesthésie locale avec une solution de novocaïne à 0,5%, une ponction de l'espace épidural est réalisée. L'aiguille est injectée strictement perpendiculairement, mais avec l'ostéochondrose, un angle d'inclinaison est possible ou lors de la ponction dans la région mi-thoracique. Lorsque l'aiguille pénètre dans l'épaisseur des ligaments, le mandrin en est retiré et une seringue contenant du liquide est attachée. La poursuite de l'avancement de l'aiguille est effectuée lentement et en douceur avec une pression sur le piston de la seringue. En raison de la résistance importante des ligaments, le liquide ne peut pas sortir de la seringue. La seringue est déconnectée et le cathéter est inséré à 5-7 cm, il ne doit y avoir aucune résistance. L'aiguille est retirée et le fil de guidage est fixé au dos avec un pansement adhésif, l'amenant à la surface avant de la poitrine. La fiche avec le filtre est fixée au conducteur. Un anesthésique est injecté. Après cela, le niveau d'anesthésie cutanée est déterminé. Complications : troubles respiratoires et hémodynamiques, intoxication, atteinte de la dure-mère, complications neurologiques, péridurite. 5. Ponction lombaire Indications : présence de syndrome méningé, hypertension intracrânienne, diagnostic différentiel entre AVC ischémique et hémorragique, traumatisme crânien, tumeurs de la moelle épinière. Contre-indications: présence d'un processus inflammatoire ou purulent au site de ponction, diathèse hémorragique, tumeur de la fosse crânienne postérieure, luxation du tronc, état terminal du patient, avec des limites floues du nerf optique. Le point de ponction se situe entre les 3e et 4e apophyses épineuses des vertèbres lombaires. La manipulation est réalisée dans des conditions aseptiques, sous anesthésie locale. L'aiguille va perpendiculairement au nombril. La pose du patient est la même que pour la ponction péridurale. Avec le passage de trois ligaments (interépineux externes et internes, ligaments jaunes), il y a une sensation de chute, le mandrin est retiré de l'aiguille et le liquide céphalo-rachidien apparaît. Après avoir prélevé le liquide céphalo-rachidien pour examen, un mandrin est inséré et l'aiguille est retirée, un autocollant aseptique est appliqué. Contrairement à la ponction péridurale, des dommages à la dure-mère se produisent. Le liquide céphalo-rachidien est clair, incolore, pression 100-200 mm d'eau. Art., teneur en protéines 0,33 g/l, HC - 1003-1008, pH = 7,35-7,40, teneur en sucre égale à la moitié de la glycémie (normalement 2-3 mmol/l), chlorures - 110-120 mmol/l, le nombre de cellules jusqu'à 5 lymphocytes. Complications : épidurite, luxation du cerveau dans le foramen magnum, troubles neurologiques. Conférence n ° 3. Troubles aigus de la conscience La conscience est la forme la plus élevée de reflet de la réalité, qui est un ensemble de processus mentaux qui permettent à une personne de naviguer dans le monde qui l'entoure, le temps, sa propre personnalité, qui assure son comportement. L'altération de la conscience est le nom général des troubles de l'activité intégrale du cerveau, exprimée par une violation de la capacité de percevoir, de comprendre et de réagir de manière adéquate à l'environnement, de le naviguer, de se souvenir des événements actuels, d'établir un contact vocal et d'effectuer des expédients arbitraires. actes comportementaux. Il existe diverses options pour la dépression de la conscience (stupeur, stupeur, coma plus ou moins profond), ainsi que pour la confusion aiguë (état délirant ou encéphalopathie métabolique). Le degré d'altération de la conscience varie d'une légère confusion au coma, et il n'y a pas de transitions claires entre ces états. En pratique, le degré d'altération de la conscience est déterminé par la réaction du patient aux stimuli. La stupéfaction est une forme d'altération de la conscience, caractérisée par une léthargie, un ralentissement et une difficulté au cours des processus mentaux, un épuisement rapide de l'attention, une augmentation du seuil de perception des stimuli externes, mais tout en maintenant un contact verbal limité. La stupéfaction est basée sur une violation de l'attention, c'est-à-dire la capacité de sélectionner les informations nécessaires et de coordonner les réponses de manière à ce que la séquence logique des pensées et des actions ne soit pas violée. Les causes les plus fréquentes de stupeur sont des troubles métaboliques et toxiques, mais parfois on l'observe également dans des lésions focales du cortex, en particulier du lobe pariétal droit. Chez ces patients, il est possible d'obtenir une réponse monosyllabique ou la mise en œuvre des instructions les plus simples uniquement après des appels persistants ou une stimulation supplémentaire. Avec une oppression supplémentaire de la conscience, la possibilité d'un contact avec la parole est perdue et le sopor se développe. Sopor est un état de dépression profonde de la conscience avec la perte de la possibilité de contact avec le patient, mais la préservation des réactions protectrices coordonnées et l'ouverture des yeux du patient en réponse à la douleur, au son ou à d'autres stimuli. Le patient ne peut pas être complètement réveillé même à l'aide de stimuli douloureux, il est allongé les yeux fermés. La réaction aux instructions verbales est faible ou complètement absente, il est impossible d'obtenir un mot ou un son de réponse du patient. Avec une oppression supplémentaire de la conscience, un coma se développe. Le coma est un état inconscient caractérisé par une insensibilité aux stimuli externes. Il s'agit d'un état potentiellement mortel de dépression des fonctions du système nerveux central et de troubles de la régulation des fonctions vitales. Le coma peut être causé par de nombreux troubles métaboliques différents et des dommages structurels. Physiopathologie du coma Le plus souvent, le coma est dû à : 1) processus intracrâniens avec lésions du tissu cérébral (hématome, abcès, tumeur, épilepsie); 2) lésions infectieuses du système nerveux central (méningite, encéphalite); 3) dommages toxiques au cerveau (empoisonnement par l'alcool, les champignons, les drogues); 4) défaillance du flux sanguin cérébral (conséquences de l'asystole, crises de Morgagni-Adams-Stokes) ; 5) causes métaboliques (équilibre hydrique et électrolytique altéré, métabolisme glucidique, équilibre acido-basique, insuffisance rénale et hépatique); 6) trouble de l'équilibre thermique (coup de chaleur, hypothermie). classement com Selon l'étiologie, on distingue le coma suivant. 1. Primaire ou intracrânien : traumatique, vasculaire, infectieux, néoplasmes du cerveau, épileptique, métabolique et hypoxique. 2. Secondaire ou extracrânien : lésion cérébrale grave. Selon la gravité du coma sont classés de la manière suivante. 1. Coma modéré, lorsque le patient réagit à des stimuli douloureux. En réponse à eux, des mouvements de flexion et d'extension peuvent apparaître. Mais les réactions motrices protectrices ne sont pas coordonnées. La douleur du patient n'ouvre pas les yeux. Les réflexes pupillaires et cornéens sont généralement préservés, les réflexes abdominaux sont déprimés et les réflexes tendineux sont variables. Augmentation des réflexes de l'automatisme oral et des réflexes pathologiques du pied. 2. Coma profond. Elle se caractérise par l'absence de toute réaction à tout stimulus externe, diverses modifications du tonus musculaire, une diminution ou une absence de réflexes sans mydriase bilatérale, des troubles de la respiration spontanée et de l'activité cardiovasculaire. 3. Le coma terminal est déterminé par une mydriase fixe bilatérale, une atonie musculaire diffuse, des violations graves des fonctions vitales, des troubles du rythme et de la fréquence respiratoire, une apnée, une tachycardie sévère; la tension artérielle est critique ou non déterminée. Examen d'un patient dans le coma Le plan d'examen du patient est le suivant. 1. Évaluation de l'état fonctionnel des systèmes respiratoire et cardiovasculaire. 2. Examens cliniques généraux, prenant en compte les données de laboratoire, permettant d'évaluer la pathologie extracrânienne. 3. Examen neurologique. Études de laboratoire : test sanguin clinique général (signes d'une infection bactérienne ou virale) ; chimie sanguine : glucose, facteurs de coagulation (temps de coagulation, prothrombine, fibrinogène, APTT, antithrombine III, tests de paracoagulation, numération plaquettaire), urée, créatinine, bilirubine, ALT, AST, osmolarité, électrolytes (K, Na, Mg, Ca) ; dépistage toxicologique du sang, de l'urine, du contenu gastrique. Études instrumentales : radiographie du crâne et du rachis cervical. La consultation d'un neuropathologiste (neurochirurgien) détermine la direction ultérieure de la recherche diagnostique: imagerie par résonance magnétique ou calculée; EEG ; dopplerographie échographique. La ponction lombaire avec analyse du liquide céphalo-rachidien est obligatoire après : 1) consultation d'un ophtalmologiste et exclusion des signes d'augmentation de la pression intracrânienne - œdème et élévation des disques optiques ; 2) exclusion des signes de hernie du cerveau. Les localisations suivantes de la hernie du cerveau sont distinguées. Hernie diencéphalique, qui survient lorsque la localisation supratentorielle médiale est endommagée et consiste en le déplacement du diencéphale à travers l'encoche du tenon cérébelleux. Ce processus appelle : 1) Respiration de Cheyne-Stokes ; 2) constriction des pupilles tout en maintenant leur réaction à la lumière ; 3) paralysie du regard vers le haut ; 4) changements dans l'état mental. La hernie des parties médiales du lobe temporal, qui survient lorsque la localisation supratentorielle latérale est atteinte, consiste en le déplacement des parties médiales du lobe temporal à travers l'échancrure du tenon cérébelleux. La pression qui en résulte sur les structures du mésencéphale se manifeste par : 1) altération de la conscience ; 2) une pupille élargie et non réactive du côté de la hernie, qui est associée à une compression du nerf crânien III ; 3) hémiparésie du côté opposé. Les mouvements des globes oculaires ne sont pas toujours perturbés. Hernie des amygdales du cervelet, qui est causée par une pression poussant la partie inférieure du cervelet à travers le foramen magnum, ce qui entraîne une compression de la moelle allongée. Cela implique: 1) altération de la conscience ; 2) violations du rythme respiratoire ou apnée. traitement Le traitement doit être aussi agressif que possible et viser principalement à assurer une oxygénation adéquate et la stabilisation de l'hémodynamique centrale. Si la respiration spontanée est maintenue, une insufflation d'oxygène humidifié à travers un masque ou un cathéter nasal est recommandée. En l'absence de respiration spontanée ou en présence de respiration pathologique, une intubation trachéale est réalisée et le patient est transféré en ventilation pulmonaire artificielle. En cas d'agitation psychomotrice et de réaction à la ventilation mécanique, l'utilisation de sédatifs (benzodiazépines, butyrophénones) est nécessaire. La stabilisation de l'hémodynamique centrale est la normalisation de la pression artérielle. Dans un état hypertendu, la pression artérielle doit être réduite, mais pas plus de 10% de l'original par heure. Un bon effet est l'utilisation de nitroprussiate de sodium ou de sulfate de magnésium. Avec l'hypotension, la dopamine, la dopamine, le dobutrex et les médicaments hormonaux sont utilisés. En l'absence de données anamnestiques et d'un diagnostic peu clair, une thérapie ex juvantibus est réalisée (une réponse positive à l'exposition au médicament, d'une part, donne la clé du diagnostic, d'autre part, elle permet de gagner du temps pour éviter des changements irréversibles ): 1) thiamine - 100 mg par voie intraveineuse, puis - 100 mg par voie intramusculaire (surtout en cas d'antécédents d'alcoolisme, lors de la détermination de concentrations élevées d'éthanol dans le sang); 2) glucose - une solution à 40% de 60 ml par voie intraveineuse (avec un taux de glucose plasmatique inconnu ou à un taux inférieur à 3 mmol / l); 3) naloxone - 0,4-1,2 mg par voie intraveineuse, fractionnée, répétée, en particulier en présence de "signes opiacés" (traces d'injections intraveineuses, pupilles étroites, troubles respiratoires centraux); 4) anexat (flumazénil) - 0,2 mg pendant 30 secondes, au cours de la minute suivante, injecter 0,3 mg supplémentaire, au cours de chaque minute suivante - 0,5 mg jusqu'à une dose totale de 3 mg. En l'absence d'effet, on peut supposer que le coma est peu susceptible d'être causé par des médicaments à base de benzodiazépines ; 5) en cas d'empoisonnement ou de surdosage avec un médicament ou une substance connue, un antidote approprié doit être administré (s'il existe une possibilité de traitement antidote). Contrôle des saisies. L'hypoxie cérébrale entrante peut provoquer un état de mal épileptique. Les épisodes de convulsions peuvent également résulter de la toxicité des médicaments anticholinestérase. Pour le traitement, le médicament de choix est les benzodiazépines : midazolam (Dormikum) 5 mg par voie intraveineuse en doses fractionnées jusqu'à une dose totale de 30 mg g, seduxen (Relanium) en doses fractionnées jusqu'à 10 mg, par voie intraveineuse. En cas d'apparition d'un état de mal épileptique, après l'administration de benzodiazépines, il est nécessaire d'administrer de la phénytoïne à la dose totale de 1 à 1,5 g à raison de 50 mg/min. En cas de résistance à ces médicaments, il est nécessaire d'administrer du phénobarbital (thiopental) à une dose totale allant jusqu'à 1000 300 mg par perfusion intraveineuse lente (un contrôle de la respiration et de la pression artérielle est nécessaire). En cas de crises récurrentes, une anesthésie générale est nécessaire. Chez les patients présentant des signes EEG ou tomodensitométriques d'un foyer épileptique (hémorragie, néoplasie, infarctus ischémique important, abcès, etc.) et des crises d'épilepsie épisodiques, un traitement d'entretien à la phénytoïne est nécessaire - XNUMX mg une fois par jour per os. Maintenir la normothermie. Le contrôle de la température rectale est nécessaire : sa diminution en dessous de 34 °C se développe avec l'hypothermie, le surdosage de somnifères et de sédatifs, l'hypothyroïdie, la maladie de Wernicke. Dans ces cas, il est nécessaire de réchauffer progressivement le patient jusqu'à une température de 36 °C. Les patients souffrant d'hypothermie et de manque de fonctions vitales sont soumis à la RCR, car les basses températures réduisent la demande en oxygène dans le cœur et le cerveau et contribuent à un meilleur résultat des mesures de réanimation (sauf dans les cas accompagnés d'hyperkaliémie). La présence de fièvre chez les patients comateux nécessite une recherche active et un traitement des complications infectieuses. La présence de signes de méningisme peut indiquer la présence soit d'une méningite bactérienne, soit d'une hémorragie sous-arachnoïdienne (bien qu'environ 12 heures doivent s'écouler entre le début du saignement et l'irritation méningée chimique). Une autre cause de fièvre peut être un abcès intracrânien ou un hématome sous-dural. Si une méningite bactérienne est suspectée, une ponction lombaire (analyse du liquide céphalo-rachidien) et une tomodensitométrie doivent être réalisées pour déterminer les signes d'augmentation de la pression intracrânienne. Prévenir l'aspiration du contenu gastrique. La nécessité d'un lavage gastrique en cas d'intoxication et de surdosage médicamenteux et, par conséquent, la pose d'une sonde gastrique augmente le risque de régurgitation du contenu gastrique (en raison du relâchement du sphincter gastro-œsophagien). Par conséquent, avant d’insérer une sonde gastrique, il est nécessaire de réaliser une intubation trachéale avec un brassard étanche, qui constitue le meilleur moyen de protéger les voies respiratoires. Traitement urologique. Pour contrôler la diurèse, il est nécessaire d'installer un cathéter de Foley, garantissant des conditions aseptiques et effectuant un traitement antimicrobien pour prévenir la septicémie urogénitale. Pression intracrânienne réduite. Une augmentation de la PIC est une urgence clinique qui nécessite la mise en œuvre de mesures appropriées visant à la réduire, ce qui évite des lésions secondaires du cerveau dues à la compression de ses tissus ou à une diminution du flux sanguin cérébral. La mise en œuvre des mesures de diagnostic ci-dessus permet d'établir les causes de l'augmentation de la PCI et, par conséquent, les mesures clés visent à son élimination (traitement opératoire et conservateur). Hyperventilation pour maintenir les niveaux de pCO2 25-30 mmHg Art. (des niveaux inférieurs à 25 mm Hg peuvent entraîner une diminution significative du débit sanguin cérébral, entraînant une ischémie cérébrale). Restriction liquidienne. Il est nécessaire d'exclure les solutions contenant de l'eau libre (5% de glucose). La solution isotonique de NaCl, nécessaire au maintien de l'osmolarité sanguine, doit être administrée à la moitié de la dose. Introduction de substances osmotiquement actives. Le mannitol est administré à une dose de 1 à 2 g/kg pendant 10 à 20 minutes, puis à une dose d'entretien de 0,05 à 0,3 g/kg toutes les heures 6. De plus, le furosémide est administré pour réduire plus efficacement l'ICP. Un contrôle strict de la thérapie est nécessaire pour prévenir les complications: diminution du volume intravasculaire, hypotension, hypernatrémie, hypocalcémie, hypokaliémie, ainsi qu'un syndrome de réponse et une rupture des veines corticales dans un hématome sous-dural. Une mesure importante pour prévenir les complications consiste à maintenir la pression artérielle systolique à 100-110 mm Hg. Art. Les médicaments entraînent également une diminution de l'ICP. L'utilisation de relaxants musculaires aide à réduire la PIC pendant la ventilation mécanique (blocage de l'augmentation de la pression veineuse intrathoracique pendant la ventilation mécanique), mais ils ne sont recommandés que pendant une très courte période. L'utilisation de corticostéroïdes est efficace en cas d'augmentation de la pression intracrânienne due à une néoplasie ou à une ischémie focale (accident vasculaire cérébral) du cerveau. L'efficacité des corticostéroïdes dans le traitement de l'augmentation de la pression intracrânienne due à un traumatisme et à une ischémie cérébrale générale n'a pas été prouvée. Il est important de se rappeler que les glucocorticoïdes peuvent provoquer une augmentation de la glycémie et, par conséquent, augmenter l'ischémie cérébrale. Types de communication Le coma hypoglycémique survient avec une surdose d'insuline dans le traitement du diabète sucré ou avec une restriction de l'apport en glucides. Le développement du coma est précédé de boulimie, d'irritabilité, de peur. Une diplopie, des hallucinations, des convulsions toniques et cloniques sont parfois notées. L'excitation est remplacée par l'adynamie et vice versa. Le patient perd rapidement conscience et est couvert de sueur. La peau est moite et pâle, la respiration est superficielle, rythmée. Parfois, une hypoglycémie spontanée est observée chez les athlètes et après un effort physique intense. Si le coma hypoglycémique dure plus de 3 heures, le développement de lésions organiques macroscopiques du système nerveux central est possible. Il est important d'abaisser le taux de sucre dans le sang en dessous de 3 mmol. Il n'y a ni sucre ni acétone dans les urines. Traitement. Entrez immédiatement 20-40% de glucose à une dose de 20-30 ml par voie intraveineuse sous forme de bolus. Après cela, un contrôle de la glycémie et de l'urine est effectué. Coma diabétique, ou hyperglycémique, lorsque la glycémie est fortement augmentée. Le coma est précédé de somnolence, soif, anorexie, nausées, vomissements, maux de tête. L'hyperglycémie, l'acidose métabolique sont déterminées en laboratoire, le sucre et l'acétone sont présents dans les urines (pas toujours). Le visage est pâle et hyperémique, les muqueuses sont sèches, la peau est également sèche et sa turgescence est réduite. Les globes oculaires sont enfoncés, l'odeur d'acétone de la bouche est possible. La respiration est pathologique rare. L'hémodynamique est perturbée : tachycardie, hypotension artérielle, bruits cardiaques étouffés. Traitement. Élimination de l'hypovolémie à l'aide de l'administration intraveineuse de chlorure de sodium dans un volume de 3 à 5 litres par jour. L'insulinothérapie consiste en l'introduction d'insuline à action brève 6-10 UI par heure avec une pompe à perfusion. Avec une diminution de la glycémie à 11-13 mmol / l, la dose d'insuline est réduite à 4-8 unités par heure et une perfusion de glucose à 5% commence pour éviter un état hypoglycémique. Le coma thyréotoxique est rare, mais il faut le garder à l'esprit si, avec une tachycardie sévère, il n'y a pas de signes typiques d'insuffisance myocardique hémodynamique et s'il existe une insuffisance cardiaque dynamique énergétique. La présence de struma, d'éblouissement des yeux et de tremblements attire généralement également l'attention sur cette possibilité. Le tableau clinique doit être complété par la collecte de données anamnestiques, car les études confirmant le diagnostic (métabolisme de base, iode radioactif) ne peuvent être réalisées. L'intoxication alcoolique se manifeste par une odeur d'alcool de la bouche, un état délirant, de l'anxiété, des vomissements et un visage bouffi. La respiration est lente, le pouls est accéléré, les pupilles sont dilatées. Chez les patients alcooliques, le délire se développe 2 à 3 jours après le sevrage alcoolique. Le développement du délire est prévenu par l'utilisation de benzodiazépines lorsque des signes avant-coureurs (fièvre, tremblements, tachycardie, hypertension) apparaissent. Avec le développement du délire, les médicaments de choix sont : chez les jeunes, le diazépam (administration intraveineuse), et chez les patients âgés et insuffisants hépatiques, le lorazépam, mais si nécessaire, un effet rapide est préférable au diazépam (5 mg tous les 5 minutes jusqu'à ce que l'effet soit atteint). Des cas de nécessité d'administrer 2640 mg de diazépam pour le traitement d'un état délirant sévère sont décrits. De plus, des bloqueurs et de la clonidine sont utilisés. Dans ces conditions également, l'utilisation d'antipsychotiques (halopéridol, dropéridol) est utile. Avec le coma d'apoplexie (se développe avec divers processus intracérébraux), le principal symptôme est l'hémiplégie ou la paralysie de groupes musculaires individuels. La paralysie apparaît lorsque les yeux et la tête sont tournés dans la direction opposée à celle du paralysé : "le patient regarde la lésion dans le cerveau". La bouche est inclinée du côté sain : « fumer la pipe du côté malade ». Du côté hémiplégique, le membre surélevé tombe rapidement et lourdement sur le lit, tandis que le membre non atteint revient lentement à sa position d'origine. Le coma avec la maladie d'Addison (coma surrénalien, se développant souvent avec une tuberculose surrénalienne, un traumatisme, des maladies infectieuses) est rare. Le principal symptôme est une pression artérielle pathologiquement basse, souvent non mesurable. En plus de l'effondrement, ce symptôme est causé par des changements dans le métabolisme des glucides (hypoglycémie), un déséquilibre électrolytique et le métabolisme de l'eau. Soudain, il y a une pâleur aiguë, des sueurs froides. L'excitation est rapidement remplacée par l'adynamie, puis le patient perd connaissance. L'acrocyanose apparaît, la peau devient marbrée. Sur la peau du dos et des extrémités, la pigmentation se présente sous la forme de taches sombres et d'une éruption pétéchiale rouge vif. Les bruits cardiaques sont étouffés. La déshydratation et l'oligurie s'installent rapidement. Dans le sang, acidose métabolique, hypoglycémie et augmentation de l'azote résiduel. Le traitement consiste en l'introduction rapide de glucocorticoïdes à la dose de 1 mg/kg. La dose peut être augmentée de 2 à 3 fois. Une dose similaire est administrée par voie intramusculaire. Pour lutter contre la déshydratation, une solution isotonique de chlorure de sodium est administrée, puis du glucose. Conférence numéro 4. Réanimation cardiopulmonaire La réanimation cardiorespiratoire (RCP) est un ensemble de mesures chirurgicales et thérapeutiques effectuées en l'absence de blessures mettant la vie en danger et visant à restaurer et à soutenir la fonction du système cardiorespiratoire. Indications de la réanimation cardiopulmonaire : réalisée chez des patients sans pouls efficace sur les artères carotides ou pouls filiforme, faible, inconscients et (ou) en l'absence de mouvements respiratoires efficaces. Les cas les plus courants d'arrêt cardiaque primaire, ainsi que d'insuffisance respiratoire primaire. Contre-indications : traumatismes incompatibles avec la vie, stades terminaux de maladies incurables et mort biologique. Les principes de base Les efforts principaux en RCR visent à : 1) compression thoracique ; 2) soufflage d'air dans les poumons et ventilation ; 3) préparation et administration de médicaments ; 4) installation et entretien de l'accès intraveineux ; 5) activités spécialisées (défibrillation, pose de stimulateur cardiaque, intubation trachéale). Ainsi, pour compléter l'ensemble des activités, 4 personnes et un chef d'équipe sont nécessaires. Une personne devrait être en charge de la RCR. Cette personne doit intégrer toutes les informations disponibles et hiérarchiser l'impact. Il doit surveiller le moniteur ECG, l'utilisation de médicaments et s'assurer que les actions des autres membres de l'équipe sont corrigées. Il devrait être retiré de l'exécution des procédures qui nuisent au rôle de leadership. Depuis plus de 40 ans, l'alphabet de réanimation Safar est utilisé pour la RCP. Dans ce complexe, la séquence d'actions du réanimateur est maintenue; selon leur nom anglais, ils sont indiqués par les lettres correspondantes. A - Voies respiratoires - assurer la perméabilité des voies respiratoires. B - Respiration - ventilation pulmonaire artificielle (ALV) de manière accessible, par exemple lors de la respiration "bouche à bouche". C - Circulation - assurer l'hémocirculation - massage cardiaque indirect. D - Drogues - l'introduction de drogues. E - Électrocardiographie - Enregistrement ECG. F - Fibrilation - effectuer, si nécessaire, une défibrillation électrique (cardioversion). G - Jaugeage - évaluation des résultats primaires. H - Hypothermie - refroidissement de la tête. I - Soins intensifs - soins intensifs pour les syndromes post-réanimation. A - Voies respiratoires - gestion des voies respiratoires Le patient est placé horizontalement sur le dos. La tête est renversée le plus possible, pour cela le médecin met une main sous le cou, l'autre est placée sur le front du patient; une respiration test est prise de bouche à bouche. Si un patient dont le tonus musculaire est réduit est allongé sur le dos, sa langue peut couler, comme si elle remplissait la gorge. Dans le même temps, l'épiglotte descend, bloquant davantage les voies respiratoires. Apparaissent : respiration sonore, puis violations du rythme respiratoire jusqu'à son arrêt complet. De tels phénomènes se développent particulièrement rapidement chez les patients inconscients. Pour prévenir et éliminer la rétraction de la langue, la mâchoire inférieure doit être avancée et en même temps une hyperextension de l'articulation occipito-cervicale doit être réalisée. Pour ce faire, avec la pression des pouces sur le menton, la mâchoire inférieure du patient est décalée vers le bas, puis avec les doigts placés aux coins de la mâchoire, ils la poussent vers l'avant, complétant cette technique par une surextension de la tête vers l'arrière ( technique triple Safar). Avec la conduite correcte et opportune de ces manipulations, la perméabilité des voies respiratoires au niveau du pharynx est rapidement restaurée. Les corps étrangers (caillots sanguins, mucus, prothèses dentaires, etc.) peuvent être à l'origine d'une obstruction des voies respiratoires. Ils sont rapidement enlevés avec tout matériel improvisé (serviette, mouchoir). La tête du patient doit être tournée sur le côté en raison du risque d'aspiration. La restauration de la perméabilité des voies respiratoires supérieures est facilitée par l'utilisation de divers conduits d'air. Le plus approprié est l'utilisation d'un conduit en forme de S. Pour son introduction, la bouche du patient est ouverte avec les doigts croisés II et I, et le tube est avancé jusqu'à la racine de la langue afin que son ouverture "glisse" le long du palais. Il faut veiller à ce que le conduit d'air ne bouge pas pendant le transport. Si toutes les procédures décrites ne sont pas efficaces, nous pouvons supposer la présence d'une obturation des voies respiratoires dans les sections sous-jacentes. Dans ces cas, une laryngoscopie directe et une aspiration active des sécrétions pathologiques sont nécessaires, suivies d'une intubation trachéale pendant 10 à 15 secondes. Il est conseillé de réaliser une conicotomie et une trachéotomie. B - Respiration - ventilation pulmonaire artificielle (ALV) de manière accessible La méthode la plus simple et la plus efficace de respiration artificielle lors de la réanimation est la méthode du «bouche à bouche», lorsque l'air expiré du réanimateur est insufflé dans les poumons de la victime sous pression. Après avoir renversé la tête de la victime, d'une main ils lui pincent les narines, mettent l'autre main sous son cou, respirent profondément, pressent fermement ses lèvres sur les lèvres de la victime (chez les enfants, sur les lèvres et sur le nez en même temps) et insuffler de l'air dans les poumons de la victime, en observant le soulèvement de la poitrine pendant le temps d'inspiration. Dès que la poitrine se soulève, l'injection d'air est arrêtée, ils déplacent leur visage sur le côté, respirent à nouveau profondément et le patient a à ce moment une expiration passive. Après 2-3 gonflages des poumons, la présence d'une impulsion sur l'artère carotide est déterminée, si elle n'est pas détectée, ils procèdent alors à une restauration artificielle de la circulation sanguine. La ventilation manuelle est utilisée à l'aide d'un sac auto-expansible de type Ambu. Lors de l'utilisation d'un ventilateur, la fréquence respiratoire est de 12 à 15 par minute, le volume inspiratoire est de 0,5 à 1,0 litre. Dans un hôpital, une intubation trachéale est effectuée et le patient est transféré vers un ventilateur. C-Circulation - assurer l'hémocirculation - massage cardiaque indirect Le massage à cœur fermé est le moyen le plus simple et le plus efficace d'assistance circulatoire artificielle d'urgence. Le massage à cœur fermé doit être commencé immédiatement, dès que le diagnostic d'arrêt circulatoire aigu est posé, sans en préciser les causes et les mécanismes. En cas de contractions cardiaques inefficaces, il ne faut pas attendre un arrêt cardiaque complet ou une restauration indépendante d'une activité cardiaque adéquate. Règles de base pour le massage à cœur fermé. 1. Le patient doit être en position horizontale sur une base solide (sol ou canapé bas) pour éviter la possibilité de déplacement de son corps sous le renforcement des mains massantes. 2. La zone d'application de la force des mains du réanimateur est située sur le tiers inférieur du sternum, strictement le long de la ligne médiane; le réanimateur peut être de chaque côté du patient. 3. Pour le massage, une paume est placée au-dessus de l'autre et une pression est appliquée sur le sternum dans la zone située 3-4 doigts transversaux au-dessus du lieu de fixation au sternum du processus xiphoïde; les mains du masseur, redressées au niveau des articulations du coude, sont positionnées de manière à ce que seul le poignet produise une pression. 4. La compression de la poitrine de la victime est effectuée en raison de la gravité du torse du médecin. Le déplacement du sternum vers la colonne vertébrale (c'est-à-dire la profondeur de la déviation de la poitrine) doit être de 4 à 6 cm. 5. La durée d'une compression thoracique est de 0,5 s, l'intervalle entre les compressions individuelles est de 0,5 à 1 s. Taux de massage - 60 mouvements de massage par minute. Par intervalles, les mains ne sont pas retirées du sternum, les doigts restent levés, les bras sont complètement étendus au niveau des articulations du coude. Lorsque la réanimation est effectuée par une seule personne, après deux injections rapides d'air dans les poumons du patient, 15 compressions thoraciques sont effectuées, c'est-à-dire que le rapport "ventilation: massage" est de 2 : 15. Si 2 personnes participent à la réanimation, alors ce rapport est de 1: 5, c'est-à-dire qu'il y a 5 compressions thoraciques par respiration. Une condition préalable au massage cardiaque est la surveillance constante de son efficacité. Les critères d'efficacité du massage doivent être considérés comme suit. 1. Modification de la couleur de la peau : elle devient moins pâle, grise, cyanosée. 2° Constriction des pupilles, si elles étaient dilatées, avec apparition d'une réaction à la lumière. 3. L'apparition d'un pouls sur les artères carotide et fémorale, et parfois sur l'artère radiale. 4. Détermination de la pression artérielle au niveau de 60-70 mm Hg. Art. lorsqu'il est mesuré à l'épaule. 5. Parfois, l'apparition de mouvements respiratoires indépendants. S'il y a des signes de restauration de la circulation sanguine, mais en l'absence de tendance à préserver une activité cardiaque indépendante, un massage cardiaque est effectué soit jusqu'à l'obtention de l'effet souhaité (rétablissement d'un flux sanguin efficace), soit jusqu'à ce que les signes de vie disparaissent définitivement avec le développement de symptômes de mort cérébrale. En l'absence de signes de restauration d'un flux sanguin même réduit, malgré un massage cardiaque pendant 25 à 30 minutes, le patient doit être reconnu comme mourant et les mesures de réanimation peuvent être arrêtées. D - Médicaments - administration de médicaments En cas d'arrêt aigu de la circulation sanguine, l'introduction d'agents stimulant l'activité cardiaque doit commencer dès que possible, si nécessaire, être répétée lors de la réanimation. Après le début du massage cardiaque, 0,5 à 1 ml d'adrénaline doivent être injectés dès que possible (par voie intraveineuse ou intratrachéale). Ses introductions répétées sont possibles après 2-5 minutes (jusqu'à 5-6 ml au total). Avec l'asystole, l'adrénaline tonifie le myocarde et aide à "démarrer" le cœur, avec la fibrillation ventriculaire, elle contribue à la transition de la fibrillation à petites ondes vers les grandes ondes, ce qui facilite grandement la défibrillation. L'adrénaline facilite le flux sanguin coronaire et augmente la contractilité du muscle cardiaque. Au lieu de l'épinéphrine, l'isodrine peut être utilisée, ce qui est 3 fois plus efficace que l'adrénaline en termes d'efficacité de l'effet sur le myocarde. La dose initiale est de 1 à 2 ml par voie intraveineuse et la suivante de 1 à 2 ml dans 250 ml d'une solution de glucose à 5%. Dans des conditions de circulation sanguine altérée, l'acidose métabolique augmente progressivement, par conséquent, immédiatement après la perfusion d'adrénaline, une solution à 4-5% de bicarbonate de sodium est administrée par voie intraveineuse à raison de 3 ml/kg de poids corporel du patient. En train de mourir, le tonus du système nerveux parasympathique augmente considérablement, le cerveau est épuisé, par conséquent, les M-cholinolytiques sont utilisés. En cas d'asystole et de bradycardie, l'atropine est administrée par voie intraveineuse dans une solution à 0,1% - 0,5-1 ml, jusqu'à une dose maximale de 3-4 ml. Pour augmenter le tonus myocardique et réduire l'effet de l'hyperkaliémie, l'administration intraveineuse de 5 ml d'une solution à 10% de chlorure de calcium est recommandée. L'adrénaline, l'atropine et le chlorure de calcium peuvent être administrés ensemble dans la même seringue. Avec une tachycardie sévère et surtout avec le développement d'une fibrillation, l'utilisation de lidocaïne à une dose de 60 à 80 mg est indiquée, mais comme elle est à courte durée d'action, elle est perfusée à un débit de 2 mg/min. Il est également indiqué d'utiliser des glucocorticoïdes qui, en augmentant la sensibilité des structures myocardiques adrénoréactives aux catécholamines et en normalisant la perméabilité des membranes cellulaires, contribuent à la restauration d'une activité cardiaque adéquate. E - Électrocardiographie - Enregistrement ECG À l'aide d'une étude ECG, la nature de la violation de l'activité cardiaque est déterminée. Le plus souvent, il peut s'agir d'asystole - arrêt complet des contractions cardiaques, fibrillation - contraction chaotique non coordonnée des fibres myocardiques avec une fréquence de 400 à 500 battements / min, dans laquelle le débit cardiaque s'arrête pratiquement. Initialement, une fibrillation à grandes ondes est notée, qui passe en 1 à 2 minutes en fibrillation à petites ondes, suivie d'une asystole. La présence de tout rythme sur l'ECG est préférable à l'absence totale d'activité électrique du myocarde. Par conséquent, la tâche clé de la RCP est de stimuler l'activité électrique du myocarde et de la modifier ensuite en un rythme efficace (présence d'un pouls). La présence d'asystole sert de marqueur d'un trouble sévère de la perfusion myocardique et constitue un mauvais signe pronostique pour la restauration du rythme cardiaque. Cependant, il est important de différencier la fibrillation ventriculaire à micro-ondes de faible amplitude et l'asystolie, ce qui est mieux fait dans les dérivations ECG standard 2-3. L'épinéphrine (1 mg par voie intraveineuse) et l'atropine (1 mg augmenté à 2-4 mg) sont les plus efficaces pour restaurer l'activité électrique. Dans les cas réfractaires, la correction des taux de potassium et de calcium est efficace. Fibrillation ventriculaire (FV) Chez les patients sans pouls, une thérapie immédiate par impulsions électriques en aveugle doit être effectuée (avant que la cause de l'arrêt circulatoire ne soit reconnue par ECG), car la FV est la cause la plus fréquente de mort subite et le succès de la défibrillation est largement déterminé par le moment où elle est effectuée. . Il convient de noter que la défibrillation "à l'aveugle" ne nuira pas aux patients souffrant d'asystolie et de bradycardie et est généralement efficace chez les patients souffrant de tachycardie et de FV. Il est important de se rappeler que la règle de la cardioversion "aveugle" n'est pas acceptable chez les enfants, car ils sont beaucoup plus susceptibles que la FV d'avoir un arrêt respiratoire comme cause de maladie terminale. Le succès de la défibrillation dépend de l'amplitude de la FV, qui à son tour est inversement corrélée à la durée de l'épisode de FV. Si deux tentatives initiales de cardioversion sont inefficaces, dans ce cas il faut administrer de l'épinéphrine pour augmenter l'amplitude des ondes de fibrillation et augmenter le tonus vasculaire (en cas de restauration du rythme cardiaque, elle permet d'augmenter la perfusion du cœur et du cerveau). En revanche, il faut utiliser des doses optimales d'adrénaline pour ne pas augmenter la demande en oxygène du myocarde. F - Fibrillation - effectuer une défibrillation électrique si nécessaire (cardioversion) La fibrillation cardiaque peut être éliminée par l'utilisation de la défibrillation électrique. Il est nécessaire d'appliquer étroitement les électrodes sur la poitrine (en position antérolatérale, une électrode est située dans la région de l'apex du cœur, la seconde dans la région sous-clavière à droite du sternum), ce qui augmente la force du décharge et, par conséquent, l'efficacité de la défibrillation. Chez un certain nombre de patients, la position antéropostérieure (apex du cœur - espace interscapulaire) des électrodes est plus efficace. N'appliquez pas d'électrodes sur les recouvrements du moniteur ECG. Il convient de noter que la défibrillation électrique n'est efficace que lorsque des oscillations de grande onde d'une amplitude de 0,5 à 1 mV ou plus sont enregistrées sur l'ECG. Ce type de fibrillation myocardique indique la sécurité de ses ressources énergétiques et la possibilité de rétablir une activité cardiaque adéquate. Si les oscillations sont faibles, arythmiques et polymorphes, ce qui est observé dans l'hypoxie myocardique sévère, la possibilité de rétablir l'activité cardiaque après la défibrillation est minime. Dans ce cas, à l'aide d'un massage cardiaque, d'une ventilation mécanique, d'une administration intraveineuse d'adrénaline, d'atropine, de chlorure de calcium, il est nécessaire de réaliser le transfert de la fibrillation vers les grandes ondes, et seulement après cela, la défibrillation doit être effectuée. La première tentative de défibrillation est effectuée avec une décharge de 200 J, avec les tentatives suivantes, la charge est augmentée à 360 J. Les électrodes doivent être humidifiées et fermement pressées contre la surface de la poitrine. Les erreurs les plus courantes lors de la défibrillation, qui entraînent l'inefficacité de cette dernière, sont les suivantes. 1. Longues interruptions du massage cardiaque ou absence totale de réanimation lors de la préparation du défibrillateur pour la sortie. 2. Pression lâche ou humidification insuffisante des électrodes. 3. Application d'une décharge dans le contexte d'une fibrillation à ondes basses sans prendre de mesures qui augmentent les ressources énergétiques du myocarde. 4. Appliquer une décharge de tension faible ou excessivement élevée. Il convient de noter que la défibrillation électrique du cœur est une méthode efficace pour corriger des arythmies cardiaques telles que la tachycardie ventriculaire paroxystique, le flutter auriculaire, la tachycardie nodale et supraventriculaire, la fibrillation auriculaire. L'indication de la défibrillation électrique, au stade préhospitalier, est le plus souvent la tachycardie ventriculaire paroxystique. Une caractéristique de la défibrillation dans ces conditions est la présence de conscience chez le patient et la nécessité d'éliminer la réaction à la douleur lors de l'application d'une décharge électrique. G - Jaugeage - évaluation des résultats primaires L'évaluation primaire des résultats est effectuée non seulement pour déterminer l'état du système circulatoire et respiratoire, mais également pour définir les tactiques d'autres mesures thérapeutiques. À la fin du processus de réanimation, au cours duquel la restauration de l'activité cardiaque est apparue, le réanimateur doit effectuer un certain nombre d'actions finales : 1) évaluer l'état des voies respiratoires (symétrie de la respiration, avec poursuite de la respiration forcée, adéquation de la ventilation); 2) vérifier la pulsation dans les artères centrales et périphériques ; 3) évaluer la couleur de la peau ; 4) déterminer le niveau de tension artérielle ; 5) mesurer le volume de sang circulant (mesurer la CVP, évaluer l'état des veines du cou); 6) vérifier la position correcte des cathéters dans les veines centrales ; 7) en cas d'élimination de la fibrillation cardiaque, qui a été la cause de la mort subite, s'assurer que la perfusion de tout agent antifibrillaire est poursuivie ; 8) passent la correction de la thérapeutique, si elle était passée au malade avant l'épisode de la mort subite. H - Hypothermie - refroidissement de la tête Avec l'hypothermie, le temps critique d'arrêt circulatoire peut augmenter de manière significative. Pour prévenir le développement de l'encéphalopathie posthypoxique, des mesures doivent être prises pour réduire l'intensité des processus métaboliques dans le cerveau, ainsi que les médicaments antihypoxiques et antioxydants. Activités principales 1. Hypothermie craniocérébrale - enveloppant la tête et le cou avec des packs de glace, de la neige, de l'eau froide. 2. Administration parentérale d'antihypoxants (oxybutyrate de sodium, mafusol, petites doses de sédatifs), ainsi que l'amélioration des propriétés rhéologiques du sang (rhéopolyglucine, hemodez, héparine, trental). 3. L'introduction d'antagonistes du calcium (nimoton, lidoflazine, etc.). 4. Introduction d'antioxydants (mafusol, unitiol, vitamine C, catalase, etc.). I - Soins intensifs - effectuer des soins intensifs des syndromes post-réanimation Bien qu'une réponse positive rapide à la RCP améliore les chances d'un pronostic favorable chez les patients, le développement ultérieur d'une septicémie, d'une insuffisance pulmonaire aiguë et d'une pneumonie est possible, ce qui aggrave naturellement le pronostic. La survie à long terme des patients atteints de maladies antérieures des organes vitaux après la RCR n'est pas typique, car pendant cette période, leurs lésions s'approfondissent et les centres nerveux qui assurent le contrôle autonome et le maintien des réflexes protecteurs sont endommagés. De plus, lorsqu'une compression thoracique intensive est utilisée, des ruptures du foie, de l'aorte, du pneumothorax, des fractures des côtes et du sternum sont notées. Les complications fréquentes sont la pneumonie par aspiration, les convulsions (dues à une ischémie cérébrale) et l'intoxication à la lidocaïne. Un certain nombre de patients développent des saignements dus à des ulcères de stress de l'estomac et du duodénum. Après la RCR, il y a une augmentation significative du niveau des enzymes hépatiques (et/ou des muscles squelettiques), bien que le développement d'une nécrose hépatique et l'insuffisance de sa fonction soient rares. Dans les régimes de défibrillation à haute énergie, il y a une augmentation significative du niveau de créatine phosphokinase, mais une augmentation de la fraction MB n'est présente qu'avec des décharges répétées à haute énergie. 1. Correction du CBS et de l'équilibre eau-électrolyte. Souvent, après la RCP, une alcalose métabolique, une hypokaliémie, une hypochlorémie et d'autres troubles électrolytiques se développent. Il y a un changement de pH vers un environnement acide ou alcalin. La clé de la correction du pH est une ventilation adéquate. L'utilisation de bicarbonate doit être effectuée sous le contrôle de la composition gazeuse du sang. En règle générale, il n'est pas nécessaire d'introduire NSO3 avec la restauration rapide de la circulation sanguine et de la respiration. Avec un cœur fonctionnel, un niveau de pH d'environ 7,15 est suffisant pour le fonctionnement du système cardiovasculaire. La dose de bicarbonate couramment recommandée (1 mg/kg) peut provoquer des effets indésirables, notamment : 1) alcalose arythmogène ; 2) augmentation de la production de CO2; 3) hyperosmolarité ; 4) hypokaliémie ; 5) acidose intracellulaire paradoxale du système nerveux central ; 6) décalage vers la gauche de la courbe de dissociation de l'hémoglobine, limitant l'apport tissulaire d'O2. Par conséquent, la nomination de ce médicament doit être strictement conforme aux indications. Pour éliminer l'hypokaliémie, une perfusion intraveineuse de chlorure de potassium est réalisée à la dose de 2 mmol/kg par jour. 2. Normalisation du système de défense antioxydant. La thérapie intensive comprend un complexe de médicaments antioxydants à action multidirectionnelle - mafusol, unitiol, vitamine C, multibiont, tocophérol, probucol, etc. 3. L'utilisation d'antioxydants aide à réduire l'intensité des processus métaboliques et, par conséquent, à réduire les besoins en oxygène et en énergie, ainsi que l'utilisation maximale de la quantité réduite d'oxygène disponible pendant l'hypoxie. Ceci est réalisé grâce à l'utilisation de médicaments de protection neurovégétative et d'antihypoxants (seduxen, dropéridol, bloqueurs de ganglions, mexamine, oxybutyrate de sodium, cytochrome, gutimin, etc.). 4. Une augmentation des ressources énergétiques est apportée par l'administration intraveineuse de solutions concentrées de glucose avec de l'insuline et les principales coenzymes impliquées dans l'utilisation de l'énergie (vitamine B6, cocarboxylase, ATP, riboxine, etc.). 5. La stimulation de la synthèse des protéines et des acides nucléiques - substrats absolument nécessaires au fonctionnement normal des cellules, la synthèse des enzymes, des immunoglobulines et autres, est réalisée par l'utilisation d'hormones anabolisantes (rétabolil, nérabolil, insuline, rétinol ), l'acide folique, ainsi que l'introduction de solutions d'acides aminés. 6. L'activation du métabolisme aérobie est obtenue en introduisant une quantité suffisante de substrats d'oxydation (glucose), ainsi qu'en utilisant l'oxygénation hyperbolique (HBO) - cette méthode garantit l'apport de la quantité d'oxygène requise même dans des conditions de violation brutale de sa livraison . 7. Amélioration des processus redox (acide succinique, riboxine, tocophérol, etc.). 8. La thérapie de désintoxication active contribue à la normalisation des processus métaboliques. Pour cela, diverses méthodes de thérapie par perfusion (gélatinol, albumine, plasma), diurèse forcée, etc. sont utilisées.Dans les cas graves, des méthodes de détoxification extracorporelle (hémosorption, hémodialyse, plasmaphérèse) sont utilisées. 9. Élimination des violations des processus de microcirculation. Pour cela, une thérapie à l'héparine est effectuée. Il n'existe pas de ligne directrice unique pour toutes les situations cliniques. Au cours de la RCP en cours, les signes neurologiques ne peuvent pas servir de marqueurs de résultat et, par conséquent, ne peuvent pas être guidés par eux lorsque la RCP est arrêtée. La réanimation est rarement efficace si plus de 20 minutes sont nécessaires pour rétablir un rythme cardiaque coordonné. Un certain nombre d'études ont montré que l'absence de réponse dans les 30 minutes à une RCP complète, à de rares exceptions près, entraîne la mort. Les meilleurs résultats se produisent en cas de cardioversion effective immédiate. Une réanimation prolongée avec un bon résultat neurologique est possible avec la fourniture d'une hypothermie et d'une dépression pharmacologique profonde du système nerveux central (par exemple, les barbituriques). Méthodes pour déterminer la non-viabilité du cerveau: 1) angiographie des vaisseaux cérébraux (manque de flux sanguin); 2) EEG (ligne droite pendant au moins 24 heures) ; 3) tomodensitométrie. Critères de résiliation CPR : 1) si dans les 30 minutes toutes les mesures de réanimation correctement effectuées n'apportent aucun effet - la respiration spontanée n'apparaît pas, la circulation sanguine n'est pas rétablie, les pupilles restent dilatées et ne réagissent pas à la lumière; 2) si dans les 30 minutes, il y a des arrêts cardiaques répétés qui ne se prêtent pas à la thérapie, et en même temps il n'y a aucun autre signe de réanimation réussie; 3) si, au cours de la réanimation, il s'est avéré que ce patient n'était pas du tout montré; 4) si dans les 45 à 60 minutes, malgré la restauration partielle de la respiration, la victime n'a pas de pouls et il n'y a aucun signe de restauration de la fonction cérébrale. Conférence n ° 5. Conditions d'urgence en pneumologie L'insuffisance respiratoire aiguë est un état pathologique du corps dans lequel la fonction de l'appareil respiratoire externe est insuffisante pour fournir au corps de l'oxygène et une élimination adéquate du dioxyde de carbone. Le volume courant normal (TO) est de 500 ml (ventilation alvéolaire - 350 ml, espace mort 150 ml). Volume de ventilation minute (MOV) - 6-8 l. Consommation d'oxygène - 300 ml/min. Dans l'air expiré, l'oxygène est de 16%, dans l'inspiration - 21%. L'oxygène dans le mélange inhalé doit être d'au moins 20 %. Causes d'insuffisance respiratoire aiguë: violation de la régulation centrale de la respiration ou inadéquation entre la ventilation et le flux sanguin au niveau des respirons - les dernières unités structurelles et fonctionnelles des poumons. Surdosage de substances narcotiques (inhalation), analgésiques narcotiques, œdème cérébral aigu, accident vasculaire cérébral, tumeurs cérébrales, réduction de la lumière des voies respiratoires ou obstruction complète, rétraction de la langue, crachats abondants, en particulier chez les patients atteints de maladies pulmonaires suppurées (abcès, bronchectasie), hémorragie pulmonaire, vomissements et aspiration, laryngospasme et bronchospasme. Lorsque la langue est rétractée, un conduit d'air doit être placé ou il est plus fiable d'intuber et de ventiler artificiellement. Avec l'accumulation de crachats, il est nécessaire de forcer le patient à l'expectorer. Si le patient est inconscient, les voies respiratoires sont désinfectées. Chez les patients graves, une anesthésie et un assainissement actif sont effectués. Le cathétérisme de la trachée, de l'arbre bronchique et l'élimination du contenu sont effectués. 1. Laryngospasme Le laryngospasme est la fermeture des vraies et des fausses cordes vocales. Dans les deux cas, des agents de contrôle (eufillin) sont obligatoirement utilisés. Si cela n'aide pas, il est nécessaire d'introduire des myorelaxants à action brève, d'intuber et de transférer le patient sous ventilation mécanique. Les relaxants musculaires provoquent une insuffisance respiratoire dans la période postopératoire si une décurarisation suffisante n'est pas effectuée. Il est généralement produit par des médicaments anticholinestérasiques (prozérine). Au moment de l'extubation, il est nécessaire de s'assurer que la force et le tonus musculaire ont récupéré (demander à lever la main, serrer la main, lever la tête). Avec de multiples fractures des côtes, une partie de la poitrine s'enfonce lors de l'inspiration, la respiration dite paradoxale se développe, il est donc nécessaire de restaurer le cadre thoracique. Pour ce patient, il est nécessaire d'intuber, après introduction de relaxants, avec un nouveau transfert en ventilation mécanique (jusqu'à ce que l'intégrité du thorax soit restaurée). Les éléments suivants entraînent une diminution du fonctionnement du parenchyme pulmonaire: atélectasie, collapsus pulmonaire, pneumonie, suites d'une intervention chirurgicale, pneumo-, hémo-, pyothorax. Différences entre atélectasie et collapsus : l'atélectasie est une obstruction à l'état redressé. Cette affection se caractérise par la présence d'un poumon non ventilé par lequel passe la moitié du sang circulant, ce dernier n'étant pas oxygéné. En conséquence, une insuffisance respiratoire aiguë se développe. Lorsque le poumon s'effondre, il est comprimé par l'air ou le liquide dans la cavité pleurale. Dans le même temps, la circulation sanguine dans le poumon comprimé diminue fortement et la circulation sanguine dans un poumon sain augmente. Par conséquent, l'effondrement n'est pas une complication aussi dangereuse en termes de développement d'une insuffisance respiratoire aiguë que l'atélectasie. Avant la chirurgie, la fonction du poumon intact doit être évaluée (spirographie séparée). Selon le stade de développement, l'insuffisance respiratoire aiguë est divisée en: 1) dysfonctionnement ; 2) insuffisance ; 3) défaillance de la fonction prothétique. Selon le taux de développement, l'insuffisance respiratoire aiguë est divisée en: 1) rapide comme l'éclair (se développe en une minute); 2) aigu (se développe en quelques heures); 3) subaiguë (se développe en quelques jours); 4) chronique (dure des années). Les principaux éléments de la réanimation pour insuffisance respiratoire aiguë : oxygénothérapie, position de drainage du patient, fibrobronchoscopie, trachéotomie, intubation et ventilation mécanique, bronchodilatation, hormonothérapie, OHB. 2. Embolie pulmonaire L'embolie pulmonaire (EP) est un blocage du tronc principal ou moyen, des petits troncs vasculaires de l'artère pulmonaire, entraînant une augmentation de la pression dans la circulation pulmonaire, une insuffisance ventriculaire droite. Facteurs prédisposants Maladies du système cardiovasculaire - athérosclérose, cardiopathie rhumatismale, malformations rhumatismales, endocardite septique. Maladies des veines des membres inférieurs, pathologie des organes et vaisseaux du petit bassin. L'EP postopératoire en particulier nécessite une attention particulière. Le plus souvent, l'embolie se développe lors d'opérations sur: les vaisseaux des membres inférieurs, la vessie, les organes génitaux féminins, la prostate, les os du bassin et l'articulation de la hanche. Les modifications du système d'hémostase, de fibrinolyse spontanée, de rétraction et d'organisation des thrombus veineux sont essentielles. Les patients atteints de maladies oncologiques, d'obésité, d'insuffisance circulatoire, contraints pour diverses raisons de rester au lit pendant une longue période sont également les plus à risque. Classification clinique de l'EP Forme : lourde, moyenne et légère. En aval : fulminant, aigu, récurrent. Selon le niveau d'atteinte de l'artère pulmonaire : tronc ou branches principales, branches lobaires (segmentaires), petites branches. Clinique et diagnostic L'évolution clinique de l'EP est assez variable. Les symptômes les plus fréquents sont l'apparition soudaine d'un essoufflement (RR allant de 30 à plus de 50 par minute), une respiration rapide, une pâleur, le plus souvent une cyanose, un gonflement des veines jugulaires, une tachycardie, une hypotension artérielle (jusqu'au choc), une douleur, toux et hémoptysie. L'auscultation détermine souvent le renforcement du tonus II sur l'artère pulmonaire. Signes radiographiques - augmentation de la taille de l'artère pulmonaire proximale, épuisement du motif périphérique, ainsi que soulèvement du dôme du diaphragme. L'ECG peut révéler une surcharge des bons services (cœur pulmonaire) : 1) l'apparition d'ondes Q avec augmentation simultanée de l'amplitude des dents R et S (syndrome QS) ; 2) rotation du cœur autour de l'axe longitudinal avec le ventricule droit vers l'avant (décalage de la zone de transition vers les dérivations thoraciques gauches) ; 3) sus-décalage du segment ST avec onde T négative dans les dérivations III, aVF, V1-V3 ; 4) l'apparition ou l'augmentation du degré de blocage de la jambe droite du faisceau de His; 5) dent "pulmonaire" pointue haute P avec une déviation de son axe électrique vers la droite; 6) tachycardie sinusale ou forme tachysystolique de fibrillation auriculaire. L'échocardiographie permet de détecter le cœur pulmonaire aigu, de déterminer la sévérité de l'hypertension dans la circulation pulmonaire, d'évaluer l'état structurel et fonctionnel du ventricule droit, de détecter une thromboembolie dans les cavités cardiaques et dans les principales artères pulmonaires, de visualiser un foramen ovale ouvert, qui peut affecter la sévérité des troubles hémodynamiques et être à l'origine d'embolies paradoxales. Cependant, un résultat échocardiographique négatif n'exclut nullement le diagnostic d'embolie pulmonaire. La méthode de diagnostic la plus informative est l'angiographie de l'artère pulmonaire. À des fins préventives, les anticoagulants sont utilisés dans la période postopératoire. La dose d'héparine est de 10 000 UI par jour (2 500 UI 4 fois). En présence de contre-indications, les anticoagulants ne sont pas prescrits. Les contre-indications incluent : lésions cérébrales graves ; oncopathologie avec possibilité de saignement ; thrombocytopénie; tuberculose pulmonaire; maladies chroniques graves du parenchyme du foie et des reins avec insuffisance fonctionnelle. traitement Traitement anticoagulant. Les anticoagulants peuvent prévenir la thrombose secondaire dans le lit vasculaire pulmonaire et la progression de la thrombose veineuse. Il est conseillé d'utiliser largement les héparines de bas poids moléculaire (daltéparine, ioxaparine, fraxiparine) qui, par rapport à l'héparine conventionnelle non fractionnée, entraînent rarement des complications hémorragiques, ont moins d'effet sur la fonction plaquettaire, ont une durée d'action plus longue et une biodisponibilité élevée. thérapie thrombolytique. Dans l'EP massive, le traitement thrombolytique est indiqué et justifié dans les cas où le volume de la lésion est relativement faible, mais où l'hypertension pulmonaire est prononcée. Le plus souvent, la streptokinase est utilisée à une dose de 100 000 unités par heure, mais il faut être conscient des réactions allergiques graves. La durée de la thrombolyse est généralement de 1 à 2 jours. L'urokinase et l'alteplase sont dépourvues de propriétés antigéniques, mais ont une résistance élevée. Opération. L'embolectomie est indiquée chez les patients présentant une thromboembolie du tronc pulmonaire ou de ses deux branches principales avec un degré extrêmement sévère de perfusion pulmonaire altérée, accompagné de troubles hémodynamiques prononcés. Toutes les manipulations pour retirer les emboles après le clampage de la veine cave ne doivent pas durer plus de 3 minutes, car cet intervalle est critique pour les patients subissant une intervention chirurgicale dans des conditions d'hypoxie initiale sévère. Il est optimal d'effectuer une embolectomie sous circulation extracorporelle en utilisant un accès transsternal. 3. Asthme bronchique L'asthme bronchique est une maladie basée sur une inflammation chronique des voies respiratoires à composante auto-immune, accompagnée d'une modification de la sensibilité et de la réactivité des bronches, se manifestant par une crise ou un état d'étouffement, avec des symptômes constants d'inconfort respiratoire, dans le contexte d'une prédisposition héréditaire aux maladies allergiques. Classification La classification de l'asthme bronchique est la suivante. 1. Stades de développement de l'asthme : 1) défauts biologiques chez des personnes pratiquement en bonne santé; 2) l'état de preastma ; 3) asthme cliniquement prononcé. 2. Variantes cliniques et pathogéniques : 1) atopique ; 2) infectieux-dépendant ; 3) auto-immune ; 4) désharmonieux ; 5) neuro-psychique ; 6) aspiré ; 7) réactivité bronchique primaire altérée. 3. La gravité de l'évolution de la maladie: 1) poumon ; 2) modéré ; 3) lourd. 4. Phases d'écoulement : 1) exacerbation ; 2) rémission instable ; 3) rémission stable (plus de 2 ans). 5. Complications : 1) pulmonaire - atélectasie, pneumothorax, insuffisance pulmonaire aiguë; 2) extrapulmonaire - cœur pulmonaire, insuffisance cardiaque. 6. Par étiologie : 1) atopique (exogène, allergique, immunologique); 2) non atopique (endogène, non immunologique). Les critères cliniques pour le degré de BA sont donnés dans le tableau 2. Tableau 2 Critères cliniques d'évaluation de la sévérité de l'asthme
état asthmatique L'état asthmatique est une crise incessante d'asthme bronchique, caractérisée par une insuffisance respiratoire aiguë obstructive au cours de la journée. Les principales caractéristiques distinctives de l'état de mal asthmatique sont l'absence d'effet de la thérapie bronchodilatatrice conventionnelle et une toux débilitante improductive. La classification de l'état de mal asthmatique est présentée dans le tableau 3. Tableau 3 Classification de l'état de mal asthmatique (Sorokina T. A., 1987)
La SA se caractérise par un essoufflement sévère de nature expiratoire avec la participation des muscles auxiliaires de la poitrine et de la paroi abdominale antérieure à l'acte de respiration, accompagné d'un changement de couleur de la peau - pâleur, hyperémie, cyanose. La peau peut être sèche et chaude ou froide et humide. La tachypnée est caractéristique, la fréquence respiratoire est généralement supérieure à 30 par 1 min. Écoute auscultatoire du son musical associé au passage de l'air à travers les bronchioles rétrécies. Avec la progression du processus, le phénomène bien connu des "zones silencieuses" des poumons se produit, ce qui indique une broncho-obstruction de cette région des poumons. Caractérisé par une tachycardie, une augmentation de la pression artérielle et du débit cardiaque (MOS). Diminution de la pression artérielle systolique pendant l'inspiration. Une déshydratation et une hypovolémie se développent. La perte de liquide se produit principalement par les voies respiratoires et la peau. Le volume de sang circulant (VSC) est généralement réduit de 10 % en moyenne et très rarement augmenté. Augmenter considérablement la viscosité du sang et l'hématocrite jusqu'à 0,50-0,60, ce qui crée une menace réelle de thromboembolie pulmonaire et nécessite la nomination d'héparine. La concentration de protéines est augmentée, la déshydratation générale se manifeste par la soif, la sécheresse de la langue, l'augmentation de l'osmolalité plasmatique et l'oligurie. La pression veineuse centrale (CVP) est réduite à 2-5 cm d'eau. Art. L'hypovolémie prédispose au collapsus, ce qui est particulièrement important lors du transfert des patients vers une ventilation mécanique. Au départ, il y a l'excitation, puis les troubles mentaux et la "panique respiratoire", qui est associée à une sensation de manque d'air. À l'avenir, l'irritabilité, la confusion, la léthargie (jusqu'à la stupeur et le coma) s'installent. Une acidose respiratoire se développe. Traitement d'urgence de l'état de mal asthmatique Oxygénothérapie. L'oxygène humidifié est inhalé2 à travers des cathéters nasaux ou à travers un masque à un débit de 1-2 l / min. L'adrénaline stimule les récepteurs a1-, b1- et b2-adrénergiques, dilate les bronches et réduit la résistance des voies respiratoires. Il est administré par voie sous-cutanée: avec un poids corporel inférieur à 60 kg - 0,3 ml, avec un poids de 60 à 80 kg - 0,4 ml, avec un poids supérieur à 80 kg - 0,5 ml. Eufillin inhibe la phosphodiestérase, qui contribue à l'accumulation d'AMPc et à l'élimination du bronchospasme. Lors de la prescription d'aminophylline, il convient de prendre en compte les contre-indications, notamment le tabagisme et l'enfance, l'insuffisance cardiaque et le syndrome coronarien aigu, les maladies chroniques des poumons, du foie et des reins. Avec la SA, la dose de charge d'aminophylline est de 3 à 6 mg/kg, elle est administrée par voie intraveineuse en 20 minutes. Ensuite, une perfusion goutte à goutte d'entretien du médicament est réalisée à raison de 0,6 mg/kg par heure pour un patient sans pathologie concomitante, 1 mg/kg par heure pour un fumeur, 0,8 mg/kg par heure pour un congestif. insuffisance cardiaque, pneumonie, maladies du foie et des reins, 1 mg/kg par heure pour les maladies pulmonaires chroniques sévères. L'effet de la corticothérapie est associé à la suppression de l'inflammation des voies respiratoires et à une sensibilité accrue aux médicaments b-adrénergiques. Plus la SA est sévère, plus l'indication d'une corticothérapie immédiate est importante. Une dose élevée de corticostéroïdes doit être administrée initialement. La dose minimale est de 30 mg de prednisolone ou 100 mg d'hydrocortisone, ou 4 mg de dexaméthasone (céleston). Si le traitement est inefficace, la dose est augmentée. Au moins toutes les 6 heures, des doses équivalentes appropriées de ces médicaments sont administrées. La plupart des patients reçoivent un traitement par inhalation avec des agonistes b-adrénergiques; (fénotérol, alupent, salbutamol). Les exceptions sont les cas de surdosage médicamenteux de sympathomimétiques. Si le traitement en cours ne donne pas d'effet, l'administration intraveineuse d'agonistes b-adrénergiques, tels que l'isoprotérénol, dilués dans une solution de glucose à 5%, est indiquée. Les contre-indications sont les maladies cardiaques (cardiosclérose coronarienne, infarctus du myocarde), la tachycardie sévère et les symptômes de tachyphylaxie, la vieillesse. Le débit d'administration de l'isoprotérénol est de 0,1 μg/kg par 1 min jusqu'à l'apparition de la tachycardie (HR 130 par 1 min ou plus). La thérapie par perfusion est le composant le plus important du traitement de la SA, visant à reconstituer la carence en liquide et à éliminer l'hypovolémie, le volume total de la thérapie par perfusion est de 3 à 5 litres par jour. L'hydratation est réalisée en introduisant des solutions contenant une quantité suffisante d'eau libre (solutions de glucose), ainsi que des solutions d'électrolytes hypo- et isotoniques contenant du sodium et du chlore. Les indicateurs d'une hydratation adéquate sont l'arrêt de la soif, une langue humide, le rétablissement d'une diurèse normale, une meilleure évacuation des expectorations et une diminution de l'hématocrite à 0,30-0,40. L'anesthésie à l'halothane peut être utilisée dans le traitement d'une crise d'asthme sévère qui ne se prête pas à une thérapie conventionnelle. Ventilation artificielle des poumons. Les indications pour le transfert des patients atteints de SA à la ventilation mécanique doivent être très strictes, car dans cet état, elles entraînent souvent des complications et se caractérisent par une mortalité élevée. Dans le même temps, la ventilation mécanique, si elle est pratiquée selon des indications strictes, est la seule méthode pouvant empêcher la progression ultérieure de l'hypoxie et de l'hypercapnie. Indications pour IVL: 1) progression régulière de la SA, malgré un traitement intensif ; 2) augmentation de la pCO2 et hypoxémie, confirmée par une série de tests; 3) progression des symptômes du SNC et coma ; 4) augmentation de la fatigue et de l'épuisement. Les mucolytiques et les expectorants sont divisés en deux groupes. 1. Les enzymes protéolytiques (trypsine, chymotrypsine) agissent en rompant les liaisons peptidiques des glycoprotéines, réduisant la viscosité et l'élasticité des expectorations. Ils sont efficaces dans les expectorations muqueuses et purulentes, ayant un effet anti-inflammatoire, mais peuvent provoquer des hémoptysies et des réactions allergiques. 2. Les dérivés de la cystéine stimulent l'activité sécrétoire dans l'épithélium cilié de l'arbre trachéobronchique (mukosolvan, mukomist), sont utilisés sous forme d'aérosol d'une solution à 20% de 2-3 ml 2-3 fois par jour. Conférence n ° 6. Conditions d'urgence en cardiologie 1. Infarctus du myocarde L'infarctus du myocarde est un écart entre la demande myocardique en oxygène et son apport, entraînant une nécrose limitée du muscle cardiaque. La cause la plus fréquente est un thrombus, moins souvent une embolie, moins souvent un spasme des artères coronaires. La thrombose est le plus souvent observée dans le contexte de lésions athéroscléreuses des artères coronaires. En présence de plaques d'athérome, un tourbillonnement du flux sanguin se produit. Les lésions athérosclérotiques se développent à la suite d'un métabolisme lipidique altéré, la coagulation sanguine augmente, ce qui est associé à une diminution de l'activité des mastocytes qui produisent de l'héparine. L'augmentation de la coagulation sanguine et de la turbulence contribue à la formation de caillots sanguins. La désintégration des plaques athéromateuses, leurs hémorragies peuvent entraîner la formation de caillots sanguins. Les facteurs prédisposants sont le sexe masculin, l'âge supérieur à 50 ans, l'obésité, l'hérédité, le stress psycho-émotionnel, le travail acharné. Clinique et diagnostic Classiquement, l'infarctus du myocarde commence par une douleur croissante derrière le sternum, qui est de nature brûlante et pressante. Caractérisé par une irradiation étendue de la douleur dans les bras (généralement à gauche), le dos, l'abdomen, la tête, sous l'omoplate gauche, dans la mâchoire inférieure gauche, etc. Les patients sont agités, anxieux, parfois ils notent un sentiment de peur de décès. Il existe des signes d'insuffisance cardiaque et vasculaire - extrémités froides, sueur moite, etc. Le syndrome douloureux se prolonge et n'est pas soulagé par la nitroglycérine pendant 30 minutes ou plus. Il existe divers troubles du rythme cardiaque, une baisse de la tension artérielle ou son élévation. Les patients notent subjectivement la sensation de manque d'air. Les signes ci-dessus sont typiques de la période I - douloureuse ou ischémique, dont la durée varie de plusieurs heures à 2 jours. Objectivement, une augmentation de la tension artérielle (puis une diminution) ; augmentation de la fréquence cardiaque ou perturbation du rythme ; à l'auscultation, une tonalité IV anormale est entendue; les bruits cardiaques sont étouffés ; accent sur le tonus de l'aorte II ; il n'y a pratiquement pas de changements biochimiques dans le sang, des signes caractéristiques sur l'ECG. La deuxième période est aiguë (fiévreuse, inflammatoire), caractérisée par la survenue d'une nécrose du muscle cardiaque au site de l'ischémie. La douleur disparaît généralement. La durée de la période aiguë peut aller jusqu'à 2 semaines. L'état de santé du patient s'améliore progressivement, mais une faiblesse générale, un malaise et une tachycardie persistent. Les bruits cardiaques sont étouffés. Une augmentation de la température corporelle due au processus inflammatoire du myocarde, généralement faible, jusqu'à 38 ° C, apparaît généralement au 3ème jour de la maladie. À la fin de la première semaine, la température revient généralement à la normale. Lors de l'examen du sang, ils trouvent: leucocytose, modérée, neutrophile (10-15 mille) avec un passage aux bâtonnets: les éosinophiles sont absents ou éosinopénie; accélération progressive de l'ESR ; La protéine C-réactive apparaît; augmentation de l'activité de la transaminase; augmentation de l'activité de la lactate déshydrogénase, de la créatine phosphokinase et d'autres marqueurs d'infarctus. Les cardiospécifiques sont la fraction CPK-MB et la troponine cardiaque. La troisième période (subaiguë ou période de cicatrisation) dure de 4 à 6 semaines. Caractéristique pour cela est la normalisation des paramètres sanguins (enzymes), la température corporelle se normalise, tous les autres signes d'un processus aigu disparaissent: l'ECG change, une cicatrice du tissu conjonctif se développe au site de la nécrose. La quatrième période (période de rééducation, récupération) dure de 6 mois à 1 an. Il n'y a pas de signes cliniques. Au cours de cette période, une hypertrophie compensatoire des fibres musculaires myocardiques intactes se produit et d'autres mécanismes compensatoires se développent. Il y a une restauration progressive de la fonction myocardique. Mais l'onde Q pathologique persiste à l'ECG. Mais il ne faut pas oublier la présence de formes atypiques d'infarctus du myocarde, souvent retrouvées en pratique clinique. Ceux-ci incluent les suivants. 1. La forme abdominale se déroule selon le type de pathologie du tractus gastro-intestinal avec des douleurs dans la région épigastrique, sous le processus xiphoïde, dans l'abdomen, accompagnées de nausées, de vomissements. Plus souvent, cette forme (abdominale) d'infarctus du myocarde survient avec un infarctus de la paroi postérieure du ventricule gauche. En général, l'option est rare. Dérivations ECG II, III et VL. 2. La forme asthmatique se caractérise par des signes d'asthme cardiaque et provoque en conséquence un œdème pulmonaire. La douleur peut être absente. La forme asthmatique est plus fréquente chez les personnes âgées atteintes de cardiosclérose ou en infarctus récidivant, ou en cas d'infarctus très étendus. Il y a essoufflement, suffocation, toux. Auscultatoire dans les poumons - râles bouillonnants fins et humides. 3. Forme cérébrale, ou cérébrale. Dans le même temps, au premier plan, les symptômes d'accident vasculaire cérébral par type d'accident vasculaire cérébral avec perte de conscience sont plus fréquents chez les personnes âgées atteintes de sclérose vasculaire cérébrale. Il y a des étourdissements, des nausées, des vomissements, des symptômes neurologiques focaux. 4. La forme silencieuse ou indolore est une découverte accidentelle lors d'un examen médical. Parmi les manifestations cliniques: tout à coup, il est devenu "malade", il y avait une faiblesse aiguë, une sueur collante, puis tout, à l'exception de la faiblesse, disparaît. Cette situation est typique d'une crise cardiaque à un âge avancé et d'infarctus du myocarde répétés. Une diminution non motivée de la tolérance à l'exercice se développe. 5. Forme arythmique: le principal symptôme est paroxystique - tachycardie, la douleur peut être absente. Il commence par un signe de tachycardie ventriculaire ou supraventriculaire, degré de bloc AV II-III, blocage aigu des jambes du faisceau auriculo-ventriculaire. Les attaques Morgagni-Adams-Stokes se produisent souvent dans l'ouverture. Dans la plupart des cas, les arythmies cardiaques se compliquent d'hypotension, de choc arythmogène et d'insuffisance cardiaque aiguë. Les signes d'infarctus du myocarde sur l'ECG sont les suivants : 1) avec infarctus du myocarde pénétrant ou transmural (c'est-à-dire que la zone de nécrose s'étend du péricarde à l'endocarde) : déplacement du segment ST au-dessus de l'isoligne, la forme est convexe vers le haut - comme un « dos de chat » ; fusion de l'onde T avec les segments ST les jours 1 à 3 ; l'onde Q profonde et large est le signe principal ; diminution de la taille de l'onde R, parfois forme QS ; changements discordants caractéristiques - décalages opposés de ST et T (par exemple, dans les 1ère et 2ème dérivations standard par rapport à la 3ème dérivation standard) ; en moyenne, à partir du 3ème jour, une dynamique inverse caractéristique des modifications de l'ECG est observée : le segment ST se rapproche de l'isoligne, un T profond uniforme apparaît. L'onde Q subit également une dynamique inverse, mais le Q et le T profond altérés peuvent persister toute la vie ; 2) avec infarctus du myocarde intra-muros ou non transmuraux : il n'y a pas d'onde Q profonde, le déplacement du segment ST peut être non seulement vers le haut, mais aussi vers le bas. Les principaux critères pour le diagnostic de l'infarctus du myocarde: 1) signes cliniques ; 2) signes électrocardiographiques ; 3) signes biochimiques. Complications : arythmies cardiaques, troubles de la conduction auriculo-ventriculaire, insuffisance ventriculaire gauche aiguë : œdème pulmonaire, asthme cardiaque, choc cardiogénique, troubles gastro-intestinaux (parésie de l'estomac et des intestins, saignement gastrique), péricardite, thromboendocardite pariétale, ruptures myocardiques, anévrisme aigu et chronique de le cœur, syndrome de Dressler, complications thromboemboliques, angine de poitrine post-infarctus. traitement Le traitement vise à prévenir les complications, à limiter la zone d'infarctus, à soulager la douleur et à corriger l'hypoxie. L'éloignement du syndrome douloureux : commencent par l'accueil des nitrates. En cas d'hypotension sévère, une neuroleptanalgésie est réalisée - fentanyl 1-2 ml par voie intraveineuse sur glucose, dropéridol 0,25% 2 ml pour 40 ml de solution de glucose à 5%. Avec un effet incomplet, la morphine 1% 1,0 est réintroduite après une heure par voie sous-cutanée ou intraveineuse par jet ; omnopon 2 % - 1,0 par voie sous-cutanée ou intraveineuse ; promedol 1% - 1,0 par voie sous-cutanée. Pour renforcer l'effet analgésique, soulager l'anxiété, l'anxiété, l'excitation, appliquer: analgin 50% - 2,0 par voie intramusculaire ou intraveineuse; diphenhydramine 1% - 1,0 par voie intramusculaire (effet sédatif) + chlorpromazine 2,5% - 1,0 par voie intramusculaire, intraveineuse (potentialisation du médicament). Pour limiter la zone de nécrose, des anticoagulants sont utilisés (héparine 5 1 unités - bolus de 1 ml suivi de l'administration intraveineuse d'une pompe à perfusion 6 250 unités par heure), des thrombolytiques (fibrinolysine XNUMX XNUMX unités par voie intraveineuse goutte à goutte; streptase XNUMX XNUMX dans une solution saline goutte à goutte par voie intraveineuse ) et antiagrégants plaquettaires (aspirine, cardiomagnyl, thrombo-ASS, Plavix). Prévention et traitement des arythmies. 1. Mélange polarisant, qui favorise la pénétration du potassium dans les cellules. 2. La lidocaïne est le médicament de choix, plus efficace pour les arythmies ventriculaires Bolus de 80 à 100 mg. 3. Cordarone ou amiodarone 450 mg par voie intraveineuse dans une solution saline. Étant donné que la fonction de pompage du cœur en souffre, la nomination de b-bloquants (egilok 12,5-25 mg) est indiquée pour améliorer la contractilité myocardique. En présence d'œdème dans les membres inférieurs ou de râles humides dans les poumons, des diurétiques sont utilisés (Lasix à une dose de 40 à 80 mg). L'accent est mis sur la pression artérielle, qui doit soit être augmentée avec l'hypotension (dopamine), soit réduite (goutte-à-goutte intraveineux d'isoket, médicaments antihypertenseurs - énalapril). Pour éliminer l'hypoxie, l'oxygénothérapie est réalisée à l'aide d'oxygène humidifié à travers un masque ou des cathéters nasaux. 2. Choc cardiogénique Le choc cardiogénique est un trouble circulatoire critique avec hypotension artérielle et signes de détérioration aiguë de la circulation sanguine dans les organes et les tissus. Clinique et diagnostic Le principal signe diagnostique est une diminution significative de la pression artérielle systolique, inférieure à 90 mm Hg. Art. La différence entre la pression systolique et diastolique (pression pulsée) est de 20 mm Hg. Art. ou devenir encore plus petit. De plus, une clinique d'une forte détérioration de la perfusion des organes et des tissus se développe: 1) troubles de la conscience allant d'une légère léthargie à la psychose ou au coma, des symptômes neurologiques focaux peuvent apparaître ; 2) diurèse inférieure à 20 ml/h. Symptômes de détérioration de la circulation périphérique : peau pâle cyanosée, marbrée, brique, moite ; veines périphériques effondrées, forte diminution de la température de la peau des mains et des pieds; diminution du flux sanguin. La valeur du CVP peut être différente. Les indicateurs normaux de CVP sont 5-8 cm d'eau. Art.; indicateur en dessous de 5 cm d'eau. Art. indique une hypovolémie et une pression artérielle basse, et au-dessus de 8 cm d'eau. Art. indique une insuffisance ventriculaire droite. Le diagnostic de choc cardiogénique n'est généralement pas difficile. Il est plus difficile de déterminer son type et ses principaux mécanismes physiopathologiques. Tout d'abord, il faut distinguer le vrai choc cardiogénique (contractile) du choc arythmique, réflexe (douloureux), médical dû à une insuffisance ventriculaire droite ou à une rupture myocardique à évolution lente. Lors de la conduite de soins intensifs pour un patient en état de choc, il est important d'exclure les causes d'hypotension artérielle, telles que l'hypovolémie, la tamponnade cardiaque, le pneumothorax sous tension, les complications thromboemboliques, et de ne pas manquer une hémorragie interne, par exemple, avec des érosions de stress ou des ulcères de Le tube digestif. traitement L'oxygénothérapie avec de l'oxygène humidifié à travers un masque ou des cathéters nasaux est indiquée. Les anticoagulants sont administrés en bolus à la dose de 10 000 UI, suivi de l'administration intraveineuse d'une pompe à perfusion à 1000 1 UI par heure. Il est nécessaire d'introduire des antalgiques : morphine 1,0 % 50 ml en sous-cutané ou en intraveineux par jet ; analgin 2% XNUMX ml par voie intramusculaire, intraveineuse. Toniques vasculaires : Cordiamine 1-4 ml par voie intraveineuse ; mezaton 1% 1,0 g par voie sous-cutanée, intraveineuse, dans une solution saline ; norépinéphrine 0,2 % 1,0 par voie intraveineuse. Le véritable choc cardiogénique est traité comme suit. Pour augmenter l'activité contractile du myocarde, on utilise ce qui suit: strophanthine 0,05% 0,5-0,75 g par voie intraveineuse lentement par 20,0 solution isotonique, korglukon 0,01 g par voie intraveineuse, également dans une solution isotonique ou dans un mélange polarisant, glucagon 2- 4 mg par voie intraveineuse goutte à goutte sur une solution polarisante. Normalisation de la tension artérielle : norépinéphrine 0,2 % 2 à 4 ml pour 1 litre de solution de glucose à 5 % ou de solution isotonique. La TA est maintenue à 100 mm Hg. Art., mezaton 1 % 1,0 g par voie intraveineuse ; cordiamine 2-4 ml, dopamine 200 mg dans 400 ml de rhéopolyglucine ou de glucose à 5%. Avec un effet instable des médicaments ci-dessus, l'hydrocortisone 200 mg, la prednisolone 90-120 mg sont utilisées. Normalisation des propriétés rhéologiques du sang (puisque des thrombus microvasculaires se forment nécessairement, la microcirculation est perturbée). Élimination de l'hypovolémie, car il y a transpiration de la partie liquide du sang: reopoliglyukin, polyglukin - dans un volume allant jusqu'à 100 ml à un débit de 50,0 ml par minute. Correction de l'équilibre acido-basique (lutte contre l'acidose) : bicarbonate de sodium 5 % à 200,0 ml. Réintroduction d'analgésiques. Restauration des troubles du rythme et de la conduction. Mais il est toujours nécessaire de contrôler le CVP, ce qui permet au réanimateur de déterminer la thérapie de perfusion acceptable. Les patients en état de choc cardiogénique ne doivent pas être chargés d'eau. Plus le CVP est élevé, moins il y a de traitement par perfusion. 3. Crise hypertensive Une crise hypertensive est une augmentation brutale de la pression artérielle à un niveau habituellement non caractéristique de ce patient, entraînant des troubles circulatoires régionaux aigus et des lésions des organes cibles (cœur, cerveau, reins, intestins). Les facteurs externes provoquant une crise peuvent être : 1) stress psycho-émotionnel; 2) influences météorologiques ; 3) consommation excessive de sel de table. Au printemps et en automne, les crises surviennent plus souvent qu'en hiver et en été. Les crises peuvent également survenir dans le contexte d'une exacerbation d'un certain nombre de maladies chroniques. M. S. Kushakovsky (1982) identifie les variantes suivantes des crises hypertensives: neurovégétatives, eau-sel, convulsives (encéphalopathie). Клиника Les symptômes cliniques de la crise se manifestent par des acouphènes, des mouches clignotantes devant les yeux, des maux de tête éclatants dans la région occipitale, aggravés par la flexion, les efforts, la toux, les nausées, les vomissements et les troubles du rythme cardiaque. Pendant une crise, des violations dangereuses de la circulation coronarienne cérébrale, moins souvent rénale et abdominale, se produisent, ce qui entraîne un accident vasculaire cérébral, un infarctus du myocarde et d'autres complications graves. L'ECG révèle une hypertrophie ventriculaire gauche. La radiographie thoracique montre une hypertrophie du cœur, une déformation de l'aorte sous la forme du chiffre "3", une usure des côtes résultant d'une augmentation du flux sanguin collatéral dans les artères intercostales. L'aortographie confirme le diagnostic. La forme neurovégétative de la crise se caractérise par une apparition soudaine, une excitation, une hyperémie et une humidité de la peau, une tachycardie, des mictions abondantes fréquentes, une augmentation prédominante de la pression systolique avec une augmentation de l'amplitude du pouls. Ces crises sont autrement appelées crises surrénales ou crises de type I. Les crises de type I ont généralement une évolution relativement bénigne, bien qu'elles puissent entraîner des arythmies paroxystiques ou une angine de poitrine et, dans les cas graves, un infarctus du myocarde. Avec la forme eau-sel de la crise, l'état s'aggrave progressivement, on note somnolence, faiblesse, léthargie, désorientation, pâleur et gonflement du visage et gonflement. La pression systolique et diastolique augmente uniformément ou avec la prédominance de cette dernière et une diminution de la pression différentielle. Ces crises sont appelées crises de type II. Les crises de type II, en règle générale, sont graves et peuvent être compliquées par un infarctus du myocarde, un accident vasculaire cérébral, une insuffisance ventriculaire gauche aiguë. Il faut souligner les crises hypertensives qui se développent à la suite d'un arrêt brutal d'un traitement antihypertenseur permanent, notamment la prise de b-bloquants, de nifédipine, de sympatholytiques et surtout de clonidine. traitement Le traitement d'une crise hypertensive consiste en une diminution urgente de la pression artérielle à un niveau normal, nécessaire pour prévenir ou limiter les dommages aux organes cibles dans l'hypertension artérielle, pour prévenir des complications pouvant aller jusqu'au décès dans les cas les plus graves, ou une incapacité permanente dans le développement de accident vasculaire cérébral, infarctus du myocarde. Dans la forme neurovégétative de la crise, un jet intraveineux, une administration lente de 0,1 mg de clonidine ou des perfusions intraveineuses répétées de 50 mg de labétalol sont habituellement utilisés. L'effet hypotenseur de la clonidine peut être renforcé par l'administration sublinguale de 10 mg de nifédipine. Dans les cas extrêmement graves, le nitroprussiate de sodium est injecté par voie intraveineuse et, en son absence, par goutte-à-goutte intraveineux ou très lentement de manière fractionnée - jusqu'à 50 mg de pentamine. Les principaux dangers et complications du traitement antihypertenseur: 1) hypotension artérielle ; 2) violation de la circulation cérébrale (accident vasculaire cérébral hémorragique ou ischémique, encéphalopathie); 3) œdème pulmonaire ; 4) angine de poitrine, infarctus du myocarde ; 5) tachycardie. Les crises hypertensives mettant en jeu le pronostic vital justifient des soins intensifs immédiats. Types de crises hypertensives. 1. Forme convulsive de crise hypertensive (encéphalopathie hypertensive aiguë sévère). 2. Crise avec phéochromocytome. 3. Hypertension artérielle aiguë dans les maladies et affections potentiellement mortelles (syndrome coronarien aigu, infarctus aigu du myocarde, anévrisme disséquant de l'aorte, hémorragie interne). 4. Crise hypertensive compliquée d'œdème pulmonaire ou d'accident vasculaire cérébral hémorragique. Une forme convulsive d'une crise hypertensive (encéphalopathie hypertensive aiguë sévère) se développe dans une forme maligne d'hypertension ou d'hypertension artérielle secondaire, par exemple dans la toxicose tardive de la femme enceinte ou la glomérulonéphrite aiguë. Les crises débutent par une céphalée lancinante et arquée sévère, une agitation psychomotrice, des vomissements répétés qui n'apportent aucun soulagement, des troubles visuels ; la perte de conscience survient rapidement et des convulsions cloniques-toniques apparaissent. Chez les patients présentant une hypertension artérielle récente (avec glomérulonéphrite aiguë, toxicose de la femme enceinte), une crise hypertensive convulsive peut se développer avec une augmentation relativement faible de la pression artérielle. Dans la forme convulsive de la crise, les soins d'urgence visent à éliminer le syndrome convulsif et à abaisser d'urgence la tension artérielle. Le syndrome convulsif est éliminé par l'administration intraveineuse de diazépam. De plus, 10 ml d'une solution à 25% de sulfate de magnésium peuvent être administrés par voie intraveineuse au goutte-à-goutte ou à jet lent, ou par voie intramusculaire. Le nitroprussiate de sodium, le labétalol, le diazoxide sont utilisés pour abaisser d'urgence la tension artérielle. Pour lutter contre l'œdème cérébral, l'administration par jet intraveineux de lasix est indiquée. Dans l'éclampsie, en particulier lorsqu'il est administré par voie intraveineuse, le sulfate de magnésium est encore largement utilisé, qui est administré à la dose de 4 g pour 100 ml d'une solution de glucose à 5 %. Ensuite, si nécessaire, une injection goutte à goutte du médicament est effectuée, ou au lieu de l'injection goutte à goutte ultérieure de sulfate de magnésium, 20 ml d'une solution à 25% de sulfate de magnésium peuvent être injectés profondément par voie intramusculaire. Le sulfate de magnésium par voie intraveineuse doit être évité si la femme enceinte est traitée avec des antagonistes du calcium (une chute brutale de la pression artérielle est dangereuse). Peut-être avec éclampsie et administration intraveineuse de chlorpromazine (100-250 mg), de diazoxide (300 mg). Seduxen (diazépam) est administré par voie intraveineuse lentement (20-30 mg), puis goutte à goutte (300 mg dans 500 ml de solution de glucose à 5%). Une crise de phéochromocytome se manifeste par une augmentation soudaine, très rapide et brutale de la pression artérielle, principalement systolique, et une augmentation de la pression différentielle, accompagnées d'une peau pâle, de sueurs froides, de palpitations, de douleurs au cœur et dans la région épigastrique, de nausées, de vomissements , maux de tête lancinants, étourdissements. Lors d'une crise, une augmentation de la température corporelle, des troubles visuels et auditifs sont possibles. Caractérisé par une diminution de la pression artérielle après le passage à une position verticale. Les soins d'urgence en cas de crise de phéochromocytome commencent par relever la tête du lit à un angle de 45°, ce qui provoque une diminution de la pression artérielle. Pour le traitement antihypertenseur d'urgence, le médicament de choix est la phentolamine, qui est administrée par voie intraveineuse dans un flux de 5 ml toutes les 5 minutes. Dans le même but, une injection intraveineuse de labétalol 50 ml toutes les 5 minutes ou une perfusion goutte à goutte de 30 ml de nitroprussiate de sodium dans 300 ml de solution de glucose à 5% est utilisée. Comme médicament complémentaire, le dropéridol (5-10 ml IV) peut être utile. Pour supprimer la tachycardie, le propranolol est prescrit à une dose de 20 à 40 mg. Dans l'infarctus aigu du myocarde (surtout souvent noté dans sa localisation antérieure), lorsque pendant une crise la charge sur le myocarde augmente, la demande en oxygène du myocarde augmente, tout d'abord, il est nécessaire d'arrêter une crise de douleur intense à l'aide d'analgésiques modernes ( y compris les analgésiques narcotiques) et administrer des sédatifs qui peuvent abaisser considérablement la tension artérielle. Si une hypertension importante persiste et que le tonus du système nerveux sympathique est augmenté, des b-bloquants (propranolol, métoprolol, esmolol) sont administrés par voie intraveineuse, ce qui, associé à l'effet hypotenseur, peut limiter la zone de péri -infarctus ischémie myocardique. Recourent souvent à l'administration intraveineuse de nitroglycérine pour provoquer une diminution de la pré- et post-charge. Cela vous permet de contrôler le niveau de pression artérielle. Cependant, la nomination de nitroprussiate de sodium doit être évitée, ce qui dans ces cas peut augmenter l'ischémie myocardique, apparemment en raison du phénomène de "vol coronaire" (réduction du flux sanguin collatéral coronaire vers la zone ischémique). Si l'HTA persiste après le stade aigu de l'infarctus du myocarde, un traitement par les principaux antihypertenseurs est instauré en tenant compte des indications et des contre-indications. Cependant, ces dernières années, dans le cadre des données sur la prévention secondaire, les b-bloquants et les inhibiteurs de l'ECA sont le plus souvent préférés, qui, en l'absence de contre-indications, sont tentés d'être prescrits dès le début. Avec le développement de l'insuffisance cardiaque aiguë, la crise hypertensive est arrêtée par l'administration intraveineuse de nitroglycérine (contre-indiquée en cas de sténose mitrale sévère); prescrire des vasodilatateurs (bien qu'une tolérance s'y développe souvent), IFKA. En cas d'hypertension persistante en cas d'insuffisance cardiaque sévère, on a recours à une association avec des diurétiques, et même de petites doses d'un diurétique thiazidique associé à un diurétique épargneur de potassium (triamtérène ou amiloride) peuvent non seulement normaliser la pression artérielle, mais également prévenir l'apparition des arythmies causées par une carence en potassium et en magnésium chez ces patients. (Metelitsa VI, 1996). En cas d'accident vasculaire cérébral hémorragique ou d'hémorragie sous-arachnoïdienne, la pression artérielle doit être réduite avec une attention particulière, à l'aide de médicaments dont l'effet hypotenseur peut être facilement contrôlé (nitroprussiate de sodium) et à un niveau supérieur à la normale (travail). Toute diminution de la pression artérielle, accompagnée d'une détérioration de l'état neurologique, doit être considérée comme excessive. En cas d'œdème pulmonaire, la nitroglycérine ou le nitroprussiate de sodium ou la pentamine, ainsi que le lasix, sont prescrits par voie intraveineuse pour abaisser d'urgence la tension artérielle. En cas d'anévrisme disséquant ou de rupture de l'aorte, les médicaments suivants sont utilisés par voie intraveineuse pour réguler la pression artérielle et se préparer au traitement chirurgical : nitroprussiate de sodium, diurétiques de l'anse (furosémide), nifédipine, propranolol (avec le nitroprussiate de sodium), méthyldopa, réserpine (en tant qu'additif agent). Dans les crises causées par une augmentation du débit cardiaque, une tachycardie et une augmentation prédominante de la pression systolique et pulsée sont souvent observées, un bon effet dans ces cas est l'administration intraveineuse d'anapriline, puis, si nécessaire, de furosémide. 4. Arythmies potentiellement mortelles Arythmie Une arythmie est un rythme cardiaque autre que sinusal. Un rythme cardiaque normal a les caractéristiques suivantes : 1) fréquence cardiaque de 60 à 120 par minute ; 2) le stimulateur cardiaque est le nœud sinusal, dont la preuve est une onde P positive précédant le complexe QRS dans la dérivation standard II et négative dans l'AVR ; 3) les intervalles RR ne diffèrent pas de plus de 0,01 s ; 4) les indicateurs réels, reflétant la taille des intervalles et des dents dans la norme. Tous les changements sur l'ECG sont effectués dans la dérivation standard II. Classification des arythmies 1. Violation de la formation des impulsions : 1) dans le nœud sinusal : a) tachycardie sinusale ; b) bradycardie sinusale ; c) arythmie sinusale ; d) maladie des sinus (SSS) ; 2) arythmies ectopiques : a) extrasystole ; b) tachycardie paroxystique ; c) fibrillation auriculaire et flutter ; d) scintillement et flutter des ventricules. 2. Violation de la conduction des impulsions : 1) voies supplémentaires (faisceaux de Kent); 2) bloc cardiaque : a) auriculaire (intra-auriculaire); b) auriculo-ventriculaire ; c) intraventriculaire. Mécanismes des arythmies Une diminution du potentiel de repos, le seuil d'excitabilité se produit uniquement sur la base d'une carence en potassium cellulaire, le rapport "plasma - cellule" (normalement 80 meq de potassium est dans la cellule et 5 meq dans le plasma). Asymétrie du foyer électrophysiologique-métabolique du myocarde due à l'ischémie, l'inflammation, la reperfusion lors de la thrombolyse. Faiblesse électrophysiologique du stimulateur supérieur. Voies de conduction accessoires congénitales. Tachycardie supraventriculaire paroxystique La tachycardie supraventriculaire paroxystique est une crise cardiaque soudaine avec une fréquence de 150 à 250 battements par minute. Il existe 3 formulaires : 1) auriculaire ; 2) nodal ; 3) ventriculaire. L'étiologie de la tachycardie paroxystique supraventriculaire est plus souvent associée à une augmentation de l'activité du système nerveux sympathique. Elle se manifeste cliniquement par une attaque soudaine de palpitations, les vaisseaux du cou palpitent, l'activité cardiaque passe à un rythme différent. La durée de l'attaque est de quelques minutes à plusieurs jours. Le nombre de battements cardiaques dans la forme ventriculaire est généralement compris entre 150 et 180 battements par minute, avec des formes supraventriculaires - 180-240 battements par minute. Lors d'une attaque, un rythme pendulaire est caractéristique auscultatoire, il n'y a pas de différence entre le ton I et II. Il augmente la demande en oxygène du myocarde et peut provoquer une crise d'insuffisance coronarienne aiguë. Signes ECG 1. Les complexes QRS ne sont pas modifiés. 2. Dans la forme supraventriculaire, l'onde P fusionne avec T. Le traitement débute par l'administration intraveineuse de cordarone à la dose de 300 mg ou de novocaïnamide jusqu'à 1 g, puis d'adénosine 1 ml - bolus à 1 % (10 mg). Les antagonistes du calcium vérapamil (Isoptin) sont utilisés par voie intraveineuse en bolus à une dose de 2,5 à 5 mg en 2 à 4 minutes. Mais il est utilisé pour les complexes QRS étroits et pour les complexes QRS larges, il peut fibriller. Il est possible de prendre des b-bloquants (propranolol 20-40 mg par voie sublinguale). Paroxysme de fibrillation auriculaire Le paroxysme de fibrillation auriculaire est caractérisé par l'absence de complexes auriculaires et, au lieu d'une isoligne, des ondes en dents de scie de flutter auriculaire sont détectées, qui sont plus distinctes dans les dérivations II, III et VF avec une fréquence de 250 à 400 battements par minute. Ou il n'y a pas de complexes auriculaires, des ondes de scintillement, des oscillations à grandes ou petites ondes de l'isoligne sont détectées, la fréquence des ondes auriculaires est de 350 à 600 battements par minute. Clinique. Le pouls est arythmique avec des ondes de remplissage différent, la présence d'un pouls déficitaire (la différence entre la fréquence cardiaque et le pouls) ; différents intervalles et différents volumes de bruits cardiaques pendant l'auscultation. Traitement. En cas de paroxysme, il débute par l'introduction de 0,25 mg de digoxine (1 ml à 0,025%) pour 20 ml de sérum physiologique en bolus intraveineux. Pour obtenir l'effet souhaité de saturation en glycosides, une dose de 1,5 mg de digoxine par jour ou 3 jours est recommandée. En cas de paroxysme non compliqué, le médicament de choix est le novocaïnamide, administré par voie intraveineuse lentement à une dose allant jusqu'à 2000 ml en 30 minutes (10 ml d'une solution à 10%) avec une surveillance constante de la pression artérielle, de la fréquence cardiaque et de l'ECG. Le flutter auriculaire est traité par thérapie par impulsions électriques. Tachycardie ventriculaire paroxystique La tachycardie ventriculaire paroxystique est caractérisée par la détection d'au moins 3 complexes QRS larges consécutifs (plus de 0,12 s) avec une fréquence de 100 à 250 battements par minute avec un décalage discordant du segment ST et de l'onde T dans la direction opposée à la onde principale du complexe QRS. La pirouette ou tachycardie ventriculaire fusiforme bidirectionnelle se produit lorsque l'intervalle QT est allongé.Dans ce cas, un rythme irrégulier est enregistré avec une fréquence cardiaque de 150 à 250 battements par minute avec de larges complexes QRS déformés polymorphes. Traitement. Dans des conditions d'hypodynamie de la circulation sanguine, une thérapie par électropulse est nécessaire, après quoi une thérapie d'entretien est effectuée avec une goutte de lidocaïne. Dans des conditions d'hémodynamique stable, le médicament de choix est la lidocaïne, bolus intraveineux de 1 à 2 mg / kg (80 à 100 mg) pendant 3 à 5 minutes, suivi d'une perfusion goutte à goutte pendant la journée à 4 mg / min. Extrasystole ventriculaire L'extrasystole ventriculaire est la survenue d'un complexe QRS déformé extraordinairement large, d'un décalage ST et T discordant, d'une pause compensatoire complète (l'intervalle entre l'onde P pré et post-extrasystolique est égal à deux fois l'intervalle RR normal). Le médicament de choix est la lidocaïne, qui est administrée selon le schéma ci-dessus. Peut-être l'utilisation de cordarone à une dose de 300 à 450 mg goutte à goutte par voie intraveineuse. Violation de la conduction AV avec développement de syncope (syndrome de Morgagni-Adams-Stokes) Lorsque la conduction est perturbée, divers types de blocs cardiaques se produisent, il y a un ralentissement ou un arrêt complet de la conduction de l'impulsion à travers le système de conduction du cœur. Le blocage sino-auriculaire est caractérisé par un dysfonctionnement des lymphocytes T et une altération de la conduction des impulsions du nœud sinusal aux oreillettes. Il y a 3 degrés. Je degré - ralentir l'impulsion. Sur l'ECG - allongement de l'intervalle PQ de plus de 0,20 s. Prolapsus du complexe QRS. L'intervalle RR est stable. II degré - perte d'une partie des impulsions, conduction incomplète. Mobitz type I - au fur et à mesure que les impulsions sont réalisées, l'intervalle PQ s'allonge progressivement jusqu'à la perte complète de l'onde de pouls. Le QRS n'est pas modifié. Au site du prolapsus QRS, la plus grande distance est RR. Pronostiquement, ce type est relativement favorable. Mobitz de type II avec un intervalle PQ constant et un complexe QRS inchangé. Dans le même temps, toutes les impulsions n'atteignent pas les ventricules - dans certains cas, une impulsion sur deux est effectuée, dans d'autres - tous les tiers, etc., c'est-à-dire qu'il y a un prolapsus périodique du complexe QRS 3: 2, 4: 3 , 5: 6, etc. d. Degré III - blocage complet de la conduction. Dans le même temps, la conduction des impulsions vers les ventricules est complètement arrêtée et un foyer hétérotopique de rythme idioventriculaire naît dans les ventricules, et plus l'automatisme est faible, plus la clinique est difficile. Une dissociation complète est observée: le rythme auriculaire est proche de la normale et les ventricules ont leur propre fréquence - 40 battements par minute ou moins. Ce dernier dépend du niveau de dommage: si le nœud AV souffre, 40-50 par 1 min, si la jambe du faisceau de His - 20 battements par 1 min ou moins. Le niveau de dommage est également indiqué par le degré de déformation du complexe QRS. Les sons cardiaques sont affaiblis, il y a périodiquement un ton "canon" I, lorsque la systole des oreillettes et des ventricules coïncide presque dans le temps. Peut être III tonalité supplémentaire. Des souffles d'éjection systolique peuvent apparaître à la base du cœur. On trouve souvent une pulsation des veines associée à la contraction auriculaire, particulièrement distincte avec le ton canon de Strazhesko. Clinique. Défaillance du cœur, si une impulsion tombe. Vertige si plusieurs impulsions tombent. Syndrome de Morgagni-Adams-Stokes (perte de conscience), si 6-8 complexes tombent. Traitement. Pour rétablir un rythme adéquat, l'atropine est administrée à une dose de 0,5-1 mg à 3 mg. Toutes les 3 minutes, 1 mg jusqu'à une dose totale de 0,4 mg/kg. Antagonistes calciques - isoptine 0,04 mg/kg. Avec des pertes de conscience fréquentes, le patient est transféré à une thérapie électropulsive permanente. Mais le plus souvent, la stimulation doit être effectuée "à la demande". Conférence numéro 7. Insuffisance rénale aiguë L'insuffisance rénale aiguë (IRA) est une complication d'un certain nombre de maladies rénales et extrarénales caractérisées par une forte détérioration ou un arrêt de la fonction rénale et se manifestant par le complexe de symptômes suivant : oligoanurie, azotémie, hyperhydratation, altération du CBS et de l'équilibre hydrique et électrolytique. Les formes de POO comprennent : 1) prérénal (hémodynamique); 2) rénal (parenchymateux); 3) postrénale (obstructive); 4) arénal. Étiologie Raisons du développement de l'insuffisance rénale aiguë prérénale. 1. Diminution du débit cardiaque (choc cardiogénique, arythmie paroxystique, tamponnade cardiaque, embolie pulmonaire, insuffisance cardiaque congestive). 2. Diminution du tonus vasculaire (septicémie, choc infectieux-toxique, choc anaphylactique, surdosage d'antihypertenseurs). 3. Diminution du volume intravasculaire efficace (perte de sang, perte de plasma, déshydratation - perte de 7 à 10 % du poids corporel, vomissements abondants, diarrhée, polyurie, hypovolémie avec néphropathie pendant la grossesse, syndrome néphrotique, péritonite, cirrhose du foie). 4. Violation de l'hémodynamique intrarénale (prise d'AINS, d'inhibiteurs de l'ECA, de médicaments radio-opaques, de sandimmune). 5. Empoisonnement à l'eau - hyperhydratation (production incontrôlée d'ADH dans les tumeurs malignes, maladies inflammatoires du système nerveux central, surdosage de médicaments - médicaments, barbituriques, antidiabétiques sulfanilamides, indométhacine, amitriptyline, cyclophosphamide). Raisons du développement de l'insuffisance rénale aiguë rénale. 1. Ischémie rénale (choc, déshydratation). 2. Dommages néphrotoxiques dus à l'exposition à : 1) médicaments (aminoglycosides, AINS, agents radio-opaques, sulfamides, phénacétine, barbituriques, céphalosporines, ampicilline, rimfapicine, sandimmune); 2) les néphrotoxines industrielles (sels de métaux lourds : mercure, chrome, cadmium, plomb, arsenic, platine, bismuth, or, uranium, baryum) ; 3) les néphrotoxines ménagères (éthylène glycol, alcool méthylique, dichloroéthane, tétrachlorure de carbone). 3. Obstruction intratubulaire par des pigments : 1) hémoglobine (hémolyse - transfusion sanguine incompatible, empoisonnement aux champignons, acide acétique, anémie hémolytique, syndrome hémolytique et urémique, purpura thrombocytopénique thrombotique); 2) urates (goutte, traitement immunosuppresseur du myélome multiple et de la leucémie lors d'efforts physiques intenses, chez les personnes inadaptées à la chaleur) ; 3) myoglobine (rhabdomyolyse traumatique, rhabdomyolyse non traumatique dans le coma, blessure électrique, engelures, éclampsie, myopathie alcoolique et héroïnomane, hypokaliémie et hypophosphatémie sévères, intoxication au monoxyde de carbone, sels de mercure, zinc, cuivre, médicaments, myosite virale, surdosage de statines et fibrates); 4) processus inflammatoires: OTIN de genèse médicinale et infectieuse (SIDA, HFRS, rougeole, mononucléose, leptospirose, mycoplasmose, rickettsiose) pyélonéphrite aiguë, glomérulonéphrite aiguë; 5) papillite nécrotique (diabète sucré, analgésique, néphropathie alcoolique); 6) pathologie vasculaire (vascularite - polyartérite noueuse, granulomatose de Wegener, sclérodermie systémique; thrombose artérielle ou veineuse, embolie bilatérale de l'artère rénale, lésion traumatique). Raisons du développement de l'insuffisance rénale aiguë post-rénale. 1. Pathologie des uretères : 1) obstruction (pierre, caillots sanguins, papillite nécrotique); 2) compression (tumeur des organes pelviens, fibrose rétropéritonéale). 2. Pathologie de la vessie (calculs, tumeurs, obstruction inflammatoire du col de la vessie, adénome de la prostate, altération de l'innervation dans les lésions de la moelle épinière et neuropathie diabétique). 3. Rétrécissement urétral. Classification Classification OPN selon E. M. Tareev. 1. Rein de choc. 2. Rein toxique. 3. Rein infectieux aigu. 4. Obstruction vasculaire. 5. Rein urologique. Options pour l'évolution de l'insuffisance rénale aiguë: cyclique, récurrente et irréversible. Клиника L'évolution clinique de l'insuffisance rénale aiguë comporte cinq stades. Le stade I de l'insuffisance rénale aiguë est initial, il dure depuis l'apparition du facteur étiologique jusqu'à l'apparition des premiers signes. A ce stade, les tactiques thérapeutiques visent à éliminer ou à atténuer l'impact du facteur étiologique: thérapie anti-choc, reconstituer le BCC, lutter contre l'insuffisance cardiaque, thérapie alcalinisante de l'hémolyse intravasculaire, combattre la douleur, traiter les affections septiques, etc. thérapie, le spasme des vaisseaux rénaux est éliminé sous le contrôle de la diurèse horaire. Plus la stimulation de la diurèse est débutée tôt, plus le pronostic est favorable. Le stade II de l'insuffisance rénale aiguë, ou oligoanurique, est caractérisé par un dysfonctionnement de 70 % des néphrons. Une miction inférieure à 500 ml par jour indique le développement de l'oligurie et sa diminution à 50 ml par jour. et ci-dessous indique l'anurie. Parallèlement à une violation de la capacité d'excrétion d'eau des reins, les fonctions de concentration et d'excrétion d'azote en souffrent également. Dans l'urine, la quantité d'électrolytes et d'azote diminue fortement. À ce stade, les modifications les plus prononcées de l'hémostase se produisent. Le traitement doit viser à maintenir un environnement interne constant afin de donner le temps et l'opportunité à l'épithélium rénal de se régénérer. Un état d'hyperhydratation se développe en raison de la perte d'électrolytes lors des vomissements et de la diarrhée. Il est donc nécessaire de stimuler la diurèse, mais uniquement sous le contrôle de la pression veineuse centrale. Améliore le flux sanguin rénal. Puisqu'il est nécessaire de contrôler strictement la diurèse, un cathétérisme de la vessie est effectué. Une altération de la fonction d'excrétion de l'azote par les reins conduit à une azotémie. Par conséquent, pour empêcher au maximum la dégradation des protéines dans le corps, il est nécessaire d'introduire une quantité suffisante de glucides (au moins 5 g/kg par jour.). Le fructose et le glucose sont introduits en y ajoutant du xylitol (sorbitol) dans des proportions de 2 : 1 : 1, et s'il n'y a pas de fructose, alors 3 parties de glucose et 1 partie de sorbitol. Si l'évolution est sévère et ne peut être traitée, des séances d'hémodialyse sont réalisées. Si le facteur étiologique est supprimé, après 5 à 7 jours de traitement, la diurèse commence à augmenter. La durée maximale de cette étape peut aller jusqu'à 2 semaines. Stade III de l'insuffisance rénale aiguë - polyurique précoce. Elle se caractérise par une augmentation progressive de la diurèse (de 200 à 300 ml par jour) jusqu'à 3 litres. Les fonctions d'excrétion et de concentration d'azote des reins ne se sont pas encore complètement rétablies, mais la concentration de potassium, de magnésium et de phosphates se normalise progressivement. La thérapie intensive au stade polyurique précoce devrait inclure les mêmes mesures que dans la précédente, à l'exception de la stimulation de la diurèse. Souvent, une hémodialyse est nécessaire. Le risque de déshydratation est élevé. Stade IV de l'insuffisance rénale aiguë - polyurie tardive. L'augmentation quotidienne de l'urine atteint 500 à 1000 8 ml et la diurèse peut atteindre 10 à XNUMX litres par jour ou plus. Dans les reins, les processus d'échange d'ions commencent à se rétablir. Les pertes de potassium, de magnésium, de phosphore et d'autres électrolytes augmentent fortement, les patients sont à risque de déshydratation et de déminéralisation. Par conséquent, les électrolytes et le liquide sont administrés par voie intraveineuse à ce stade. Stade V OPN, ou stade de récupération. La fonction de concentration des reins est restaurée. La diurèse commence à diminuer progressivement jusqu'à la normale (2-3 litres par jour) et la densité de l'urine augmente (1008-1028). Pour déterminer la gravité de la maladie et l'efficacité du traitement, les patients souffrant d'insuffisance rénale aiguë sont examinés quotidiennement dans le sang pour détecter les indicateurs de CBS, la concentration d'électrolytes, l'hémoglobine, le sucre, les protéines totales et les fractions protéiques, l'urée, l'azote résiduel et uréique. , créatinine, hématocrite et dans l'urine quotidienne - densité, quantité d'électrolytes et d'azote. traitement Les principes du traitement sont les suivants. 1. Traitement du choc : mesures anti-choc, glucocorticoïdes. 2. Reconstitution de BCC: polyglucine, réopoliglyukine, plasma, albumine, masse érythrocytaire. 3. Traitement des infections : antibiothérapie adéquate. 4. Déshydratation: solution isotonique, hypertonique, hypotonique de chlorure de sodium, glucose. 5. Empoisonnement avec des poisons : des antidotes sont introduits. 6. Rein urologique : élimination de l'obstruction. 7. Obstruction intratubulaire : traitement alcalinisant par perfusion intensive continue jusqu'à 60 heures (solution de mannitol à 10 % 3-5 ml/kg/h avec solution isotonique de chlorure de sodium, bicarbonate de sodium, glucose 400-600 ml/h, furosémide 30-50 mg / kg). 8. Élimination des spasmes des vaisseaux rénaux: eufillin 2,4% - 10 ml à nouveau après 4-6 heures, carillons 0,5% - 2-4-6 ml par voie intraveineuse, trental 3-5 mg / kg par jour, pentamine 0,5-1,0 mg /kg par jour, benzohexonium 0,3-0,5 mg/kg par jour, dropéridol 0,12 mg/kg par jour, dopamine 1,5-3 mg/kg. 9. Stimulation de la diurèse (après stabilisation de la tension artérielle et élimination de l'hypovolémie) : aminofilline, mannitol, lasix. 10. Contrôle de la diurèse horaire, de la pression artérielle, de la CVP. Indications de l'hémodialyse aiguë : insuffisance rénale aiguë hypercatabolique, absence d'effet du traitement conservateur avec insuffisance rénale aiguë non catabolique pendant 2-3 jours, hyperkaliémie supérieure à 6-6,5 mmol/l, acidose métabolique décompensée avec déficit en bases supérieur à 15 mmol/ l, créatinine sanguine supérieure à 600 µmol/l, urée sanguine supérieure à 30 mmol/l, hyperhydratation avec développement d'œdème pulmonaire ou cérébral. Conférence numéro 8. Insuffisance hépatique aiguë L'insuffisance hépatique aiguë est un complexe de symptômes caractérisé par une violation d'une ou plusieurs fonctions hépatiques due à des lésions aiguës ou chroniques de son parenchyme. Étiologie Les causes de l'insuffisance rénale aiguë peuvent être les virus de l'hépatite A, B, C, D, E, G, ainsi que les virus de l'herpès, le cytomégalovirus, le virus de la mononucléose infectieuse, le simplex et le zona, le Coxsackie, la rougeole, la septicémie qui se développe avec des abcès du foie et cholangite purulente, drogues, alcool, toxines industrielles, insuffisance cardiaque. L'IRA survient toujours avec des lésions organiques multiples : les reins, le système cardiovasculaire, les poumons, le pancréas et le cerveau sont impliqués dans le processus. L'altération de la fonction rénale se manifeste par une nécrose tubulaire aiguë. Complications pulmonaires - aspiration de contenu gastrique ou de sang, atélectasie, infections respiratoires. La pancréatite aiguë et la nécrose pancréatique peuvent entraîner la mort. Un trouble de l'homéostasie potentiellement mortel se développe. L'insuffisance hépatique s'explique par une dystrophie et une nécrobiose généralisée des hépatocytes. Clinique et diagnostic Les manifestations cliniques de l'ARF sont les suivantes. 1. La coagulopathie est causée par une déficience en facteurs de coagulation et une augmentation de l'activité fibrinolytique. Il prédispose aux saignements spontanés des muqueuses: des saignements gastro-intestinaux, utérins, nasaux peuvent être observés. Des hémorragies cérébrales sont possibles. Pour évaluer l'état du système d'hémostase, le temps de prothrombine est déterminé. 2. L'hypoglycémie se caractérise par un taux élevé d'insuline dans le plasma, qui est dû à une diminution de son absorption par le foie. Elle entraîne une détérioration rapide de l'état neurologique et la mort des patients. 3. Violations de l'équilibre eau-électrolyte et acido-basique. L'insuffisance rénale aiguë terminale se caractérise par une hyponatrémie, une hypophosphatémie, une hypocalcémie et une hypomagnésémie. Le changement d'état acido-basique n'a pas de sens univoque. L'alcalose respiratoire associée à la stimulation du centre respiratoire par des substances toxiques peut être remplacée par une acidose respiratoire due à l'augmentation de la pression intracrânienne et à la suppression de l'activité respiratoire. Dans le développement du coma hépatique en tant qu'évolution sévère de la maladie, les stades du précoma, du coma menaçant et du coma proprement dit sont distingués. Il existe également un coma hépatocellulaire (endogène), résultant d'une nécrose massive du parenchyme, porto-cave (pontage, shunt, exogène), dû à une exclusion importante du foie des processus métaboliques en raison de la présence d'anastomoses porto-caves prononcées, et coma mixte, survenant principalement avec une cirrhose du foie. Dans la période précomateuse, une anorexie progressive, des nausées, une diminution de la taille du foie, une augmentation de la jaunisse, une hyperbilirubinémie et une augmentation de la teneur en acides biliaires dans le sang se développent. À l'avenir, les troubles neuropsychiques, le ralentissement de la pensée, la dépression et parfois l'euphorie augmentent. Caractérisé par l'instabilité de l'humeur, l'irritabilité, la mémoire est perturbée, le sommeil est perturbé. Les réflexes tendineux augmentent, un petit tremblement des membres est caractéristique. L'azotémie se développe. Avec un traitement rapide, les patients peuvent sortir de cet état, mais le plus souvent, avec des modifications irréversibles graves du foie, un coma survient. Pendant la période de coma, une excitation est possible, qui est alors remplacée par une dépression (stupeur) et une altération progressive de la conscience jusqu'à sa perte complète. Des phénomènes méningés, des réflexes pathologiques, une agitation motrice, des convulsions se développent. La respiration est perturbée (comme Kussmaul, Cheyne-Stokes); le pouls est petit, arythmique; il y a hypothermie. Le visage du patient est hagard, les extrémités sont froides, une odeur de foie sucrée caractéristique se dégage de la bouche et de la peau, les phénomènes hémorragiques s'intensifient (hémorragies cutanées, saignements du nez, des gencives, varices de l'œsophage, etc.). L'insuffisance hépatique aiguë se développe rapidement, en quelques heures ou quelques jours, et avec un traitement rapide peut être réversible. Études de laboratoire : bilirubine, urée et créatinine dans le sang et l'urine, paramètres du système d'hémostase, formule sanguine complète et urine, CVP, ECG, osmolarité plasmatique et urinaire, électrolytes plasmatiques, hémoglobine plasmatique et urinaire libre, ALT, AST, phosphatase alcaline, LDH, CPK, temps de prothrombine. La tomodensitométrie du foie peut révéler une diminution de sa taille, mais la plupart des cliniciens se concentrent sur les données cliniques et de laboratoire. traitement Un soutien inotrope opportun est un élément essentiel des soins intensifs. Prévention des complications infectieuses - la nomination d'antibiotiques céphalosporines en association avec des médicaments antifongiques (amphotéricine-B). Hépatoprotecteurs et médicaments stabilisateurs de membrane : prednisolone jusqu'à 300 mg, vitamine C 500 mg, troxevasine 5 ml, étamsylate de sodium 750 mg, Essentiale 30 ml, tocophérol 4 ml par voie intramusculaire, cytomak 35 mg, cocarboxylase 300 mg, acide nicotinique 30-40 mg, complamine 900 mg, sirepar 5-10 ml, acide glutamique 1% 400 ml, vikasol 10 ml par voie intraveineuse, vitamines B. Inhibiteurs de la protéase, qui comprennent 100 400 unités corticales, XNUMX XNUMX unités de trasilol, antagonosan, gordox. Stimulation de la diurèse : reogluman 400 ml, mannitol, lasix jusqu'à 200 mg par voie intraveineuse, eufillin 240 mg. Pour corriger la coagulopathie, l'administration intraveineuse de vitamine K (10 mg par jour pendant 3 jours) est utilisée. L'effet se produit après 3 heures.Dans ce cas, l'élimination de l'hypoprothrombinémie associée à une mauvaise absorption de la vitamine K, résultant d'une carence en acides biliaires. En cas d'hémorragie ou de gestes invasifs suspectés (cathétérisme vasculaire, dialyse péritonéale), une masse plaquettaire ou du plasma frais congelé est administré par voie intraveineuse. L'œdème cérébral est une cause fréquente de décès. Le mannitol est administré à raison de 1 g/kg de poids corporel. Chez les insuffisants rénaux, le mannitol est prescrit en association avec l'ultrafiltration pour éviter l'hyperosmolarité et la surhydratation. Avec le développement du coma hépatique, le chlorure de potassium est prescrit (solution à 0,4-0,5% dans une solution de glucose à 5% avec un volume de 500 ml par voie intraveineuse) ou une solution de bicarbonate de sodium (avec acidose métabolique); Les patients respirent de l'oxygène humidifié à travers un cathéter nasal. Avec une diminution de la pression artérielle et veineuse, la polyglucine et l'albumine sont administrées par voie intraveineuse. En présence de saignements massifs, des mesures appropriées sont prises pour les arrêter, du sang d'un groupe est transfusé et des médicaments contenant des facteurs de coagulation du sang sont administrés. Avec des signes significatifs de coagulation intravasculaire disséminée, l'héparine est administrée par voie intraveineuse à une dose de bolus de 10 000 à 15 000 UI. En cas d'insuffisance rénale, une hémodialyse péritonéale et une plasmaphérèse sont réalisées, qui donnent un bon résultat, mais l'introduction d'héparine est contre-indiquée avant ces manipulations. Pour arrêter l'agitation psychomotrice et les convulsions, la diprazine, l'halopéridol, l'oxybutyrate de sodium sont prescrits. Dans les cas graves, recourir à l'intubation et à la ventilation mécanique. Il est important de se rappeler qu'il existe un risque élevé de saignement, donc toutes les manipulations doivent être effectuées avec une extrême prudence. Lors du retrait du patient du coma, l'étape suivante consiste à mener une thérapie intensive pour la maladie sous-jacente. Conférence n ° 9. Choc Le choc est une forme d'état critique du corps, se manifestant par un dysfonctionnement de plusieurs organes, qui se déchaîne sur la base d'une crise de circulation généralisée et, en règle générale, se termine par la mort sans traitement. Un facteur de choc est tout effet sur le corps qui dépasse les mécanismes adaptatifs en force. En état de choc, les fonctions de la respiration, du système cardiovasculaire et des reins changent, les processus de microcirculation des organes et des tissus et les processus métaboliques sont perturbés. Étiologie et pathogenèse Le choc est une maladie de nature polyétiologique. Selon l'étiologie de la survenue, les types de choc peuvent être différents. 1. Choc traumatique : 1) avec des blessures mécaniques - fractures osseuses, plaies, compression des tissus mous, etc.; 2) avec des brûlures (brûlures thermiques et chimiques); 3) sous l'influence d'une basse température - choc froid; 4) en cas de blessures électriques - décharge électrique. 2. Choc hémorragique ou hypovolémique : 1) se développe à la suite d'un saignement, d'une perte de sang aiguë; 2) à la suite d'une violation aiguë de l'équilibre hydrique, une déshydratation du corps se produit. 3. Choc septique (bactérien toxique) (processus purulents généralisés causés par une microflore gram-négative ou gram-positive). 4. Choc anaphylactique. 5. Choc cardiogénique (infarctus du myocarde, insuffisance cardiaque aiguë). Considéré dans la section conditions d'urgence en cardiologie. Dans tous les types de choc, le principal mécanisme de développement est la vasodilatation et, par conséquent, la capacité du lit vasculaire augmente, l'hypovolémie - le volume de sang circulant (BCC) diminue, car il existe divers facteurs: perte de sang, redistribution de liquide entre le sang et les tissus, ou une inadéquation du volume sanguin normal augmentant la capacité vasculaire. L'écart qui en résulte entre le BCC et la capacité du lit vasculaire est à l'origine de la diminution du débit cardiaque et des troubles de la microcirculation. Ce dernier entraîne de graves changements dans le corps, car c'est ici que s'effectue la fonction principale de la circulation sanguine - l'échange de substances et d'oxygène entre la cellule et le sang. Il s'ensuit un épaississement du sang, une augmentation de sa viscosité et une microthrombose intracapillaire. Par la suite, les fonctions cellulaires sont perturbées jusqu'à leur mort. Dans les tissus, les processus anaérobies commencent à prédominer sur les processus aérobies, ce qui conduit au développement d'une acidose métabolique. L'accumulation de produits métaboliques, principalement l'acide lactique, augmente l'acidose. Une caractéristique de la pathogenèse du choc septique est une violation de la circulation sanguine sous l'influence de toxines bactériennes, ce qui contribue à l'ouverture des shunts artério-veineux, et le sang commence à contourner le lit capillaire et se précipite des artérioles aux veinules. En raison d'une diminution du flux sanguin capillaire et de l'action des toxines bactériennes spécifiquement sur la cellule, la nutrition cellulaire est perturbée, ce qui entraîne une diminution de l'apport d'oxygène aux cellules. En cas de choc anaphylactique, sous l'influence de l'histamine et d'autres substances biologiquement actives, les capillaires et les veines perdent leur tonus, tandis que le lit vasculaire périphérique se dilate, sa capacité augmente, ce qui entraîne une redistribution pathologique du sang. Le sang commence à s'accumuler dans les capillaires et les veinules, provoquant une violation de l'activité cardiaque. Le BCC formé en même temps ne correspond pas à la capacité du lit vasculaire et le volume minute du cœur (débit cardiaque) diminue en conséquence. La stagnation du sang qui en résulte dans le lit microcirculatoire entraîne une rupture du métabolisme et de l'oxygène entre la cellule et le sang au niveau du lit capillaire. Les processus ci-dessus conduisent à une ischémie du tissu hépatique et à une perturbation de ses fonctions, ce qui aggrave encore l'hypoxie aux stades sévères du développement du choc. Désintoxication violée, formation de protéines, formation de glycogène et autres fonctions du foie. Le trouble du flux sanguin principal et régional et de la microcirculation dans le tissu rénal contribue à la perturbation des fonctions de filtration et de concentration des reins avec une diminution de la diurèse de l'oligurie à l'anurie, ce qui conduit à l'accumulation de déchets azotés dans les reins du patient. corps, comme l'urée, la créatinine et d'autres substances métaboliques toxiques. Les fonctions du cortex surrénalien sont altérées, la synthèse des corticostéroïdes (glucocorticoïdes, minéralocorticoïdes, hormones androgènes) est réduite, ce qui aggrave les processus en cours. Les troubles circulatoires dans les poumons expliquent la violation de la respiration externe, les échanges gazeux alvéolaires diminuent, un shunt sanguin se produit, une microthrombose se forme et, par conséquent, le développement d'une insuffisance respiratoire, qui aggrave l'hypoxie tissulaire. Клиника Le choc hémorragique est une réaction de l'organisme à la perte de sang qui en résulte (une perte de 25 à 30 % du BCC entraîne un choc grave). Dans la survenue d'un choc de brûlure, le facteur douleur et la perte plasmatique massive jouent un rôle prépondérant. Oligurie et anurie se développant rapidement. Le développement du choc et sa gravité sont caractérisés par le volume et le taux de perte de sang. Sur la base de ce dernier, on distingue le choc hémorragique compensé, le choc réversible décompensé et le choc irréversible décompensé. Avec un choc compensé, une pâleur de la peau, une sueur froide et collante, le pouls devient petit et fréquent, la pression artérielle reste dans la plage normale ou est légèrement réduite, mais légèrement, la miction diminue. En cas de choc réversible non compensé, la peau et les muqueuses deviennent cyanosées, le patient devient léthargique, le pouls est petit et fréquent, il y a une diminution significative de la pression artérielle et veineuse centrale, une oligurie se développe, l'indice d'Algover est augmenté, l'ECG montre un violation de l'apport d'oxygène au myocarde. Avec une évolution irréversible du choc, la conscience est absente, la pression artérielle chute à des chiffres critiques et peut ne pas être détectée, la peau est de couleur marbrée, une anurie se développe - arrêt de la miction. L'indice d'Algover est élevé. Pour évaluer la sévérité du choc hémorragique, la détermination du BCC, le volume de la perte de sang, est d'une grande importance. La carte d'analyse de la sévérité du choc et l'évaluation des résultats obtenus sont présentées dans les tableaux 4 et 5. Tableau 4 Carte d'analyse de la gravité des chocs
Tableau 5 Évaluation des résultats par total de points
L'indice de choc, ou indice d'Algover, est le rapport entre la fréquence cardiaque et la pression systolique. En cas de choc du premier degré, l'indice d'Algover ne dépasse pas 1. Au deuxième degré - pas plus de 2; avec un indice supérieur à 2, la condition est caractérisée comme incompatible avec la vie. Types de chocs Le choc anaphylactique est un complexe de diverses réactions allergiques de type immédiat, atteignant un degré de gravité extrême. Il existe les formes suivantes de choc anaphylactique : 1) forme cardiovasculaire, dans laquelle se développe une insuffisance circulatoire aiguë, se manifestant par une tachycardie, souvent accompagnée de troubles du rythme cardiaque, de fibrillation ventriculaire et auriculaire et d'une diminution de la pression artérielle; 2) forme respiratoire, accompagnée d'insuffisance respiratoire aiguë : essoufflement, cyanose, stridor, respiration bouillonnante, râles humides dans les poumons. Cela est dû à une violation de la circulation capillaire, un gonflement du tissu pulmonaire, du larynx, de l'épiglotte; 3) forme cérébrale due à l'hypoxie, à la microcirculation altérée et à l'œdème cérébral. Selon la gravité de l'évolution, on distingue 4 degrés de choc anaphylactique. I degré (léger) se caractérise par des démangeaisons de la peau, l'apparition d'une éruption cutanée, des maux de tête, des étourdissements, une sensation de rougeur à la tête. Degré II (modéré) - L'œdème de Quincke, la tachycardie, la baisse de la pression artérielle, l'augmentation de l'indice d'Algover rejoignent les symptômes précédemment indiqués. Le grade III (sévère) se manifeste par une perte de conscience, une insuffisance respiratoire et cardiovasculaire aiguë (essoufflement, cyanose, respiration stridorée, petit pouls rapide, forte diminution de la pression artérielle, indice d'Algover élevé). Le degré IV (extrêmement sévère) s'accompagne d'une perte de conscience, d'une insuffisance cardiovasculaire sévère: le pouls n'est pas déterminé, la pression artérielle est basse. Traitement. Le traitement est effectué selon les principes généraux du traitement de choc: restauration de l'hémodynamique, du flux sanguin capillaire, utilisation de vasoconstricteurs, normalisation du CBC et de la microcirculation. Des mesures spécifiques visent à inactiver l'antigène dans le corps humain (par exemple, pénicillinase ou b-lactamase en cas de choc provoqué par des antibiotiques) ou à prévenir l'effet de l'antigène sur le corps - antihistaminiques et stabilisateurs de membrane. 1. Perfusion intraveineuse d'adrénaline jusqu'à stabilisation hémodynamique. Vous pouvez utiliser la dopmine 10-15 mcg / kg / min, et avec des symptômes de bronchospasme et des agonistes b-adrénergiques: alupent, brikanil goutte à goutte par voie intraveineuse. 2. Thérapie par perfusion dans un volume de 2500 3000 à 4 400 ml avec inclusion de polyglucine et de rhéopolyglucine, à moins que la réaction ne soit provoquée par ces médicaments. Bicarbonate de sodium XNUMX% XNUMX ml, solutions de glucose pour restaurer le CBC et l'hémodynamique. 3. Stabilisateurs de membrane par voie intraveineuse : prednisolone jusqu'à 600 mg, acide ascorbique 500 mg, troxevasine 5 ml, étamsylate de sodium 750 mg, cytochrome C 30 mg (les doses quotidiennes sont indiquées). 4. Bronchodilatateurs : eufillin 240-480 mg, noshpa 2 ml, alupent (brikanil) goutte à goutte 0,5 mg. 5. Antihistaminiques : diphenhydramine 40 mg (suprastin 60 mg, tavegil 6 ml), cimétidine 200-400 mg par voie intraveineuse (les doses quotidiennes sont indiquées). 6. Inhibiteurs de la protéase : trasylol 400 100 U, contrical XNUMX XNUMX U. Le choc traumatique est un état pathologique et critique du corps qui est apparu en réponse à une blessure, dans lequel les fonctions des systèmes et organes vitaux sont altérées et inhibées. Lors d'un choc traumatique, on distingue les phases torpides et érectiles. Au moment de l'apparition, le choc peut être primaire (1-2 heures) et secondaire (plus de 2 heures après la blessure). Stade érectile ou phase d'occurrence. La conscience reste, le patient est pâle, agité, euphorique, inadéquat, peut crier, courir quelque part, éclater, etc. À ce stade, l'adrénaline est libérée, grâce à laquelle la pression et le pouls peuvent rester normaux pendant un certain temps. La durée de cette phase est de quelques minutes et heures à plusieurs jours. Mais dans la plupart des cas, il est court. La phase torpide remplace la phase érectile, lorsque le patient devient léthargique et adynamique, la pression artérielle diminue et une tachycardie apparaît. Les estimations de la gravité des blessures sont présentées dans le tableau 6. Tableau 6 Évaluation de l'étendue de la gravité des blessures
Après avoir calculé les points, le nombre résultant est multiplié par le coefficient. notes 1. En présence de blessures non spécifiées dans la liste du volume et de la gravité de la blessure, le nombre de points est attribué en fonction du type de blessure, en fonction de la gravité correspondant à l'une de celles répertoriées. 2. En présence de maladies somatiques qui réduisent les fonctions adaptatives du corps, la somme des points trouvée est multipliée par un coefficient de 1,2 à 2,0. 3. À l'âge de 50-60 ans, la somme des points est multipliée par un facteur de 1,2, plus âgé - par 1,5. Traitement. Les principales orientations du traitement. 1. Élimination de l'action de l'agent traumatique. 2. Élimination de l'hypovolémie. 3. Élimination de l'hypoxie. L'anesthésie est réalisée par l'introduction d'analgésiques et de médicaments, la mise en place de blocages. Oxygénothérapie, si nécessaire, intubation trachéale. Compensation des pertes sanguines et BCC (plasma, sang, rhéopolyglucine, polyglucine, érythromasse). Normalisation du métabolisme, à mesure que l'acidose métabolique se développe, du chlorure de calcium 10% - 10 ml, du chlorure de sodium 10% - 20 ml, du glucose 40% - 100 ml sont introduits. Lutte contre les carences vitaminiques (vitamines du groupe B, vitamine C). Hormonothérapie avec glucocorticostéroïdes - prednisolone par voie intraveineuse une fois 90 ml, puis 60 ml toutes les 10 heures. Stimulation du tonus vasculaire (mezaton, norépinéphrine), mais uniquement avec un volume de sang circulant reconstitué. Les antihistaminiques (diphenhydramine, sibazon) sont également impliqués dans la thérapie anti-choc. Le choc hémorragique est un état d'insuffisance cardiovasculaire aiguë qui se développe après qu'une quantité importante de sang a été perdue et entraîne une diminution de la perfusion des organes vitaux. Étiologie : blessures avec atteinte des gros vaisseaux, ulcères gastriques et duodénaux aigus, rupture d'un anévrisme de l'aorte, pancréatite hémorragique, rupture de la rate ou du foie, rupture de la trompe ou grossesse extra-utérine, présence de lobules placentaires dans l'utérus, etc. Selon les données cliniques et l'ampleur de la déficience du volume sanguin, les degrés de gravité suivants sont distingués. 1. Non exprimé - il n'y a pas de données cliniques, le niveau de pression artérielle est normal. Le volume de sang perdu peut atteindre 10% (500 ml). 2. Faible - tachycardie minimale, légère diminution de la tension artérielle, quelques signes de vasoconstriction périphérique (mains et pieds froids). Le volume de sang perdu est de 15 à 25% (750-1200 ml). 3. Modéré - tachycardie jusqu'à 100-120 battements par minute, diminution de la pression différentielle, pression systolique 1-90 mm Hg. Art., anxiété, transpiration, pâleur, oligurie. Le volume de sang perdu est de 100 à 25% (35-1250 ml). 4. Sévère - tachycardie supérieure à 120 battements par minute, pression systolique inférieure à 60 mm Hg. Art., souvent non déterminé par le tonomètre, stupeur, pâleur extrême, extrémités froides, anurie. Le volume de sang perdu est supérieur à 35% (plus de 1750 ml). Laboratoire dans le test sanguin général, une diminution du taux d'hémoglobine, des érythrocytes et de l'hématocrite. L'ECG montre des modifications non spécifiques du segment ST et de l'onde T, qui sont dues à une circulation coronarienne insuffisante. Le traitement du choc hémorragique comprend l'arrêt du saignement, l'utilisation d'une thérapie par perfusion pour restaurer le CBC, l'utilisation de vasoconstricteurs ou de vasodilatateurs, selon la situation. La thérapie par perfusion implique l'administration intraveineuse de liquide et d'électrolytes dans un volume de 4 litres (solution saline, glucose, albumine, polyglucine). En cas de saignement, une transfusion de sang et de plasma d'un groupe est indiquée dans un volume total d'au moins 4 doses (1 dose correspond à 250 ml). L'introduction de médicaments hormonaux, tels que les stabilisateurs de membrane (prednisolone 90-120 mg), est montrée. Selon l'étiologie, une thérapie spécifique est effectuée. Le choc septique est la pénétration d'un agent infectieux à partir de son foyer initial dans le système sanguin et sa propagation dans tout le corps. Les agents responsables peuvent être: des bactéries staphylococciques, streptococciques, pneumococciques, méningococciques et entérococciques, ainsi que Escherichia, Salmonella et Pseudomonas aeruginosa, etc. Le choc septique s'accompagne d'un dysfonctionnement des systèmes pulmonaire, hépatique et rénal, d'une violation du sang système de coagulation, qui conduit au syndrome thrombohémorragique (syndrome de Machabeli), qui se développe dans tous les cas de septicémie. L'évolution de la septicémie est affectée par le type d'agent pathogène, ce qui est particulièrement important avec les méthodes de traitement modernes. Une anémie progressant en laboratoire est notée (due à l'hémolyse et à l'oppression de l'hématopoïèse). Leucocytose jusqu'à 12 109 / l, cependant, dans les cas graves, une forte dépression des organes hématopoïétiques se forme, une leucopénie peut également être observée. Symptômes cliniques du choc bactérien : frissons, forte fièvre, hypotension, peau sèche et chaude - au début, puis plus tard - froide et humide, pâleur, cyanose, trouble de l'état mental, vomissements, diarrhée, oligurie. Caractérisé par une neutrophilie avec un déplacement de la formule leucocytaire vers la gauche jusqu'aux myélocytes ; L'ESR augmente à 30-60 mm/h ou plus. Le niveau de bilirubine sanguine est augmenté (jusqu'à 35-85 µmol/l), ce qui s'applique également à la teneur en azote résiduel dans le sang. La coagulation sanguine et l'indice de prothrombine sont abaissés (jusqu'à 50-70%), la teneur en calcium et en chlorures est réduite. La protéine sanguine totale est réduite, ce qui se produit en raison de l'albumine, et le niveau de globulines (alpha-globulines et b-globulines) augmente. Dans l'urine, les protéines, les leucocytes, les érythrocytes et les cylindres. Le niveau de chlorures dans l'urine est réduit et l'urée et l'acide urique sont élevés. Le traitement est principalement de nature étiologique, par conséquent, avant de prescrire une antibiothérapie, il est nécessaire de déterminer l'agent pathogène et sa sensibilité aux antibiotiques. Les agents antimicrobiens doivent être utilisés aux doses maximales. Pour le traitement du choc septique, il est nécessaire d'utiliser des antibiotiques couvrant tout le spectre des micro-organismes à Gram négatif. La plus rationnelle est l'association de la ceftazidime et de l'impinem, qui ont prouvé leur efficacité contre Pseudomonas aeruginosa. Des médicaments tels que la clindamycine, le métronidazole, la ticarcilline ou l'imipinem sont les médicaments de choix en cas d'apparition d'un agent pathogène résistant. Si les staphylocoques sont semés à partir du sang, il est nécessaire de commencer le traitement avec des médicaments du groupe de la pénicilline. Le traitement de l'hypotension est à la première étape du traitement dans l'adéquation du volume de liquide intravasculaire. Utiliser des solutions cristalloïdes (solution isotonique de chlorure de sodium, Ringer lactate) ou colloïdes (albumine, dextran, polyvinylpyrrolidone). L'avantage des colloïdes est que lors de leur introduction, les pressions de remplissage requises sont atteintes le plus rapidement et le restent longtemps. S'il n'y a pas d'effet, un support inotrope et (ou) des médicaments vasoactifs sont utilisés. La dopamine est le médicament de choix car c'est un bêta-agoniste cardiosélectif. Les corticostéroïdes réduisent la réponse globale aux endotoxines, aident à réduire la fièvre et ont un effet hémodynamique positif. Prednisolone à la dose de 60 à 90 mg par jour. Conférence numéro 10. Intoxication aiguë Empoisonnement aigu - maladies d'étiologie chimique, dont le tableau clinique se développe avec une seule ingestion de produits chimiques dans le corps humain à une dose toxique pouvant entraîner des violations des fonctions vitales et mettre la vie en danger. Selon la cause et le lieu de l'événement, on distingue les types d'empoisonnement suivants. 1. Empoisonnement accidentel (accidents) au travail - exposition à des poisons industriels lors d'un accident ou en violation des règles techniques de sécurité pendant la période de travail avec des substances nocives; dans la vie quotidienne - lorsqu'il y a une utilisation erronée ou incorrecte de produits chimiques ménagers, en cas d'automédication avec des médicaments, leur surdosage ou leur utilisation erronée, avec intoxication alcoolique et médicamenteuse, piqûres d'insectes venimeux et de serpents; erreurs médicales. 2. Empoisonnements délibérés - empoisonnements suicidaires (vrais ou démonstratifs) et empoisonnements criminels (dans le but de tuer ou de mettre dans un état d'impuissance); "police" (lors de l'utilisation de produits chimiques et de poisons pour rétablir l'ordre public) et combattre l'empoisonnement (lors de l'utilisation d'armes chimiques), y compris à la suite d'actes terroristes. Selon le nombre de victimes, on distingue les intoxications aiguës individuelles, de groupe et de masse. L'ingestion d'une substance toxique est possible par la bouche (incorporée, orale), par les voies respiratoires (inhalation), la peau non protégée (percutanée), par injection parentérale, ou par injection dans le rectum, le vagin, le conduit auditif externe. Dans l'évolution clinique de l'intoxication aiguë, on distingue deux stades : toxicogène et somatogène. L'essence de l'étape toxique est que la substance active dans le corps a une dose qui peut provoquer un effet toxique spécifique. Le stade somatogène survient après l'élimination ou la destruction d'une substance toxique et se manifeste sous la forme de "traces" ou de violations résiduelles de l'état structurel et fonctionnel des organes et des systèmes. Principes généraux pour le diagnostic d'une intoxication aiguë 1. Le diagnostic clinique est basé sur les données suivantes : 1) inspection des lieux pour la découverte de preuves matérielles d'empoisonnement ; 2) anamnèse à partir des paroles de la victime ou d'autres - vous pouvez savoir quelle substance toxique la victime a prise, l'heure de prise de la substance toxique, la dose de substance toxique prise, la voie de pénétration de la substance toxique dans le corps , les circonstances qui ont accompagné le développement de l'empoisonnement, etc.; 3) étudier le tableau clinique de la maladie pour identifier les symptômes spécifiques d'empoisonnement caractéristiques d'une certaine substance toxique ou d'un groupe de substances selon le principe de la "toxicité sélective". 2. Le diagnostic toxicologique en laboratoire vise la détermination qualitative ou quantitative des substances toxiques dans les milieux biologiques de l'organisme (sang, urine, etc.). 3. Le diagnostic pathologique consiste en la détection de signes post-mortem spécifiques d'empoisonnement et est effectué par des experts médico-légaux. 1. Intoxication à l'alcool méthylique L'alcool méthylique est absorbé par toutes les voies - respiratoire, digestive et percutanée. La dose létale de méthanol lorsqu'elle est prise par voie orale varie de 40 à 250 ml, mais la prise même de 10 à 20 ml peut provoquer la cécité. L'intoxication survient également après la prise de divers mélanges alcooliques contenant de 1,5 à 2,5 % de méthanol. Après absorption, le méthanol est distribué dans tous les tissus en raison de sa solubilité dans l'eau. La plus grande quantité s'accumule dans les reins et le tractus gastro-intestinal, la plus petite dans le cerveau, les muscles et le tissu adipeux. Les lésions anatomiques pathologiques comprennent un œdème cérébral et des lésions de la nature initialement inflammatoire, puis dystrophique, des cellules ganglionnaires rétiniennes. Dans certains cas, en plus des dommages au système nerveux, des lésions dégénératives du foie, des reins, des poumons et du muscle cardiaque sont découvertes. Image clinique Dans l'effet toxique du méthanol, une action en deux phases peut être distinguée. Dans la période initiale (phase I), le méthanol agit sur l'organisme comme une molécule entière et a un effet majoritairement narcotique, mais plus faible que celui de l'alcool éthylique. Par la suite (phase II), l'effet néfaste des produits d'oxydation se manifeste. Dans le tableau clinique, on distingue les périodes: intoxication, bien-être latent ou relatif (d'une durée de plusieurs heures à 1-2 jours), les principales manifestations d'intoxication et, avec une évolution favorable, un développement inverse. Selon la gravité, on distingue légère, modérée (ou ophtalmique) et sévère (ou généralisée). Avec une intoxication légère, on note de la fatigue, des maux de tête, des nausées et un état d'intoxication légère, qui surviennent après une période de latence de 30 minutes à plusieurs heures. L'absorption simultanée d'alcool éthylique et méthylique augmente la période de latence et réduit la gravité de l'intoxication. En cas d'intoxication modérée, après une courte période de latence, le patient développe des maux de tête, des vertiges, des douleurs abdominales aiguës (principalement dans la région épigastrique), des vomissements, de l'agitation, du délire, des convulsions. Finalement, un coma profond s'installe. Le patient souffre d'hypothermie, dans certains cas de cyanose, lorsqu'une insuffisance respiratoire de nature centrale se développe, suivie d'une insuffisance cardiovasculaire. A ce stade, les pupilles se dilatent et l'étude du fond d'œil indique la présence d'un œdème rétinien. Des troubles visuels caractéristiques, tels qu'une acuité visuelle réduite, un rétrécissement du champ, des pupilles dilatées, une perte de réflexe à la lumière, des douleurs dans le globe oculaire surviennent du 2e au 6e jour. L'examen du fond d'œil révèle des signes d'atrophie du nerf optique. La complication la plus grave est la cécité totale. traitement Le traitement comprend les points suivants. 1. Arrêter l'entrée de poison dans le corps. Cessation de l'utilisation de poison, élimination de l'atmosphère contaminée, élimination du poison de la peau. 2. Élimination du poison non absorbé (du tractus gastro-intestinal): 1) sonde de lavage gastrique ; 2) l'utilisation d'adsorbants ou de laxatifs salins ; 3) lavement nettoyant ou siphon. 3. Élimination du poison absorbé : 1) forcer la diurèse ; 2) méthodes de désintoxication extracorporelle (hémosorption, hémodialyse, dialyse péritonéale, chirurgie de remplacement du sang). 4. Thérapie antidote, c'est-à-dire neutralisation du poison par neutralisation physique ou chimique, ainsi que compétition avec le poison pour les points d'application. 6. Maintenir les fonctions vitales du corps. 7. Normalisation de l'état eau-électrolyte, acido-basique du corps. 8. Traitement des conséquences à long terme et des complications. Lavage gastrique avec de l'eau ou une solution de bicarbonate de sodium à 2 %, suivi de l'ingestion de 30 g de sulfate de magnésium (sodium) dans 100 ml d'eau. En sous-cutané 2 ml de cordiamine, 1 ml de solution de caféine à 20 %. Dans le coma, par voie intraveineuse, une solution à 5% d'alcool éthylique dans une solution de glucose à 5% à raison de 1,5-2 g d'alcool pour 1 kg de poids du patient par jour. Par voie intraveineuse 400 ml de polyglucine (rhéopolyglucine), 50-100 mg de prednisolone, mélange glucosone-vocaïne (400 ml de solution de glucose à 5% avec 25 ml de solution de novocaïne à 2%), 80-120 mg de furosémide (lasix), 40 ml de 40% - solution de glucose avec 8 UI d'insuline. 2. Intoxication à l'alcool éthylique Клиника Lors de la prise de doses toxiques - agitation, ataxie, stupeur, coma avec inhibition des réflexes, odeur d'alcool de la bouche, rougeur du visage, conjonctivite, "jeu" des pupilles, vomissements, miction involontaire, tachycardie, respiration "rauque" , collapsus, vomissements avec aspiration possible de masse émétique. traitement Lavage gastrique à travers une sonde épaisse, suivi de l'introduction d'un laxatif salin, lavement au siphon. Par voie sous-cutanée 1 ml d'une solution à 0,1% d'atropine, 2 ml de cordiamine, 1 ml d'une solution à 20% de caféine, avec collapsus - par voie intramusculaire 1 ml d'une solution à 1% de mezaton. En l'absence de réflexes pharyngés - intubation trachéale et ventilation mécanique. Forcer la diurèse avec l'administration simultanée d'une solution de bicarbonate de sodium à 4% dans un volume calculé selon la formule d'Astrup, de solutions de glucose hypertoniques (10 et 20%) avec insuline, vitamines B et C, cocarboxylase, acide nicotinique. Avec dépression respiratoire - par voie intraveineuse lentement 3-5 ml d'une solution à 1,5% d'étimizol, 10 ml d'une solution à 2,4% d'aminophylline, 1 ml d'une solution à 5% d'éphédrine, inhalation d'oxygène. Avec aspiration - bronchoscopie d'assainissement d'urgence. Antibiotiques parentéraux. 3. Empoisonnement à l'éthylène glycol (antigel) La dose létale moyenne est d'environ 100 ml. Il est rapidement absorbé dans le tube digestif et distribué dans tous les tissus, créant une concentration maximale dans le cerveau. Le principal effet toxique est observé dans le parenchyme rénal, où se développent une nécrose de l'épithélium tubulaire, un œdème interstitiel et des foyers de nécrose hémorragique dans la couche corticale. L'œdème se trouve dans le cerveau. Клиника Dans la clinique de l'intoxication, on distingue 3 périodes : 1) initial - durant jusqu'à 12 heures, les symptômes de lésions du SNC par le type d'intoxication alcoolique prédominent; 2) neurotoxique - lorsque les symptômes de l'atteinte du SNC progressent et que les troubles des systèmes respiratoire et cardiovasculaire se rejoignent ; 3) néphrotoxique - du 2e au 5e jour, les lésions rénales prédominent dans le tableau clinique de l'intoxication. La durée et la gravité des périodes d'intoxication dépendent de la gravité de l'intoxication. Dans les cas bénins, après une période d'intoxication (10-15 heures), un léger malaise, des maux de tête et des nausées se développent. La conscience reste claire, aucune lésion rénale n'est observée. En cas d'empoisonnement modéré, sur fond de symptômes d'intoxication, de vomissements, de diarrhée, de douleurs dans la région épigastrique et de maux de tête. Le 3-5ème jour, des symptômes de lésions rénales apparaissent. En cas d'intoxication grave, une perte de conscience survient rapidement, une raideur de la nuque, des convulsions tonico-cloniques, de la fièvre, une respiration profonde bruyante, un collapsus et un œdème pulmonaire. Si le patient ne meurt pas le premier jour, alors à partir du 2-3ème jour des symptômes d'insuffisance rénale se développent : la soif apparaît, le mal de dos, la quantité d'urine diminue, jusqu'à l'anurie. Le foie est hypertrophié, douloureux. La mort vient de l'urémie. traitement Lavage gastrique avec de l'eau ou une solution de bicarbonate de sodium à 2 %, suivi de l'introduction de 30 g de sulfate de magnésium dans 200 ml d'eau. À l'intérieur de 200 ml d'une solution à 30% d'alcool éthylique. 3-5 g de bicarbonate de sodium dans 100 ml d'eau. Boisson abondante. Par voie intramusculaire 1-2 ml de cordiamine, 1 ml d'une solution de caféine à 20%. Par voie intraveineuse 400 ml de solution de glucose à 5% avec 5 ml de solution d'acide ascorbique à 5% et 8 unités d'insuline, mélange glucosone-vocaïne, 400 ml de polyglucine, 400 ml d'hémodez, 80-120 g de furosémide, 60-100 mg de prednisolone. 4. Empoisonnement au dichloroéthane Les principales voies d'entrée sont le tube digestif, les voies respiratoires et la peau. La dose létale de DCE pour l'homme lorsqu'il est administré par voie orale est de 10 à 20 ml. L'effet toxique du DCE est dû à l'effet narcotique sur le système nerveux central, aux dommages au foie, aux reins, au tractus gastro-intestinal et à un effet prononcé sur le système cardiovasculaire. Клиника Dans le tableau clinique, les principaux symptômes sont les suivants : encéphalopathie toxique, gastrite et gastro-entérite aiguë toxique, altération de la respiration externe, hépatite toxique, altération de la fonction rénale. Dans les premières heures après l'ingestion, apparaissent des vertiges, une ataxie, une agitation psychomotrice, des convulsions cloniques-toniques, une dépression de la conscience, jusqu'au coma. L'un des premiers signes d'empoisonnement est des troubles gastro-intestinaux sous forme de nausées, de vomissements répétés avec un mélange de bile. La violation de la fonction de la respiration externe se produit souvent selon le type d'aspiration obstructive et est associée à une augmentation de la salivation, de la bronchorrhée et de l'aspiration. On note l'inhibition de la fonction du centre respiratoire, le développement de l'hypertonicité des muscles respiratoires et la rigidité de la poitrine. Une complication grave est le choc exotoxique, qui se manifeste par un refroidissement et une cyanose de la peau, des sueurs froides, un essoufflement, une tachycardie et une hypovolémie. Diminution de la fonction excrétrice des reins. Selon la gravité de l'empoisonnement DCE sont divisés en ce qui suit. 1. Intoxication légère, caractérisée par le développement de troubles dyspeptiques, de symptômes neurologiques légers et d'une hépatopathie légère. 2. Empoisonnement modéré. Se produire avec des symptômes de gastrite toxique, gastro-entérite, encéphalopathie toxique, hépatopathie modérée, néphropathie légère. 3. Une intoxication grave se produit avec des manifestations graves d'encéphalopathie toxique, d'hépatopathie grave, de néphropathie toxique, de gastro-entérite. En cas d'empoisonnement par les vapeurs, il y a un mal de tête, une somnolence, un goût sucré dans la bouche, une odeur de poison de la bouche, une irritation des muqueuses, une perte de conscience, une insuffisance hépatique et rénale aiguë avec jaunissement de la sclérotique et de la peau , hypertrophie du foie, anurie. En cas d'ingestion - vomissements répétés, douleurs abdominales, selles molles avec une odeur de poison, hyperémie de la sclérotique, agitation psychomotrice, alternant dépression et coma, collapsus, choc toxique, syndrome hémorragique, insuffisance hépatique-rénale aiguë. Lorsque le poison entre en contact avec la peau, une dermatite se développe. traitement En cas d'empoisonnement aux vapeurs - éloignement de la victime de la zone touchée, avec dépression respiratoire IVL. Si le poison pénètre à l'intérieur - lavage gastrique à travers une sonde épaisse, suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre dans 200 ml d'eau et 150-200 ml d'huile de vaseline, lavement au siphon. Par voie intraveineuse 20-40 ml d'une solution à 30% de thiosulfate de sodium, par voie intramusculaire 5 ml d'une solution à 5% d'unitiol. par voie intraveineuse 400 ml de polyglucine, 400 ml d'hémodez, 400 ml de solution de glucose à 5%, 80-120 mg de furosémide (lasix), 6-8 ml de solution à 5% d'acide ascorbique. Par voie intramusculaire 2 ml de cordiamine, avec collapsus - 1 ml d'une solution à 1% de mezaton, 1 ml d'une solution à 20% de caféine, 100-150 mg de prednisolone. Avec une augmentation de l'insuffisance hépatique-rénale, un traitement spécifique est effectué. Bolus intraveineux 400 ml de polyglucine, 400 ml de gemodez, 400 ml de glucose à 5%, 80-120 mg de furosémide, 6-8 ml d'acide ascorbique à 5%, 100-150 mg de prednisolone, avec effondrement 1 ml de 1% mézaton. Par voie intramusculaire 2 à 4 ml de bromure de thiamine à 6 % et 2 à 4 ml de pyridoxine à 5 %. Avec agitation psychomotrice, 1 ml d'une solution à 3% de fénozépam. Inhalation d'oxygène, avec dépression respiratoire - IVL à travers un tube respiratoire. Lors du premier jour, la méthode la plus efficace et la plus économe est la dialyse péritonéale. La composition de la solution de dialyse standard comprend : chlorure de potassium 0,3 g, chlorure de sodium 8,3 g, chlorure de magnésium 0,1 g, chlorure de calcium 0,3 g, glucose 6 g pour 1 litre d'eau. Dans le même temps, jusqu'à 2 litres de solution d'électrolyte additionnés de 500 1000 unités de pénicilline et XNUMX XNUMX unités d'héparine sont injectés dans la cavité abdominale du patient. Dans la phase somatogène de l'intoxication, la thérapeutique principale vise à traiter les complications développées : pneumonie, hépatopathie, etc. 5. Empoisonnement aux champignons vénéneux (agaric tue-mouche, faux champignons, morilles, grèbe pâle) Клиника Après une période de latence d'une durée de 1-2 à 36 heures, des crampes abdominales, une salivation, des nausées, des vomissements indomptables, une diarrhée, une déshydratation, un collapsus, un délire, des hallucinations, des convulsions apparaissent. Le 2ème-3ème jour - les phénomènes d'insuffisance rénale et hépatique avec anurie, azotémie, jaunisse. En cas d'intoxication grave aux lignes et aux morilles, une hémolyse est possible. traitement Lavage gastrique à travers un tube épais, suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre dans 200 ml d'eau et 30 g de sulfate de magnésium (sodium) dans 100 ml d'eau, lavement au siphon. En sous-cutané 1 ml d'une solution à 0,1% d'atropine, 2 ml de cordiamine. Dans l'empoisonnement aux morilles, l'atropine n'est pas utilisée comme antidote. Par voie intraveineuse 400 ml de polyglucine, 400 ml d'hémodez, 400 ml de solution de glucose à 5% avec 4-6 ml de solution d'acide ascorbique à 5%, 80-120 mg de furosémide (lasix). Par voie intramusculaire 1-2 ml d'une solution à 6% de bromure de thiamine et 2 ml d'une solution à 5% de chlorhydrate de pyridoxine (ne pas injecter dans une seule seringue). Soulagement du syndrome douloureux par voie intramusculaire avec l'introduction de 1 ml d'une solution à 0,2% de platifilline, 2 ml d'une solution à 2% de papavérine. Avec convulsions, agitation psychomotrice - par voie intramusculaire 1-2 ml d'une solution à 3% de fénozépam ou d'un mélange lytique (1-2 ml d'une solution à 2,5% de chlorpromazine, 1-2 ml d'une solution à 1% de diphenhydramine, 5-10 ml de solution à 25 % de sulfate de magnésium) sous contrôle de la pression artérielle. Forcer la diurèse. Dans les cas graves - hémosorption, hémodialyse précoce. En cas d'intoxication grave aux ficelles et aux morilles, en cas d'hémolyse sévère et d'absence de possibilité d'hémodialyse, une opération de remplacement du sang est réalisée. Correction de l'acidose par administration intraveineuse d'une solution à 4 % de bicarbonate de sodium dans un volume déterminé selon la formule d'Astrup. Antibiotiques - benzylpénicilline jusqu'à 10 millions d'unités par jour. Thérapie symptomatique. En cas d'insuffisance hépatique et rénale croissante - thérapie par perfusion avec une solution de glucose à 5-10% avec de l'insuline, des vitamines des groupes B et C, 20-30 XNUMX UI d'héparine, aminophylline. 6. Empoisonnement au venin de serpent Клиника Douleur et gonflement se propageant rapidement au site de la morsure, somnolence, dépression respiratoire, collapsus, hémolyse intravasculaire avec hémoglobinurie, hémorragies sous-cutanées sévères, parfois convulsions. Peut-être une insuffisance rénale. Avec une morsure de cobra, les changements locaux sont moins prononcés, les troubles bulbaires (troubles de la parole et de la déglutition, ptosis, paralysie des muscles moteurs) et la dépression respiratoire prédominent. Affiche un repos complet en position horizontale. Faire sortir les premières gouttes de sang de la plaie. Immobilisation du membre blessé. Au lieu de la morsure - froid. Boisson abondante. traitement Aspiration du sang et de la lymphe de la plaie (au plus tard 30 à 60 minutes après la morsure), formée au site de la morsure, à l'aide d'un bocal suceur de sang. Laver la plaie avec une solution de permanganate de potassium à 1%. Introduction à la plaie 0,3-0,5 ml d'une solution d'adrénaline à 0,1%. Si possible, introduction en urgence d'un sérum spécifique anti-serpent mono- ou polyvalent après une injection intraveineuse préalable de 100-150 ml d'hydrocortisone ou 50-100 ml de prednisolone. En cas de morsures de cobra - sérum Anticobra par voie intraveineuse à la dose de 300 ml en association avec 1 ml d'une solution à 0,05% de prozérine et administration répétée toutes les 30 minutes avec 1 ml d'une solution à 0,1% d'atropine. Prophylactiquement - sérum antitétanique selon Bezredka, mélange polarisant par voie intraveineuse, 10-15 mille UI d'héparine, 1-2 ml de solution de diphenhydramine à 1%, 10 ml de solution de chlorure de calcium (gluconate) à 10%, 5-10 ml de 5 % - solution d'acide ascorbique, 50-100 mg de prednisolone ou 100-150 mg d'hydrocortisone, 400 ml de gemodez, 400 ml de polyglucine, 40-80 mg de lasix. Soulagement de la douleur par administration intraveineuse de 1 ml d'une solution à 2% de promedol. En cas d'insuffisance respiratoire aiguë - ventilation mécanique par un tube respiratoire, inhalation d'oxygène. En cas de toxicose sévère - hémosorption, avec progression de l'insuffisance hépatique-rénale - hémodialyse en association avec l'hémosorption. Thérapie symptomatique. 7. Empoisonnement avec des acides concentrés (nitrique, acétique, sulfurique) Клиника L'inhalation de vapeurs provoque une irritation des yeux et des voies respiratoires supérieures (larmoiement, nez qui coule, toux, essoufflement). Un arrêt respiratoire réflexe est possible. Après une période de latence (de 2 à 24 heures), une pneumonie toxique ou un œdème pulmonaire toxique se forme. Au coup dans les yeux, sur la peau - les brûlures chimiques. En cas d'ingestion - brûlure chimique de la cavité buccale, du pharynx, de l'œsophage, de l'estomac, gonflement possible du larynx avec insuffisance respiratoire. Vomissements répétés avec du sang, irritation péritonéale et parfois perforation de l'œsophage ou de l'estomac. Effondrement, choc, syndrome hémorragique. Hémolyse intravasculaire possible, néphrose hémoglobinurique avec insuffisance rénale aiguë (réno-hépatique). Le lavage gastrique sans tube et les vomissements artificiels sont dangereux en raison de la possibilité de rebrûler l'œsophage et d'aspiration acide. Ne pas injecter de solutions salines laxatives et alcalines. traitement Lavage gastrique à travers un tube épais avec de l'eau froide après une injection intraveineuse ou intramusculaire préalable de 1-2 ml d'une solution à 2% de promedol. A l'intérieur des morceaux de glace, Almagel A 15-20 ml toutes les heures. Par voie intraveineuse 800 ml de polyglucine, 400 ml d'hémodez, mélange glucosone-vocaïne (400 ml de solution de glucose à 5% avec 25 ml de solution de novocaïne à 2%), 50-150 mg de prednisolone ou 150-250 mg d'hydrocortisone, 10 80 unités d'héparine, 120-XNUMX mg de furosémide (Lasix). Le soulagement du syndrome douloureux est obtenu par voie intraveineuse avec l'introduction de 1 à 2 ml d'une solution à 0,005% de fentanyl et de 2 à 4 ml d'une solution à 0,25% de dropéridol, avec une douleur persistante dans l'abdomen - par voie intramusculaire 1 à 2 ml d'un Solution à 0,2% de platyfiline, 2 ml de solution de papavérine à 2%. Inhalation d'oxygène avec un antimousse. Avec augmentation de l'œdème laryngé - par voie intraveineuse 200-400 mg de prednisolone, 1-2 ml d'une solution à 1% de diphenhydramine, 10-20 ml d'une solution à 2,4% d'aminophylline, 1-2 ml d'une solution à 5% d'éphédrine. En l'absence d'effet - trachéotomie, inhalation d'oxygène, selon les indications - ventilation mécanique. 8. Empoisonnement à l'arsenic et ses composés Клиника Il y a un goût métallique dans la bouche, des douleurs abdominales, des vomissements, des selles molles, une déshydratation sévère, des convulsions, une tachycardie, une baisse de la pression artérielle, un coma, une insuffisance rénale aiguë. L'intoxication à l'hydrogène par l'arsenic développe une hémolyse intravasculaire, une hémoglobinurie. traitement Lavage gastrique à travers un tube épais (2-3 fois par jour) avec introduction au début et à la fin du lavage de 50 ml d'une solution à 5% d'unithiol, lavements répétés au siphon avec addition d'unithiol. Poursuite du traitement antidote par voie intraveineuse ou intramusculaire avec l'introduction d'une solution à 5% d'unitiol (jusqu'à 300 ml par jour), goutte à goutte intraveineuse de 20 ml de tétacine de calcium à 10% (ED1A) dans 400 ml d'une solution de glucose à 5%. En cas d'empoisonnement à l'hydrogène arsenical - par voie intramusculaire, 1-2 ml d'une solution à 40% de mécaptide (jusqu'à 6-8 ml par jour). Forcer la diurèse avec l'administration simultanée de solutions polyioniques hypertoniques (solution de glucose à 10-20%), solution de bicarbonate de sodium à 4% dans un volume calculé selon la formule d'Astrup, mélange glucosone-vocaïne, aminophylline, vitamines B et C, cytochrome C. En cas d'intoxication grave - hémodialyse précoce. Lors du processus d'hémodialyse, une solution d'unithiol à 5% est injectée par voie intraveineuse (30-40 ml / h pour une intoxication grave, 20-30 ml / h pour une intoxication modérée). En cas d'hémolyse aiguë et d'impossibilité d'hémodialyse, une opération de remplacement du sang est effectuée. 9. Empoisonnement à la lessive Клиника En cas d'ingestion, une brûlure chimique de la membrane muqueuse de la cavité buccale, de l'œsophage et de l'estomac se développe. Douleur le long de l'œsophage et dans l'abdomen, vomissements avec du sang, saignement œsophagien-gastrique. Perforation possible de l'œsophage, de l'estomac avec développement d'une médiastinite, d'une péritonite. Avec une brûlure du larynx - enrouement de la voix, aphonie, difficulté à respirer (stridor). Dans les cas graves - choc de brûlure, oligurie. Le contact avec la peau provoque des brûlures chimiques. traitement Traiter comme dans un empoisonnement acide. 10. Empoisonnement à l'atropine Клиника Bouche sèche, enrouement, peau sèche et hyperémique, pupilles dilatées, essoufflement, palpitations, tachycardie, soif, nausées, difficulté à uriner. En cas d'intoxication grave - agitation psychomotrice, délire, hallucinations, convulsions, troubles du rythme cardiaque, coma, collapsus sont possibles. traitement Si nécessaire - lavage gastrique à travers une sonde épaisse, richement lubrifiée avec de l'huile de vaseline, l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre dans 200 ml d'eau et 30 mg de sulfate de magnésium dans 100 ml d'eau. par voie intraveineuse 2-4 ml de solution de prosérine à 0,05%, 400-800 ml de solution de glucose à 5%, 40-80 mg de furosémide (lasix). Boisson abondante. Soulagement de l'agitation psychomotrice et des convulsions par voie intramusculaire avec l'introduction de 1-2 ml d'une solution à 3% de fénozépam ou d'un mélange lytique (2 ml d'une solution à 2,5% d'aminazine, 2 ml d'une solution à 1% de diphenhydramine et 10 ml de une solution à 25% de sulfate de magnésium) ou 1-2 g d'hydrate de chloral en lavement avec 1-2 g d'amidon pour 25-50 ml d'eau, par voie intraveineuse 10-15 ml d'une solution d'hydroxybutyrate de sodium à 20%, 2-4 ml d'une solution à 0,5% de seduxen. Avec tachycardie sévère, extrasystole - anapriline par voie intraveineuse (1-2 ml d'une solution à 0,25%) ou un comprimé d'anapriline (40 mg) sous la langue. Avec collapsus - par voie intraveineuse 1 ml d'une solution à 1% de mezaton dans 10 ml d'une solution à 0,9% de chlorure de sodium. Avec une hyperthermie aiguë - par voie intramusculaire 2 ml d'une solution à 50% d'analgine, des packs de glace sur les gros vaisseaux et la tête, des enveloppements humides. 11. Intoxication au chanvre (haschisch, marijuana, marijuana, plan) Клиника Il y a euphorie, agitation psychomotrice, hallucinations visuelles vives, pupilles dilatées, acouphènes. Par la suite, faiblesse, léthargie, dépression de l'humeur, somnolence, bradycardie, hypothermie. traitement En cas d'intoxication orale - lavage gastrique à travers un tube épais, suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre dans 200 ml d'eau. Par voie intraveineuse 400-800 ml d'une solution de glucose à 5% avec 5-10 ml d'une solution à 5% d'acide ascorbique et 8-16 unités d'insuline, 40-80 mg de furosémide (lasix), par voie intramusculaire 2 ml d'une solution à 6% de bromure de thiamine. Avec une forte excitation - par voie intramusculaire 3-5 ml d'une solution à 2,5% de chlorpromazine ou d'un mélange lytique (2 ml d'une solution à 2,5% de chlorpromazine, 1-2 ml d'une solution à 1% de diphenhydramine et 5-10 ml de 25 % - une solution de sulfate de magnésium) sous le contrôle de la pression artérielle. inhalation d'oxygène. Forcer la diurèse. Dans les cas graves, recourir à l'hémosorption. 12. Intoxication à la cocaïne et à la dicaïne Клиника Elle se manifeste cliniquement par une agitation générale, des maux de tête, une rougeur du visage, des pupilles dilatées, une tachycardie, une respiration accrue, une augmentation de la pression artérielle, des hallucinations. Dans les cas graves - convulsions, coma, paralysie respiratoire, collapsus. traitement Lavage gastrique répété à travers une sonde épaisse avec une solution à 0,1% de permanganate de potassium, suivi de l'introduction de 3-4 cuillères à soupe. l. charbon actif en poudre dans 200 ml d'eau et 30 g de sulfate de magnésium dans 100 ml d'eau. Par voie intraveineuse 400 ml de gemodez, 400 ml de solution de glucose à 5% avec 5-10 ml de solution d'acide ascorbique à 5%, 40-80 mg de furosémide (lasix). Lorsqu'il est excité - fixation de la victime, par voie intramusculaire 1-2 ml d'une solution à 3% de fénozépam ou d'un mélange lytique (1-2 ml d'une solution à 2,5% de chlorpromazine, 2 ml d'une solution à 1% de diphenhydramine et 5-10 ml d'un 25% - une solution de sulfate de magnésium) sous le contrôle de la pression artérielle. Avec des convulsions, 1-2 g d'hydrate de chloral sont administrés dans un lavement avec 1-2 g d'amidon dans 25-50 ml d'eau, par voie intraveineuse lentement 15-20 ml d'une solution d'oxybutyrate de sodium à 20%, s'il n'y a pas d'effet, lentement par voie intramusculaire jusqu'à 20 ml d'une solution à 2,5% de thiopental sodique ou d'hexenal. Avec le développement d'un coma - un sac de glace sur la tête, par voie intraveineuse 40 ml d'une solution de glucose à 40% avec 4-6 ml d'une solution à 5% d'acide ascorbique et 8 unités d'insuline, par voie intraveineuse lente ou intramusculaire 2-4 ml d'une solution à 6% de bromure de thiamine et 2-4 ml d'une solution à 5% de chlorhydrate de pyridoxine, 80-120 mg de furosémide. En cas de dépression respiratoire sévère, une ventilation mécanique est effectuée, par voie intraveineuse lentement 2 ml de cordiamine, inhalation d'oxygène. 13. Empoisonnement aux analgésiques narcotiques (morphine, omnopon, dropéridol) Клиника Somnolence ou inconscience, constriction pupillaire, hypertonicité musculaire (parfois convulsions), dépression respiratoire, bradycardie, collapsus. Une paralysie respiratoire est possible avec la conscience du patient préservée. traitement Lavage gastrique à travers une sonde épaisse (tout en maintenant la conscience), suivi de l'introduction de 3-4 cuillères à soupe de charbon actif en poudre et de 30 g de sulfate de sodium, lavement au siphon. Par voie intraveineuse 400 ml de gemodez, 400 ml de polyglucine, 400 ml de solution de glucose à 5%, 60-80 mg de furosémide (lasix). Par voie sous-cutanée 1-2 ml d'une solution à 0,1% d'atropine, 1-2 ml de cordiamine, 1 ml d'une solution à 20% de caféine. Avec le développement d'un coma, un sac de glace sur la tête, par voie intraveineuse 40 ml d'une solution de glucose à 40% avec 5-10 ml d'une solution à 5% d'acide ascorbique et 8 unités d'insuline, par voie intraveineuse lente ou intramusculaire 2-4 ml d'une solution à 6% de bromure de thiamine et 2-4 ml d'une solution à 5% de chlorhydrate de pyridoxine, 80-120 mg de furosémide (lasix). Si nécessaire - cathétérisme de la vessie et extraction d'urine. Avec dépression respiratoire - IVL, inhalation d'oxygène. Hémosorption (2-3 fois par jour jusqu'à ce que la conscience soit restaurée). Conférence n ° 11. Douleur et analgésiques 1. Douleur La douleur est un état sensoriel et émotionnel désagréable dû à des effets pathologiques réels ou potentiels sur les tissus. Dans le SNC, la douleur est conduite selon deux voies principales. Chemin spécifique - les cornes postérieures de la moelle épinière, les noyaux spécifiques du thalamus, le cortex du gyrus central postérieur. Cette voie est bas-neuronale, rapide, conductrice de seuil, émotionnellement incolore, précisément localisée (douleur épicritique). Voie non spécifique - les cornes postérieures de la moelle épinière, les noyaux non spécifiques du thalamus, le cortex des lobes frontal et pariétal de manière diffuse. Conduit des douleurs sous-liminaires, émotionnellement colorées, mal localisées. Il est lent, multineuronal, car il forme de nombreuses collatérales au bulbe rachidien, à la formation réticulaire, au système limbique et à l'hippocampe. Les impulsions douloureuses inférieures au seuil subissent une sommation dans le thalamus. Les impulsions conduites le long de la voie de la douleur non spécifique excitent les centres émotionnels du système limbique, les centres autonomes de l'hypothalamus et le bulbe rachidien. Par conséquent, la douleur s'accompagne de peur, d'expériences douloureuses, d'une respiration accrue, d'un pouls, d'une augmentation de la pression artérielle, d'une dilatation des pupilles, de troubles dyspeptiques. L'action du système nociceptif de la douleur est contrecarrée par le système antinoceceptif dont les principaux neurones sont localisés dans la substance grise périaqueducale (l'aqueduc de Sylvius relie les ventricules III et IV). Leurs axones forment des voies descendantes vers le bulbe rachidien et la moelle épinière et des voies ascendantes vers la formation réticulaire, le thalamus, l'hypothalamus, le système limbique, les ganglions de la base et le cortex. Les médiateurs de ces neurones sont des pentapeptides : la méthenképhaline et la leuenképhaline, qui ont respectivement la méthionine et la leucine comme acides aminés terminaux. Les enképhalines excitent les récepteurs opiacés. Dans les synapses enképhalinergiques, les récepteurs opiacés sont situés sur la membrane postsynaptique, mais la même membrane est présynaptique pour les autres synapses. Les récepteurs opiacés sont associés à l'adénylate cyclase et provoquent son inhibition en perturbant la synthèse de l'AMPc dans les neurones. En conséquence, l'entrée de calcium et la libération de médiateurs, y compris les médiateurs de la douleur - les peptides diminuent : substance P, cholécystokinine, somatostatine, acide glutamique. Les récepteurs opiacés sont excités non seulement par des médiateurs - les enképhalines, mais également par d'autres composants du système antinoceceptif - les hormones cérébrales (endorphines). Des agonistes peptidiques des récepteurs opiacés se forment lors de la protéolyse des substances peptidiques du cerveau : proopiocortine, proenképhalines A et B. Tous ces peptides se forment dans l'hypothalamus. Les récepteurs opiacés excitent les récepteurs de toutes les structures cérébrales impliquées dans la conduction et la perception de la douleur, la formation de réactions émotionnellement colorées à la douleur. Dans le même temps, la libération de médiateurs de la douleur diminue et toutes les réactions accompagnant la douleur sont affaiblies. 2. Médicaments analgésiques Un antalgique (acide acétylsalicylique, paracétamol, morphine) est un médicament qui diminue les douleurs d'origines diverses. Les médicaments qui réduisent la douleur provoquée uniquement par un certain facteur causal ou éliminent un syndrome douloureux spécifique, par exemple les antiacides, l'ergotamine (migraine), la carbamazépine (névralgie), la nitroglycérine (angine de poitrine), n'appartiennent pas aux analgésiques classiques. Les corticostéroïdes suppriment la réponse inflammatoire et la douleur qui en résulte, mais malgré leur utilisation répandue à ces fins, ils ne représentent pas non plus des analgésiques classiques. Les analgésiques sont classés en narcotiques, agissant sur les structures du SNC et provoquant une somnolence, comme les opioïdes, et non narcotiques, agissant principalement sur les structures périphériques, comme le paracétamol, l'acide acétylsalicylique. Médicaments supplémentaires qui renforcent l'effet des analgésiques Les médicaments de ce groupe ne sont pas des analgésiques eux-mêmes, mais sont utilisés en association avec des analgésiques contre la douleur, car ils peuvent modifier l'attitude envers la douleur, sa perception et le niveau d'anxiété, de peur, de dépression (les antidépresseurs tricycliques peuvent même entraîner une diminution du besoin de morphine chez un patient en phase terminale). Ces médicaments peuvent être des médicaments psychotropes, ainsi que ceux qui affectent les mécanismes de la douleur, par exemple en éliminant les spasmes des muscles lisses et striés. Les analgésiques narcotiques sont des médicaments à base de plantes et synthétiques qui réduisent sélectivement la perception de la douleur, augmentent la tolérance à la douleur en réduisant la coloration émotionnelle de la douleur et son accompagnement végétatif, provoquent l'euphorie et la toxicomanie. Les analgésiques narcotiques réduisent la conduction et la perception de la douleur uniquement dans les limites du système nerveux central, supprimant principalement la voie non spécifique. Les moyens de ce groupe excitent les récepteurs opiacés, créent une action similaire aux effets des peptides du système anti-noreceptif. Par conséquent, les principaux mécanismes de l'anesthésie sont les suivants: un trouble de la conduction d'une impulsion douloureuse de l'axone du neurone I, dont le corps est situé dans le ganglion spinal, au neurone II, situé dans la substance gélatineuse de la partie postérieure cornes de la moelle épinière. Suppression de la sommation des impulsions inférieures au seuil dans le thalamus. Diminution de la participation à la réaction douloureuse du bulbe rachidien, de l'hypothalamus, du système limbique (attitude non accentuée face à la douleur). Classification des analgésiques narcotiques et de leurs antagonistes Le classement est le suivant. 1. Dérivés de pipéridine-phénanthrène : 1) morphine ; 2) codéine (méthylmorphine, 5 à 7 fois plus faible que la morphine comme analgésique) ; 3) éthylmorphine (dionine, égale en force à la morphine). 2. Dérivés de phénylpipéridine : 1) promedol (3-4 fois plus faible que la morphine) ; 2) fentanyl (100 à 400 fois plus fort que la morphine). 3. Dérivés du diphénylméthane : 1) pyritramide (dipidolor) - égal à la morphine; 2) tramadol (tramal) - quelque peu inférieur à la morphine. 4. Agonistes-antagonistes : 1) agonistes des récepteurs opiacés et antagonistes des récepteurs opiacés - buprénorphine (norphine) (25 à 30 fois plus puissante que la morphine); 2) agonistes des récepteurs opiacés et antagonistes des récepteurs opiacés - pentazocine (lexir) (2 à 3 fois plus faible que la morphine) et butorphanol (moradol) (égal à la morphine). Les agonistes-antagonistes sont beaucoup moins susceptibles et plus faibles que les agonistes complets de provoquer l'euphorie et la toxicomanie. Narorphine - seule (par exemple, avec un empoisonnement aux barbituriques) et avec un léger empoisonnement à la morphine, elle a un effet analgésique, provoque un myosis, une bradycardie et exacerbe la dépression du centre respiratoire. En cas d'intoxication grave à la morphine et à d'autres agonistes, il les déplace des récepteurs opiacés du centre respiratoire et rétablit la respiration. Provoque dysphorie, irritabilité, dépression, troubles de la focalisation du regard. Antagonistes complets des récepteurs opiacés La naloxone n'a pas d'action indépendante, elle est efficace comme antidote en cas d'empoisonnement avec des analgésiques narcotiques. Les analgésiques narcotiques ne doivent être utilisés que pour les douleurs aiguës pendant une courte période. Le plus souvent utilisé pour les blessures, les brûlures, l'infarctus du myocarde, la péritonite (après avoir clarifié le diagnostic et décidé de l'opération). Les analgésiques narcotiques font partie des mélanges lytiques pour la potentialisation de l'anesthésie. Les médicaments de ce groupe sont utilisés pour la douleur postopératoire en association avec des anticholinergiques M et des antispasmodiques myotropes. Ils sont prescrits pour arrêter les coliques hépatiques (pentazocine) et rénales (promedol). La douleur chronique est une contre-indication à la prescription de médicaments, à l'exception des formes avancées d'une tumeur maligne (dipidolor, tramadol, agonistes-antagonistes). Les analgésiques narcotiques sont combinés avec des médicaments psychotropes pour des types particuliers d'anesthésie. La neuroleptanalgésie est un soulagement de la douleur avec une combinaison de fentanyl (fort, dure 30 à 40 minutes) et de dropéridol (un antipsychotique léger). Le dropéridol a un léger effet sédatif, arrête les réactions émotionnelles et réduit le tonus des muscles squelettiques. Les autres effets importants du dropéridol sont antiémétiques et antichocs. Doses de dropéridol - 1: 50. Médicament combiné - thalamonal. La neuroleptanalgésie est utilisée dans les opérations peu traumatisantes, dans le domaine de la neurochirurgie et en cardiologie pour l'infarctus du myocarde, etc. Atalgésie ou analgésie tranquillisante - fentanyl en association avec un tranquillisant puissant tel que le sibazon, le phénazépam. Le principal inconvénient est la forte dépression respiratoire du fentanyl et la préservation de la conscience. Conférence n ° 12. Anesthésie. Types et étapes d'anesthésie L'anesthésie générale, ou anesthésie, est un état du corps qui se caractérise par un arrêt temporaire de la conscience d'une personne, de sa sensibilité à la douleur et de ses réflexes, ainsi que par un relâchement des muscles des muscles squelettiques, provoqué par l'action d'analgésiques narcotiques sur le système nerveux central. Selon les voies d'administration des substances narcotiques dans le corps, on distingue l'anesthésie par inhalation et sans inhalation. 1. Théories de l'anesthésie Actuellement, il n'existe aucune théorie de l'anesthésie qui définirait clairement le mécanisme d'action narcotique des anesthésiques. Parmi les théories disponibles sur l'anesthésie, les plus importantes sont les suivantes. Les médicaments peuvent provoquer des changements spécifiques dans tous les organes et systèmes. Pendant la période où le corps est saturé d'un analgésique narcotique, il y a une certaine mise en scène dans le changement de conscience, de respiration et de circulation sanguine du patient. Par conséquent, il existe des étapes qui caractérisent la profondeur de l'anesthésie. Ces étapes se manifestent particulièrement clairement pendant l'anesthésie à l'éther. Il y a 4 étapes : 1) analgésie ; 2) excitation ; 3) stade chirurgical, subdivisé en 4 niveaux ; 4) stade d'éveil. Stade de l'analgésie Le patient est conscient, mais une certaine léthargie est notée, il somnole, répond aux questions par monosyllabes. Les sensibilités superficielles et douloureuses sont absentes, mais quant aux sensibilités tactile et thermique, elles sont préservées. À ce stade, des interventions chirurgicales à court terme sont effectuées, telles que l'ouverture du phlegmon, des abcès, des études diagnostiques, etc. Le stade est à court terme et dure 3 à 4 minutes. Stade d'excitation A ce stade, les centres du cortex cérébral sont inhibés et les centres sous-corticaux sont à ce moment dans un état d'excitation. Dans le même temps, la conscience du patient est complètement absente, une excitation motrice et vocale prononcée est notée. Les patients commencent à crier, tentent de se lever de la table d'opération. On note une hyperémie de la peau, le pouls devient fréquent, la pression artérielle systolique augmente. La pupille de l'œil s'élargit, mais la réaction à la lumière persiste, on note un larmoiement. Il y a souvent une toux, une sécrétion bronchique accrue, parfois des vomissements. Une intervention chirurgicale dans le contexte de l'excitation ne peut pas être effectuée. Pendant cette période, vous devez continuer à saturer le corps avec un narcotique pour améliorer l'anesthésie. La durée de l'étape dépend de l'état général du patient et de l'expérience de l'anesthésiste. Typiquement, la durée d'excitation est de 7 à 15 minutes. Stade chirurgical Avec le début de cette étape de l'anesthésie, le patient se calme, la respiration devient calme et régulière, la fréquence cardiaque et la tension artérielle approchent de la normale. Pendant cette période, des interventions chirurgicales sont possibles. Selon la profondeur de l'anesthésie, on distingue 4 niveaux et le stade III d'anesthésie. Premier niveau : le patient est calme, le nombre de mouvements respiratoires, le nombre de contractions cardiaques et la tension artérielle se rapprochent des valeurs initiales. La pupille commence progressivement à se rétrécir, sa réaction à la lumière est préservée. Il y a un mouvement fluide des globes oculaires, une disposition excentrique. Les réflexes cornéens et pharyngo-laryngés étaient conservés. Le tonus musculaire est préservé, par conséquent, les opérations abdominales à ce niveau ne sont pas effectuées. Deuxième niveau : le mouvement des globes oculaires est arrêté, ils sont fixés en position centrale. Les pupilles se dilatent et leur réaction à la lumière s'affaiblit. L'activité des réflexes cornéens et pharyngo-laryngés commence à s'affaiblir avec une disparition progressive vers la fin du deuxième niveau. Les mouvements respiratoires sont calmes et réguliers. Les valeurs de la pression artérielle et du pouls acquièrent des valeurs normales. Le tonus musculaire est réduit, ce qui permet des opérations abdominales. L'anesthésie, en règle générale, est réalisée pendant la période des premier et deuxième niveaux. Le troisième niveau est caractérisé comme une anesthésie profonde. Dans le même temps, les pupilles des yeux se dilatent en réaction à un fort stimulus lumineux. Quant au réflexe cornéen, il est absent. Une relaxation complète des muscles squelettiques se développe, y compris les muscles intercostaux. En raison de ce dernier, les mouvements respiratoires deviennent superficiels ou diaphragmatiques. La mâchoire inférieure s'affaisse, à mesure que ses muscles se détendent, la racine de la langue s'enfonce et ferme l'entrée du larynx. Tout ce qui précède conduit à un arrêt respiratoire. Afin de prévenir cette complication, la mâchoire inférieure est avancée et maintenue dans cette position. À ce niveau, la tachycardie se développe et le pouls devient petit remplissage et tension. Le niveau de pression artérielle diminue. La réalisation d'une anesthésie à ce niveau est dangereuse pour la vie du patient. quatrième niveau ; l'expansion maximale de la pupille avec l'absence de sa réaction à la lumière, la cornée est terne et sèche. Étant donné que la paralysie des muscles intercostaux se développe, la respiration devient superficielle et s'effectue par des mouvements du diaphragme. La tachycardie est caractéristique, tandis que le pouls devient filiforme, fréquent et difficile à déterminer en périphérie, la pression artérielle est fortement réduite ou pas détectée du tout. L'anesthésie au quatrième niveau met la vie du patient en danger, car un arrêt respiratoire et circulatoire peut survenir. Phase d'éveil Dès que l'introduction de stupéfiants s'arrête, que leur concentration dans le sang diminue et que le patient traverse toutes les étapes de l'anesthésie dans l'ordre inverse, le réveil se produit. 2. Préparation du patient pour l'anesthésie L'anesthésiste joue un rôle direct et souvent principal dans la préparation du patient à l'anesthésie et à la chirurgie. Un moment obligatoire est l'examen du patient avant l'opération, mais en même temps, non seulement la maladie sous-jacente, pour laquelle la chirurgie doit être effectuée, mais aussi la présence de maladies concomitantes, que l'anesthésiste demande en détail, est important . Il est nécessaire de savoir comment le patient a été traité pour ces maladies, l'effet du traitement, la durée du traitement, la présence de réactions allergiques, l'heure de la dernière exacerbation. Si le patient subit une intervention chirurgicale de manière planifiée, alors, si nécessaire, une correction des maladies concomitantes existantes est effectuée. L'assainissement de la cavité buccale est important en présence de dents mobiles et cariées, car elles peuvent être une source d'infection supplémentaire et indésirable. L'anesthésiste découvre et évalue l'état psychoneurologique du patient. Ainsi, par exemple, dans la schizophrénie, l'utilisation de drogues hallucinogènes (kétamine) est contre-indiquée. La chirurgie pendant la période de psychose est contre-indiquée. En présence d'un déficit neurologique, il est préalablement corrigé. Les antécédents allergiques sont d'une grande importance pour l'anesthésiste, pour cela, l'intolérance aux médicaments, ainsi qu'aux aliments, aux produits chimiques ménagers, etc. est spécifiée.Si le patient a une anamnèse allergique aggravée, même pas aux médicaments, pendant l'anesthésie, une réaction allergique peut évoluer jusqu'au choc anaphylactique. Par conséquent, des agents désensibilisants (diphénhydramine, suprastine) sont introduits en grande quantité dans la prémédication. Un point important est la présence d'un patient dans les opérations et l'anesthésie passées. Il s'avère quelle était l'anesthésie et s'il y a eu des complications. L'attention est attirée sur l'état somatique du patient: la forme du visage, la forme et le type de la poitrine, la structure et la longueur du cou, la sévérité de la graisse sous-cutanée, la présence d'œdèmes. Tout cela est nécessaire pour choisir la bonne méthode d'anesthésie et de médicaments. La première règle de préparation d'un patient à l'anesthésie lors de toute opération et lors de l'utilisation de toute anesthésie est le nettoyage du tractus gastro-intestinal (l'estomac est lavé à travers la sonde, des lavements nettoyants sont effectués). Pour supprimer la réaction psycho-émotionnelle et supprimer l'activité du nerf vague, avant la chirurgie, le patient reçoit un médicament - une prémédication. La nuit, le phénazépam est prescrit par voie intramusculaire. Les patients ayant un système nerveux labile se voient prescrire des tranquillisants (seduxen, relanium) un jour avant la chirurgie. 40 minutes avant l'intervention, des analgésiques narcotiques sont injectés par voie intramusculaire ou sous-cutanée : 1 ml d'une solution de promolol à 1-2 % ou 1 ml de pentozocine (lexir), 2 ml de fentanyl ou 1 ml de morphine à 1 %. Pour supprimer la fonction du nerf vague et réduire la salivation, 0,5 ml d'une solution à 0,1% d'atropine est administré. Immédiatement avant l'opération, la cavité buccale est examinée pour détecter la présence de dents amovibles et de prothèses retirées. 3. Anesthésie intraveineuse Les avantages de l'anesthésie générale intraveineuse sont l'introduction rapide du patient en anesthésie. Avec ce type d'anesthésie, il n'y a pas d'excitation et le patient s'endort rapidement. Mais les stupéfiants utilisés pour l'administration intraveineuse créent une anesthésie à court terme, ils ne peuvent donc pas être utilisés sous leur forme pure comme mononarcose pour des opérations à long terme. Les barbituriques - thiopental sodique et hexénal - sont capables d'induire rapidement un sommeil narcotique, alors qu'il n'y a pas de stade d'excitation et que le réveil est rapide. Les tableaux cliniques de l'anesthésie réalisée par le thiopental sodique et l'hexénal sont similaires. Geksenal a un effet moins inhibiteur sur le centre respiratoire. Des solutions fraîchement préparées de dérivés d'acide barbiturique sont utilisées. Le contenu du flacon (1 g de médicament) est dissous avant l'anesthésie dans 100 ml de solution isotonique de chlorure de sodium (solution à 1%). La veine périphérique ou centrale (selon les indications) est ponctionnée et la solution préparée est injectée lentement à raison de 1 ml pendant 10 à 15 secondes. Lorsque la solution a été injectée dans un volume de 3 à 5 ml, la sensibilité du patient aux dérivés de l'acide barbiturique est déterminée en 30 secondes. Si aucune réaction allergique n'est notée, continuez l'introduction du médicament jusqu'au stade chirurgical de l'anesthésie. Depuis le début du sommeil narcotique, avec une seule injection d'anesthésique, la durée de l'anesthésie est de 10 à 15 minutes. Pour maintenir l'anesthésie, les barbituriques sont administrés par fractions de 100 à 200 mg du médicament, jusqu'à une dose totale ne dépassant pas 1 g. Lors de l'administration de barbituriques, l'infirmière enregistre le pouls, la pression artérielle et la respiration. L'anesthésiste surveille l'état de la pupille, le mouvement des globes oculaires, la présence d'un réflexe cornéen pour déterminer le niveau d'anesthésie. L'anesthésie aux barbituriques, en particulier au thiopental sodique, se caractérise par une dépression du centre respiratoire, la présence d'un appareil de respiration artificielle est donc nécessaire. En cas d'arrêt respiratoire (apnée), une ventilation pulmonaire artificielle (ALV) est effectuée à l'aide d'un masque respiratoire. L'administration rapide de thiopental sodique peut entraîner une diminution de la pression artérielle et une dépression cardiaque. Dans ce cas, l'administration du médicament est arrêtée. En chirurgie, l'anesthésie avec des barbituriques comme mononarcose est utilisée pour des opérations de courte durée qui ne dépassent pas 20 minutes (par exemple, ouverture d'abcès, phlegmon, réduction de luxations, manipulations diagnostiques et repositionnement de fragments osseux). Les dérivés de l'acide barbiturique sont également utilisés pour l'anesthésie par induction. Viadryl (predion pour injection) est utilisé à la dose de 15 mg/kg, avec une dose totale de 1000 mg en moyenne. Viadryl est principalement utilisé à petites doses avec du protoxyde d'azote. À fortes doses, ce médicament peut entraîner une diminution de la pression artérielle. Une complication de son utilisation est le développement de phlébites et de thrombophlébites. Afin de prévenir leur développement, il est recommandé d'administrer lentement le médicament dans la veine centrale sous la forme d'une solution à 2,5 %. Viadryl est utilisé pour les examens endoscopiques comme type d'anesthésie d'introduction. Le propanidide (épontol, sombrevin) est disponible en ampoules de 10 ml d'une solution à 5%. La dose du médicament est de 7 à 10 mg / kg, administrée par voie intraveineuse, rapidement (la dose totale est de 500 mg en 30 secondes). Le sommeil vient immédiatement - "au bout de l'aiguille". La durée du sommeil anesthésique est de 5 à 6 minutes. Le réveil est rapide, calme. L'utilisation de propanidide provoque une hyperventilation, qui survient immédiatement après la perte de conscience. Parfois, une apnée peut survenir. Dans ce cas, la ventilation doit être effectuée à l'aide d'un appareil respiratoire. Le côté négatif est la possibilité de formation d'hypoxie dans le contexte de l'administration du médicament. Il est nécessaire de contrôler la pression artérielle et le pouls. Le médicament est utilisé pour l'anesthésie d'induction dans la pratique chirurgicale ambulatoire pour les petites opérations. L'hydroxybutyrate de sodium est administré par voie intraveineuse très lentement. La dose moyenne est de 100 à 150 mg/kg. Le médicament crée une anesthésie superficielle, il est donc souvent utilisé en association avec d'autres stupéfiants, tels que les barbituriques - propanidide. Il est souvent utilisé pour l'anesthésie par induction. La kétamine (ketalar) peut être utilisée pour l'administration intraveineuse et intramusculaire. La dose estimée du médicament est de 2 à 5 mg / kg. La kétamine peut être utilisée pour la mononarcose et pour l'anesthésie par induction. Le médicament provoque un sommeil superficiel, stimule l'activité du système cardiovasculaire (la pression artérielle augmente, le pouls s'accélère). L'introduction du médicament est contre-indiquée chez les patients souffrant d'hypertension. Largement utilisé en état de choc chez les patients souffrant d'hypotension. Les effets secondaires de la kétamine peuvent être des hallucinations désagréables à la fin de l'anesthésie et au réveil. 4. Anesthésie par inhalation L'anesthésie par inhalation est réalisée à l'aide de liquides (volatils) qui s'évaporent facilement - éther, halothane, méthoxy-flurane (pentran), trichloroéthylène, chloroforme ou substances narcotiques gazeuses - protoxyde d'azote, cyclopropane. Avec la méthode d'anesthésie endotrachéale, la substance narcotique pénètre dans le corps à partir de la machine d'anesthésie par un tube inséré dans la trachée. L'avantage de la méthode est qu'elle offre une perméabilité libre des voies respiratoires et peut être utilisée dans des opérations sur le cou, le visage, la tête, élimine la possibilité d'aspiration de vomi, de sang; réduit la quantité de drogue utilisée; améliore les échanges gazeux en réduisant l'espace "mort". L'anesthésie endotrachéale est indiquée pour les interventions chirurgicales majeures, elle est utilisée comme une anesthésie à plusieurs composants avec des myorelaxants (anesthésie combinée). L'utilisation totale de plusieurs médicaments à petites doses réduit les effets toxiques sur l'organisme de chacun d'eux. L'anesthésie mixte moderne est utilisée pour fournir une analgésie, éteindre la conscience, la relaxation. L'analgésie et l'extinction de la conscience sont réalisées en utilisant une ou plusieurs substances narcotiques - inhalées ou non inhalées. L'anesthésie est réalisée au premier niveau de la phase chirurgicale. La relaxation musculaire, ou relaxation, est obtenue par l'administration fractionnée de relaxants musculaires. 5. Étapes de l'anesthésie Il y a trois étapes d'anesthésie. 1. Introduction à l'anesthésie. L'anesthésie d'introduction peut être réalisée avec n'importe quelle substance narcotique, contre laquelle se produit un sommeil anesthésique assez profond sans stade d'excitation. On utilise principalement des barbituriques, du fentanyl en combinaison avec du sombrevin, moulu avec du sombrevin. Le thiopental sodique est également souvent utilisé. Les médicaments sont utilisés sous la forme d'une solution à 1%, ils sont administrés par voie intraveineuse à une dose de 400-500 mg. Dans le contexte de l'anesthésie par induction, des relaxants musculaires sont administrés et une intubation trachéale est réalisée. 2. Maintien de l'anesthésie. Pour maintenir l'anesthésie générale, vous pouvez utiliser n'importe quel médicament capable de protéger le corps contre les traumatismes chirurgicaux (halothane, cyclopropane, protoxyde d'azote avec oxygène), ainsi que la neuroleptanalgésie. L'anesthésie est maintenue aux premier et deuxième niveaux de la phase chirurgicale et des relaxants musculaires sont administrés pour éliminer les tensions musculaires, qui provoquent une myoplégie de tous les groupes musculaires squelettiques, y compris les respiratoires. Par conséquent, la condition principale de la méthode d'anesthésie combinée moderne est la ventilation mécanique, qui est réalisée en pressant rythmiquement un sac ou une fourrure, ou en utilisant un appareil de respiration artificielle. Récemment, la neuroleptanalgésie la plus répandue. Avec cette méthode, l'oxyde nitreux avec de l'oxygène, du fentanyl, du dropéridol, des relaxants musculaires sont utilisés pour l'anesthésie. Anesthésie d'introduction par voie intraveineuse. L'anesthésie est maintenue par inhalation de protoxyde d'azote avec de l'oxygène dans un rapport de 2: 1, administration intraveineuse fractionnée de fentanyl et de dropéridol 1-2 ml toutes les 15-20 minutes. Avec une fréquence cardiaque accrue, le fentanyl est administré, avec une augmentation de la pression artérielle - dropéridol. Ce type d'anesthésie est plus sûr pour le patient. Le fentanyl améliore le soulagement de la douleur, le dropéridol supprime les réactions végétatives. 3. Retrait de l'anesthésie. À la fin de l'opération, l'anesthésiste arrête progressivement l'administration de substances narcotiques et de relaxants musculaires. La conscience revient au patient, la respiration indépendante et le tonus musculaire sont restaurés. Les critères d'évaluation de l'adéquation de la respiration spontanée sont des indicateurs de RO2, RSO2, pH. Après réveil, rétablissement de la respiration spontanée et du tonus musculaire squelettique, l'anesthésiste peut extuber le patient et le transporter pour une observation plus approfondie en salle de réveil. 6. Méthodes de surveillance du déroulement de l'anesthésie Pendant l'anesthésie générale, les principaux paramètres de l'hémodynamique sont constamment déterminés et évalués. Mesurez la tension artérielle, le pouls toutes les 10 à 15 minutes. Chez les personnes atteintes de maladies du système cardiovasculaire, ainsi que lors d'opérations thoraciques, il est nécessaire de surveiller en permanence la fonction du muscle cardiaque. L'observation électroencéphalographique peut être utilisée pour déterminer le niveau d'anesthésie. Pour contrôler la ventilation pulmonaire et les changements métaboliques pendant l'anesthésie et la chirurgie, il est nécessaire de mener une étude de l'état acido-basique (RO2, RSO2, pH, BE). Pendant l'anesthésie, l'infirmière tient à jour un tableau anesthésique du patient, dans lequel elle consigne obligatoirement les principaux indicateurs de l'homéostasie : pouls, pression artérielle, pression veineuse centrale, fréquence respiratoire et paramètres du ventilateur. Dans cette carte, toutes les étapes de l'anesthésie et de la chirurgie sont fixées, les doses de substances narcotiques et de myorelaxants sont indiquées. Tous les médicaments utilisés pendant l'anesthésie sont notés, y compris les milieux de transfusion. Le temps de toutes les étapes de l'opération et de l'administration de médicaments est enregistré. À la fin de l'opération, le nombre total de tous les moyens utilisés est indiqué, ce qui est également reflété dans la carte d'anesthésie. Un enregistrement est fait de toutes les complications pendant l'anesthésie et la chirurgie. La carte d'anesthésie est intégrée au dossier médical. 7. Complications de l'anesthésie Des complications pendant l'anesthésie peuvent survenir en raison d'une mauvaise technique d'anesthésie ou de l'effet des anesthésiques sur les organes vitaux. Une de ces complications est le vomissement. Au début de l'introduction de l'anesthésie, les vomissements peuvent être associés à la nature de la maladie dominante (sténose pylorique, occlusion intestinale) ou à l'effet direct du médicament sur le centre du vomissement. Dans le contexte des vomissements, l'aspiration est dangereuse - l'entrée du contenu gastrique dans la trachée et les bronches. Le contenu gastrique qui a une réaction acide prononcée, tombant sur les cordes vocales puis pénétrant dans la trachée, peut entraîner un laryngospasme ou un bronchospasme, entraînant une insuffisance respiratoire avec hypoxie ultérieure - c'est ce que l'on appelle le syndrome de Mendelssohn, accompagné de cyanose, bronchospasme, tachycardie. La régurgitation peut être dangereuse - le rejet passif du contenu gastrique dans la trachée et les bronches. Cela se produit généralement dans le contexte d'une anesthésie profonde à l'aide d'un masque avec relâchement des sphincters et débordement de l'estomac ou après l'introduction de relaxants musculaires (avant l'intubation). L'ingestion dans les poumons lors de vomissements ou de régurgitations de contenu gastrique acide entraîne une pneumonie grave, souvent mortelle. Afin d'éviter l'apparition de vomissements et de régurgitations, il est nécessaire de retirer son contenu de l'estomac avec une sonde avant l'anesthésie. Chez les patients atteints de péritonite et d'obstruction intestinale, la sonde est laissée dans l'estomac pendant toute l'anesthésie, alors qu'une position de Trendelenburg modérée est nécessaire. Avant le début de l'anesthésie, pour éviter les régurgitations, vous pouvez appliquer la méthode Selick - pression sur le cartilage cricoïde postérieurement, ce qui provoque un serrage de l'œsophage. En cas de vomissements, il est nécessaire de retirer rapidement le contenu gastrique de la cavité buccale avec un écouvillon et une aspiration ; en cas de régurgitation, le contenu gastrique est retiré par aspiration à travers un cathéter inséré dans la trachée et les bronches. Des vomissements suivis d'une aspiration peuvent survenir non seulement pendant l'anesthésie, mais aussi au réveil du patient. Pour éviter l'aspiration dans de tels cas, il est nécessaire que le patient prenne une position horizontale ou la position de Trendelenburg, tourne la tête sur le côté. Le patient doit être surveillé. Des complications du système respiratoire peuvent survenir en raison d'une altération de la perméabilité des voies respiratoires. Cela peut être dû à des défauts de l'appareil d'anesthésie. Avant de commencer l'anesthésie, il est nécessaire de vérifier le fonctionnement de l'appareil, son étanchéité et la perméabilité des gaz à travers les tuyaux respiratoires. Une obstruction des voies respiratoires peut survenir à la suite d'une rétraction de la langue lors d'une anesthésie profonde (niveau III du stade chirurgical de l'anesthésie). Lors d'une anesthésie, des corps étrangers solides (dents, prothèses) peuvent pénétrer dans les voies respiratoires supérieures. Pour prévenir ces complications, il est nécessaire d'avancer et de soutenir la mâchoire inférieure dans le contexte d'une anesthésie profonde. Avant l'anesthésie, les prothèses doivent être retirées, les dents du patient doivent être examinées. Les complications de l'intubation trachéale réalisée par laryngoscopie directe peuvent être regroupées comme suit : 1) dommages aux dents par la lame du laryngoscope; 2) dommages aux cordes vocales ; 3) introduction d'un tube endotrachéal dans l'œsophage ; 4) introduction d'un tube endotrachéal dans la bronche droite ; 5) sortie du tube endotrachéal de la trachée ou en le pliant. Les complications décrites peuvent être prévenues par une bonne connaissance de la technique d'intubation et un contrôle de la position du tube endotrachéal dans la trachée au-dessus de sa bifurcation (par auscultation des poumons). Complications du système circulatoire. Une diminution de la pression artérielle à la fois pendant la période d'anesthésie et pendant l'anesthésie peut survenir en raison de l'effet des substances narcotiques sur l'activité du cœur ou sur le centre vasculaire-moteur. Cela se produit avec une surdose de substances narcotiques (souvent de l'halothane). Une hypotension peut apparaître chez les patients avec un CBC bas avec le dosage optimal de substances narcotiques. Pour prévenir cette complication, il est nécessaire de combler le déficit en BCC avant l'anesthésie, et pendant l'opération, accompagnée d'une perte de sang, de transfuser des solutions de substitution du sang et du sang. Les troubles du rythme cardiaque (tachycardie ventriculaire, extrasystole, fibrillation ventriculaire) peuvent survenir pour plusieurs raisons : 1) hypoxie et hypercapnie résultant d'une intubation prolongée ou d'une ventilation insuffisante pendant l'anesthésie ; 2) surdosage de substances narcotiques - barbituriques, halothane; 3) l'utilisation d'épinéphrine dans le contexte de l'halothane, ce qui augmente la sensibilité de l'halothane aux catécholamines. Un contrôle électrocardiographique est nécessaire pour déterminer le rythme cardiaque. Le traitement est effectué en fonction de la cause de la complication et comprend l'élimination de l'hypoxie, une diminution de la dose du médicament, l'utilisation de médicaments à base de quinine. L'arrêt cardiaque est la complication la plus dangereuse pendant l'anesthésie. Elle est le plus souvent causée par un contrôle incorrect de l'état du patient, des erreurs dans la technique d'anesthésie, une hypoxie, une hypercapnie. Le traitement consiste en une réanimation cardiorespiratoire immédiate. Complications du système nerveux. Pendant l'anesthésie générale, une diminution modérée de la température corporelle est autorisée en raison de l'influence des substances narcotiques sur les mécanismes centraux de thermorégulation et de refroidissement du patient dans la salle d'opération. Le corps des patients souffrant d'hypothermie après l'anesthésie tente de rétablir la température corporelle en raison de l'augmentation du métabolisme. Dans ce contexte, des frissons apparaissent à la fin de l'anesthésie et après celle-ci, ce qui est observé après une anesthésie à l'halothane. Pour prévenir l'hypothermie, il est nécessaire de surveiller la température dans la salle d'opération (21-22 ° C), de couvrir le patient, si nécessaire, d'un traitement par perfusion, de verser des solutions réchauffées à la température du corps et d'inhaler des stupéfiants chauds et humidifiés. L'œdème cérébral est une conséquence d'une hypoxie prolongée et profonde pendant l'anesthésie. Le traitement doit être immédiat, il faut suivre les principes de déshydratation, hyperventilation, refroidissement local du cerveau. Lésions nerveuses périphériques. Cette complication survient un jour ou plus après l'anesthésie. Le plus souvent, les nerfs des membres supérieurs et inférieurs et le plexus brachial sont endommagés. Ceci est la conséquence d'une mauvaise position du patient sur la table d'opération (abduction du bras à plus de 90° du corps, placer le bras derrière la tête, fixer le bras à l'arc de la table d'opération, allonger les jambes sur supports sans rembourrage). La position correcte du patient sur la table élimine la tension des troncs nerveux. Le traitement est effectué par un neuropathologiste et un physiothérapeute. Conférence numéro 13. Anesthésie locale 1. Anesthésie de surface Ce type d'anesthésie est réalisé par contact de la substance anesthésique avec l'un ou l'autre organe, sa surface. A cet effet, une solution à 1-3% de cocaïne, une solution à 0,25-2% de dicaïne, une solution à 1-2% de lidocaïne, une solution à 1-5% de trimécaïne et une solution à 0,5-2% sont utilisées. la solution. La plupart des anesthésiques locaux se lient aux canaux sodiques inactivés, empêchant leur activation et l'entrée du sodium dans la cellule lors de la dépolarisation membranaire, obtenant ainsi un effet analgésique. La technique d'anesthésie de surface est simple et consiste à lubrifier, instiller une solution ou la pulvériser à l'aide de pistolets pulvérisateurs spéciaux. Le début d'action de l'anesthésique dépend du pH, un pH bas prenant plus de temps à agir qu'un pH élevé. La durée d'action de l'anesthésique dépend du degré de sa liaison aux protéines. Ce type d'anesthésie est utilisé dans les manipulations diagnostiques et en ophtalmologie, oto-rhino-laryngologie. 2. Anesthésie régionale L'anesthésie régionale comprend le plexus, la conduction, la péridurale, la paravertébrale et d'autres types d'anesthésie. Contrairement à l'anesthésie générale, l'anesthésie régionale fournit une analgésie chirurgicale adéquate en raison du blocage périphérique des impulsions douloureuses tout en maintenant des fonctions vitales normales. L'anesthésie locorégionale est techniquement difficile, et nécessite une connaissance précise de la localisation anatomique et topographique du plexus nerveux ou du conducteur nerveux, une orientation claire dans les points d'identification permanents (protrusions osseuses, artères, muscles), la capacité d'évaluer la résistance des tissus et les sensations du patient. Pour désactiver la sensibilité à la douleur, il suffit d'introduire une solution à 1% de trimécaïne (lidocaïne), et pour désactiver la sensibilité proprioceptive et obtenir une relaxation musculaire, des solutions anesthésiques locales plus concentrées doivent être utilisées (par exemple, trimécaïne 2-2,5%) . La restauration de la sensibilité se fait dans l'ordre inverse, c'est-à-dire qu'apparaissent d'abord le tonus musculaire et les sensations proprioceptives, puis les sensations de douleur et de température. Il est important de prendre en compte qu'avec une augmentation de la concentration et de la quantité d'anesthésique local, sa toxicité augmente. Les solutions les plus utilisées sont la trimécaïne 1-2 %, la lidocaïne 1-2 % et la bupivocaïne 0,75-0,5 %. Les anesthésiques locaux bloquent plus facilement et plus rapidement les fibres de myéline minces et sans myéline (toutes végétatives, ainsi que les stimuli de température et de douleur). Les fibres épaisses de myéline qui vont aux muscles squelettiques, aux récepteurs tactiles et aux propriocepteurs sont très résistantes à l'anesthésie, car elles sont affectées par l'anesthésie locale dans la zone des interceptions de Ranvier. La diffusion de l'anesthésique dans la partie lipoïde de la fibre nerveuse est rapide, mais seulement jusqu'à ce que la concentration à l'extérieur du nerf soit plus élevée que dans le nerf lui-même. Après que ce rapport change, l'anesthésique diffuse dans la direction opposée du nerf dans les tissus environnants. Les solutions anesthésiques faiblement concentrées, injectées en grands volumes, se diffusent largement, mais leur diffusion est négligeable. Les solutions concentrées introduites en petits volumes ont un bon degré de diffusion. L'effet de l'anesthésie dépend de la quantité d'anesthésique pénétrant par voie transpérineurale et provoquant un bloc seuil adéquat. Doubler la concentration de l'anesthésique injecté prolonge l'anesthésie de 1/3 et l'introduction d'un double volume - seulement de 3 à 9%. Les anesthésiques locaux entraînent souvent des réactions anaphylactiques. Trimécaïne : la durée d'action est de 1 à 1,5 heure, la dose unique maximale est de 800 à 1000 1 mg. La lidocaïne (xicaïne) est utilisée dans une solution à 2-2,5 %, la durée de l'anesthésie peut aller jusqu'à 3 à 0,5 heures. La bupivocaïne (marcaïne ) est utilisé dans une solution à 0,75-150% en une dose unique maximale de 170-8 mg, la durée d'action est de 12-XNUMX heures.Pour l'utilisation d'anesthésiques à action prolongée, l'ajout de lidocaïne accélère nettement l'apparition de la effet, réduisant la période de latence. Lors de la réalisation d'une anesthésie régionale, vous devez connaître et suivre les règles générales: 1) connaître clairement les caractéristiques anatomiques et topographiques des plexus nerveux et des conducteurs dans la zone de l'anesthésie proposée, ainsi que la technique d'exécution de l'anesthésie; 2) choisir le bon anesthésique local, déterminer sa concentration, sa dose totale et son mode d'administration au plexus nerveux ou au conducteur ; 3) évaluer l'état du patient et connaître les antécédents allergiques et pharmacothérapeutiques ; 4) avertir le patient de la possible préservation de la sensibilité tactile et proprioceptive profonde lors de l'anesthésie de conduction et du plexus ; 5) surveiller en permanence l'hémodynamique et la respiration du patient après l'anesthésie ; 6) avant ou immédiatement après l'anesthésie, effectuer une ponction veineuse et prendre des mesures pour prévenir d'éventuelles complications ; 7) effectuer dans le respect des mesures aseptiques et antiseptiques et éliminer soigneusement les substances chimiquement actives (iode, chlorhexidine, etc.) de la surface de la peau avant la ponction ; 8) avant l'introduction d'un anesthésique local, il est impératif d'effectuer un test d'aspiration pour éviter que l'aiguille ne pénètre dans le vaisseau artériel ; 9) rappelez-vous que la paresthésie ressentie par le patient lors d'une anesthésie régionale est une condition préalable au succès de l'obtention d'une analgésie; son absence indique une panne possible ; 10) pour faciliter la recherche du conducteur nerveux ou du plexus, il est conseillé d'utiliser la stimulation électrique, en appliquant une impulsion négative à l'aiguille et une impulsion positive (anode) au pôle indifférent de l'électrode, qui est fixée sur le patient peau. 3. Anesthésie du plexus cervical (ASP) L'ACS, réalisée d'un ou des deux côtés, vous permet d'effectuer toutes les opérations sur le cou, la glande thyroïde, les vaisseaux brachiocéphaliques en cas de blessures par balle, de blessures et de maladies tumorales. Le plexus cervical (Plexus cervicalis) est formé à partir des branches antérieures des quatre nerfs cervicaux supérieurs (C1-DE4) à leur sortie des foramens intervertébraux. Il est situé sur la face antérieure du muscle scalène moyen et du muscle qui soulève l'omoplate, latéralement aux apophyses transverses des vertèbres cervicales. Les nerfs moteurs du plexus cervical innervent les muscles du cou et les nerfs sensitifs - la peau de la région occipitale de la tête, les surfaces antérieure et latérale du cou, la région sous-clavière jusqu'au niveau des côtes I et II et l'oreillette. Le plus gros nerf du plexus cervical est le phrénique (p. prenicus), qui est formé de C3-DE4 et moins souvent en raison d'une branche supplémentaire de C5. La plupart des nerfs sensoriels sortent au milieu sous le bord postérieur du muscle sternocléidomastoïdien et divergent dans les couches superficielles du cou, de la peau de la région occipitale de la tête et du haut de la poitrine. Lors de l'anesthésie des nerfs sensibles du plexus cervical le long du bord postérieur au milieu du muscle sternocléidomastoïdien, un certain nombre d'opérations sur le cou peuvent être effectuées, mais il convient de rappeler que l'anesthésie doit être bilatérale, car les nerfs s'anastomosent le long du ligne médiane du cou. Pour les grandes opérations dans les couches profondes du cou (strumectomie, ablation des tumeurs du cou, laryngectomie, endartériectomie carotidienne, etc.), il est nécessaire d'anesthésier le plexus cervical par voie antérieure. Avec un accès latéral, il existe un risque de complications graves (introduction d'une solution anesthésique dans l'espace sous-dural), il n'est donc pas utilisé. Pour réaliser un ASS par voie antérieure, il faut que le patient soit allongé sur le dos avec un petit bourrelet sous la nuque. La tête doit reposer à plat, droite dans la ligne médiane sans tourner ou être légèrement tournée dans la direction opposée à la ponction. Les mains le long du corps, l'anesthésiste se tient à la tête de la ponction. Repères : muscle sternocléidomastoïdien, os hyoïde, artère carotide interne et angle mandibulaire. Technique d'anesthésie 2 cm sous l'angle de la mâchoire inférieure, en avant du muscle sternocléidomastoïdien, la pulsation de l'artère carotide interne est déterminée. La branche horizontale de l'os hyoïde correspond au niveau de l'apophyse transverse de la vertèbre C3. Le point d'injection de l'aiguille est situé à l'intersection de la ligne, qui prolonge la branche horizontale de l'os hyoïde, avec le bord antérieur du muscle sternocléidomastoïdien. À ce point d'intersection, dans des conditions aseptiques, une «zeste de citron» se forme et une aiguille d'injection est dirigée à travers celle-ci de l'extérieur vers l'intérieur et d'avant en arrière, en la faisant avancer médialement vers le muscle sternocléidomastoïdien et derrière la carotide interne artère (dans l'espace entre le muscle sternocléidomastoïdien et l'artère carotide interne palpable) jusqu'à ce que le patient développe une paresthésie ou que l'aiguille touche l'apophyse transverse de la vertèbre C3. La profondeur de l'injection ne dépasse pas 2 à 5 cm, l'aiguille est solidement fixée dans cette position et un test d'aspiration est effectué, déterminant si l'extrémité de l'aiguille se trouve dans la lumière du vaisseau. Pour l'anesthésie, 10 à 12 ml d'une solution à 2% de trimécaïne sont injectés des deux côtés. Pour améliorer l'anesthésie du plexus cervical, vous pouvez en outre bloquer les branches superficielles qui vont à la face antérieure du cou. Le lieu de leur sortie est le milieu du bord postérieur du muscle sternocléidomastoïdien. L'aiguille est injectée au point de sortie sous le fascia superficiel du cou. Une solution de trimécaïne à 2% est administrée en une quantité de 3 à 5 ml par voie crânienne et caudale (en forme d'éventail). Une anesthésie adéquate se produit après 8 à 12 minutes et procure un soulagement efficace de la douleur chez la plupart des patients en 1,5 à 2 heures. Complications Syndrome de Horner, bloc du nerf phrénique, parésie du nerf récurrent, hypotension avec injection intravasculaire d'un anesthésique. L'enrouement est le principal symptôme du bloc du plexus cervical. La complication la plus dangereuse avec un accès latéral est le développement d'une rachianesthésie élevée et la pénétration d'anesthésique dans la cavité du ventricule IV, dont les symptômes sont la paralysie des centres bulbaires, la dilatation de la pupille, l'abaissement de la pression artérielle, l'insuffisance respiratoire et l'atonie musculaire. . Les contre-indications absolues à l'anesthésie du plexus cervical sont la parésie du nerf phrénique du côté opposé, les lésions des nerfs du plexus cervical. 4. Anesthésie du plexus brachial (APS) L'APS vous permet d'effectuer toutes les opérations du membre supérieur, de l'articulation de l'épaule, de l'épaule, de l'avant-bras et de la main : amputations, traitement chirurgical des plaies avec repositionnement et fixation des fragments osseux, opérations des vaisseaux sanguins et des nerfs, réduction de la luxation de l'épaule, etc. La fréquence des interventions chirurgicales du membre supérieur, notamment en temps de guerre, pose la question des méthodes rationnelles d'anesthésie lors de ces interventions. Topographiquement, il y a 2 parties du plexus brachial : supraclaviculaire et sous-clavière. Les branches s'étendent de la partie supraclaviculaire aux muscles profonds du cou et aux muscles de la ceinture scapulaire. La partie sous-clavière du plexus brachial se compose de trois troncs recouvrant l'artère axillaire des côtés intérieur, arrière et extérieur. Les nerfs longs partent des troncs, vont à la partie libre du membre supérieur, et un nerf court à la ceinture scapulaire. Du tronc interne partent le nerf cubital et la racine inférieure vers le nerf médian; les nerfs radial et axillaire partent du tronc postérieur, et le nerf musculo-cutané et la racine supérieure du nerf médian partent du tronc externe. Par conséquent, l'anesthésie du plexus brachial est possible dans différentes versions utilisant des approches supraclaviculaires, axillaires et sous-clavières. Parmi les approches supraclaviculaires, les méthodes d'anesthésie dans l'espace interstitiel sont les plus largement utilisées car les plus simples, les plus fiables et les moins compliquées. Anesthésie du plexus brachial par Winnie Le patient est allongé sur le dos, sa tête est tournée dans la direction opposée au site de ponction, le menton est amené à la ceinture scapulaire controlatérale. La main du côté de la ponction repose le long du corps, légèrement tirée vers le bas. Repères : muscle sternocléidomastoïdien, scalène antérieur, espace interstitiel, veine jugulaire externe, clavicule, cartilage cricoïde. Technique d'anesthésie. La peau est traitée avec une solution antiseptique. Derrière le muscle sternocléidomastoïdien, qui se dessine nettement avec une légère élévation de la tête, au niveau du cartilage cricoïde, le bout des doigts de la main gauche se place sur le muscle scalène antérieur. Avec un déplacement supplémentaire des doigts latéralement de 0,5 à 1,5 cm entre les muscles scalènes antérieur et moyen, l'écart interscalène se fait sentir. Il devient plus distinct avec une respiration profonde, car cela tend les muscles scalènes. Dans la profondeur de l'espace interstitiel, les apophyses transverses des vertèbres cervicales sont palpées (sensation de résistance ferme) et, avec une pression accrue du bout du doigt, une paresthésie de l'épaule ou de la ceinture scapulaire est souvent provoquée; plus caudalement, dans l'espace interstitiel, l'artère sous-clavière peut être palpée. L'espace interstitiel de la partie supérieure est traversé par la veine jugulaire externe. Le point d'injection de l'aiguille est situé dans la partie supérieure de l'espace interstitiel au niveau du cartilage cricoïde. À ce stade, une "croûte de citron" se forme et, à travers elle, l'aiguille est dirigée médialement et quelque peu vers le bas, d'avant en arrière (dans le sens dorsal) vers l'apophyse transverse C6 à un angle de 30° par rapport au plan sagittal. Lorsque l'aiguille est avancée vers l'intérieur à une distance de 1,5 à 4 cm, une paresthésie se produit et la pointe de l'aiguille repose contre l'apophyse transverse de la 6e vertèbre cervicale. Dans cette position, l'aiguille est fixée ou relevée de 1 à 2 mm et, après un test d'aspiration, 30 à 40 ml d'une solution à 2% de trimécaïne (lidocaïne) ou une solution à 0,5-0,75% de bupivocaïne (marcaïne) est injecté. Lors de l'introduction des premiers millilitres de solution anesthésique locale, le patient ressent une douleur de courte durée ("choc électrique"), indiquant l'emplacement correct de la pointe de l'aiguille. En l'absence de paresthésie, la position de la pointe de l'aiguille peut être vérifiée en introduisant 0,5 ml d'une solution de chlorure de sodium à 0,9 % sortie du réfrigérateur. L'apparition d'une sensation de douleur au membre supérieur indique le contact d'une solution froide avec un nerf. Contre-indications: parésie du nerf récurrent ou phrénique du côté opposé, lésions des nerfs du plexus brachial. Complications possibles : injection intravasculaire d'une solution anesthésique locale, notamment dans l'artère vertébrale, dont la diffusion rapide entraîne une intoxication du SNC ; l'administration sous-arachnoïdienne d'une solution anesthésique provoque un bloc rachidien total ; l'administration péridurale entraîne une forte anesthésie péridurale. Anesthésie du plexus brachial dans l'espace interstitiel selon la méthode de S. V. Gavrilin et L. G. Tikhonov La principale différence entre cette méthode et les autres est qu'il n'y a pas de dôme de la plèvre et de gros vaisseaux sanguins au site de ponction. Le patient est allongé sur le dos, la tête est tournée dans la direction opposée au site de ponction, le menton est amené à la ceinture scapulaire controlatérale. Un petit rouleau est placé sous les épaules, le bras du côté de la ponction repose le long du corps. Repères : clavicule, muscle sternocléidomastoïdien. Technique d'anesthésie. Le point d'injection de l'aiguille est situé au sommet de la perpendiculaire, restauré à partir du bord supérieur du milieu de la clavicule, dont la longueur est égale à ¼ de la longueur du muscle sternocléidomastoïdien. À ce stade, une «écorce de citron» se forme, l'aiguille d'injection intramusculaire est insérée à un angle de 60 ° par rapport à la surface de la peau, tandis que l'aiguille et une perpendiculaire imaginaire ou dessinée doivent être dans le même plan. L'aiguille est insérée dans le sens de l'apophyse transverse de la 6ème vertèbre cervicale jusqu'à l'apparition de paresthésies au niveau du membre supérieur. En l'absence de paresthésie, l'aiguille est avancée jusqu'au processus transverse de la 6e vertèbre cervicale et, après l'avoir tirée vers elle-même de 1 à 2 mm, 30 à 40 ml d'une solution à 2% de trimécaïne ou de lidocaïne sont injectés . La profondeur d'insertion de l'aiguille est de 2 à 5 cm. Anesthésie du plexus brachial dans la modification de V. S. Sokolovsky Le patient est allongé sur le dos, la tête est située dans la ligne médiane, les bras reposent le long du corps. Repères : muscle sternocléidomastoïdien et clavicule. Technique d'anesthésie. Pour faciliter la recherche d'un point sur la peau du cou, un triangle est construit avec un sommet dans la zone de l'articulation sternoclaviculaire du côté de l'anesthésie. Les rayons du triangle sont l'axe de la clavicule et une ligne droite reliant le processus mastoïdien à l'articulation sternoclaviculaire. Une perpendiculaire est restituée à la bissectrice de l'angle ABC à partir du milieu de la clavicule. Le point d'intersection est le point d'injection de l'aiguille qui avance d'un angle de 45° par rapport au plan horizontal de la table d'opération et perpendiculaire à l'axe du rachis cervical. À une profondeur de 2 à 3 cm, après avoir reçu une paresthésie et effectué un test d'aspiration, 30 à 40 ml d'une solution à 2% de trimécaïne (lidocaïne) sont injectés. L'anesthésie se produit en 10-12 minutes. Lorsqu'une paresthésie non concluante est obtenue, il est souhaitable d'utiliser la stimulation électrique pour identifier le tronc nerveux du plexus cervical. 5. Anesthésie des nerfs périphériques dans la région du poignet Pour les opérations de la main, il est nécessaire d'anesthésier les nerfs cubital, médian et radial. Dans tous les cas, l'aiguille est injectée au niveau du pli proximal du poignet. Pendant l'anesthésie, le patient est allongé sur le dos, au niveau du poignet, le bras est en supination et légèrement plié. Repères : cubitus styloïde, pisiforme, tendon fléchisseur ulnaire du carpe et tendon long fléchisseur du carpe. Anesthésie du nerf cubital Topographie du nerf ulnaire. Dans le tiers inférieur de l'avant-bras, le nerf ulnaire passe latéralement au tendon fléchisseur ulnaire et médialement à l'artère ulnaire. Au niveau du poignet ou sur la surface fléchissante de l'avant-bras, à 3-5 cm en amont du poignet, le nerf cubital se divise en deux branches - dorsale et palmaire. La branche dorsale est sensible, passe sous le tendon du fléchisseur ulnaire de la main et débouche dans le tissu sous-cutané de l'arrière de la main approximativement au niveau de l'articulation du poignet. Anastomosant avec les branches du nerf radial, il innerve 2 doigts et demi. La branche palmaire du nerf ulnaire est mixte et au niveau de l'os pisiforme, elle est divisée en deux branches - profonde et superficielle. Ce dernier est sensible et innerve la région hypothénar du 5e doigt et la face ulnaire de l'annulaire. Technique d'anesthésie de la branche palmaire du nerf cubital. Le point d'injection de l'aiguille se situe au niveau du pli proximal du poignet en dedans du tendon du fléchisseur ulnaire de la main. L'aiguille à une profondeur de 1-2 cm est passée à travers le tissu sous-cutané vers l'os pisiforme. Après l'apparition de paresthésies et avec un test d'aspiration négatif, l'aiguille est fixée et 3 à 5 ml d'une solution de trimécaïne à 2% sont injectés. En l'absence de paresthésie, l'aiguille est avancée jusqu'à ce qu'elle entre en contact avec l'os, et lorsqu'elle est retirée, les tissus sont infiltrés avec une solution de trimekaïa à 2 %. Technique d'anesthésie de la branche dorsale du nerf cubital. Le point d'injection de l'aiguille se situe au niveau de l'intersection du pli proximal du poignet avec le bord médial du tendon du muscle fléchisseur ulnaire. L'aiguille est dirigée vers le processus styloïde de l'ulna. Pour obtenir une paresthésie, 3 à 5 ml d'une solution à 2% de trimécaïne sont injectés. En l'absence de paresthésie, l'aiguille est retirée et 5 à 10 ml d'une solution de trimécaïne à 2% sont infiltrés dans les tissus. Il n'y a pas de complications. anesthésie du nerf médian Le patient est allongé sur le dos, le bras est en supination et redressé. Repères : tendon du muscle long palmaire, tendon du fléchisseur radial de la main et pli cutané proximal du poignet. Topographie. Dans le tiers inférieur de l'avant-bras, le nerf médian passe dans le sillon médial très proche de la surface de la peau, situé sous le fascia, et à environ 4-5 cm au-dessus du pli cutané distal. La rainure médiale est formée de l'extérieur par le tendon du fléchisseur radial de la main, du côté ulnaire - par le tendon du long fléchisseur de la main. Les branches du nerf médian innervent les 1er, 2e, 3e doigts et la face externe du 4e doigt, ainsi que les muscles thénars. Technique d'anesthésie. Le point d'injection de l'aiguille est situé sur la ligne du pli cutané proximal du poignet entre le tendon du muscle long palmaire et le fléchisseur radial de la main. Après avancement perpendiculaire de l'aiguille à travers le tissu sous-cutané jusqu'à une profondeur de 0,5 à 1 cm et obtention d'une paresthésie, l'aiguille est fixée et 3 à 5 ml d'une solution de lidocaïne à 2% sont injectés. S'il n'est pas possible d'obtenir une paresthésie à une profondeur de 1 cm, les tissus sont infiltrés en éventail avec 5 à 10 ml d'une solution de trimécaïne à 2 % tout en retirant lentement l'aiguille. Anesthésie du nerf radial Repères : processus styloïde du radius, artère radiale, « tabatière anatomique ». Topographie. La branche superficielle du nerf radial va d'abord à l'avant-bras avec l'artère radiale, puis dans le tiers inférieur de l'avant-bras à une distance d'environ 8 cm de l'articulation du poignet, le nerf croise le tendon du muscle brachioradial et passe à la face postérieure de l'avant-bras, où il va distalement et postérieurement, croisant le long abducteur du gros doigt et son court extenseur. Au niveau du poignet au sommet de la « tabatière anatomique » il se divise en branches terminales qui innervent les 1er, 2ème doigts et la face externe des 3èmes doigts. Les branches des trois nerfs s'anastomosent souvent les unes aux autres dans la région de l'avant-bras, du poignet et de la main. Technique d'anesthésie. Le point d'injection se situe au niveau du pli cutané proximal du poignet latéral à l'artère radiale sur la projection du haut de la « tabatière anatomique », il est injecté, et l'aiguille est dirigée vers la « tabatière ». Lorsque la paresthésie apparaît, l'aiguille est fixée, avec un test d'aspiration négatif, 3 à 5 ml d'une solution de trimécaïne à 2% sont injectés. En l'absence de paresthésie, 5 à 10 ml d'une solution à 2% de trimécaïne sont injectés en éventail dans les tissus sous-jacents, créant un "bracelet" d'infiltration de 3 à 3,5 cm de long à partir des tendons du court extenseur et du long abducteur du pouce d'un côté, au long extenseur du pouce - avec un autre. 6. Anesthésie des membres inférieurs Pour effectuer des interventions chirurgicales sur le membre inférieur, il est nécessaire d'anesthésier les quatre nerfs principaux. Trois d'entre eux - le fémoral, l'obturateur et le nerf cutané externe de la cuisse - proviennent du plexus lombaire, et le nerf sciatique est formé en partie du lombaire et de trois branches du plexus sacré. Chaque nerf innerve certaines zones du membre inférieur : le nerf fémoral - la face antérieure de la cuisse, la face interne antérieure du bas de la jambe et l'arrière du pied ; ischiatique - surface arrière et latérale de la jambe inférieure, surface plantaire du pied et son bord externe, obturateur - surface interne de la cuisse; nerf cutané externe de la cuisse - la surface latérale de la cuisse. Les zones de sensibilité profonde coïncident avec l'innervation des zones cutanées. Tous les muscles du membre inférieur reçoivent les fibres motrices des nerfs fémoral et sciatique, à l'exception du groupe des abducteurs innervés par le nerf obturateur. L'articulation du genou et sa face antérieure sont innervées par le nerf fémoral, la face interne par l'obturateur, la latérale par les nerfs cutané et sciatique externe, et la postérieure par les nerfs cutané postérieur, fémoral et sciatique. Anesthésie du plexus lombaire par voie antérieure (inguinal) Le patient est allongé sur le dos. Repères : ligament inguinal et artère fémorale. Topographie. Le plexus lombaire est formé par les branches antérieures anastomosées des racines L.1-L2-L3 et en partie par les branches antérieures de Th12 et L4 nerfs. Le plexus est situé devant les apophyses transverses des vertèbres lombaires entre le muscle carré du bas du dos - dorsalement, le muscle grand psoas - ventralement, les corps vertébraux - médialement, dégage des branches musculaires et descend dans le lit fascial. Les nerfs rachidiens lombaires ont des branches de connexion avec les nœuds lombaires des troncs sympathiques, contiennent des fibres nerveuses motrices, sensorielles et sympathiques. Les plus gros nerfs du plexus lombaire sont le nerf cutané fémoral externe (L2-L3), obturateur (L2-L4) et fémorale (L2-L4) nerfs. Ce dernier est une continuation du plexus lombaire, s'étend jusqu'à la cuisse sous le ligament pupartite à travers la lacune musculaire, étant séparé de l'artère fémorale médiale par le ligament ilio-pectiné. La largeur du nerf fémoral à cet endroit est d'environ 0,7 à 0,8 cm La profondeur du nerf fémoral est en moyenne de 1,8 à 3 cm -0,5 cm Sous le ligament inguinal, le nerf forme deux faisceaux. Les branches du faisceau antérieur innervent le muscle quadriceps fémoral, le côté moyen et médial de l'articulation du genou et passent dans le nerf saphène, qui innerve la surface médiale de la jambe inférieure et l'intérieur de la cheville. L'anesthésie du nerf sciatique permet d'opérer dans n'importe quelle zone sous l'articulation du genou, pour réduire toutes les fractures des os du membre inférieur, à l'exclusion d'une fracture du col fémoral. Technique d'anesthésie. La peau est traitée avec une solution désinfectante. Une "zeste de citron" est formée avec une solution anesthésique, après quoi l'aiguille est injectée sous le ligament inguinal 1-1,5 cm en dessous de ce dernier et 0,5-1 cm latéralement à l'artère fémorale palpée. L'aiguille est guidée à travers le tissu sous-cutané quelque peu dans la direction proximale sous le ligament inguinal, où à une profondeur de 3-4 cm après la ponction du fascia, l'aiguille échoue avec une perte de résistance et une paresthésie peut se produire, s'étendant jusqu'à la surface antérieure de la cuisse. Dans cette position, l'aiguille est fixée avec le pouce et l'index de la main gauche, et le bord de la paume de la main gauche est pressé avec force sur les tissus mous de la cuisse distale de l'aiguille et 35-40 ml d'un Une solution de trimécaïne à 1,5 % est injectée. La pression sur les tissus mous dure 1,5 à 2 minutes. Ainsi, l'anesthésie du nerf fémoral avec clampage se transforme en anesthésie du plexus lombaire, réalisée à partir de l'abord antérieur. L'action de l'anesthésie dure 2 à 2,5 heures. Complications: une résorption assez rapide de la solution anesthésique est possible lorsque l'anesthésie du plexus lombaire est associée à une anesthésie du nerf sciatique, lorsque la dose unique totale dépasse 1 g de médicament. L'anesthésie du plexus lombaire peut être réalisée par voie postérieure, tout en anesthésiant simultanément le fémur (L2-L4) et les nerfs obturateurs (L2-L3), nerf génito-fémoral (L1-L2) et le nerf cutané fémoral latéral (L2-L3). La position du patient pendant l'anesthésie est du côté sain avec les jambes fléchies. Repères : apophyse épineuse de la 4e vertèbre lombaire (ligne reliant les crêtes iliaques en arrière) ; 3 cm caudale le long des crêtes des apophyses épineuses à partir de l'apophyse épineuse de la 4e vertèbre lombaire et 5 cm latéralement à partir du dernier point. Technique d'anesthésie. À partir de l'apophyse épineuse de la 4e vertèbre lombaire dans la direction caudale, une ligne de 3 cm de long est tracée, à partir de laquelle une perpendiculaire de 5 cm de long est restaurée latéralement vers le haut.Le point final de la perpendiculaire, situé près de la crête iliaque, est le point d'injection de l'aiguille. Après avoir créé une "écorce de citron", une aiguille de 12 à 15 cm de long est insérée perpendiculairement à la peau jusqu'à ce qu'elle entre en contact avec l'apophyse transverse de la 5e vertèbre lombaire. Crânialement, glissant hors de l'apophyse transverse de la 5e vertèbre lombaire, l'aiguille pénètre dans l'épaisseur du muscle psoas carré. Dans le même temps, une résistance se fait sentir à l'introduction d'une solution avec une seringue (ou une résistance élastique se produit avec la déformation de la bulle d'air dans la seringue). L'aiguille est passée à une profondeur où il y a une sensation de "perte de résistance" (ou la bulle d'air n'est pas déformée). Ce test indique que l'aiguille est dans le fascia entre le psoas carré et le psoas majeur. L'aiguille est fixée à cette profondeur et 35 à 40 ml d'une solution de trimécaïne à 1,5 à 2 % (lidocaïne) sont injectés pour réaliser l'anesthésie. Complications possibles: injection intramusculaire d'une solution anesthésique locale avec la mauvaise position de l'aiguille, ainsi que résorption rapide de l'anesthésique dans le sang lorsqu'une solution concentrée est injectée. Anesthésie du nerf sciatique par voie antérieure Topographie. Le nerf sciatique provient du plexus sacré (L4-S3). Il est formé dans le petit bassin et quitte la cavité pelvienne par l'ouverture piriforme avec l'artère. Médialement, le nerf cutané postérieur passe, ainsi que le faisceau neurovasculaire, constitué de l'artère pudendale interne, de la veine et du nerf pudendal. Dans la région fessière, le nerf sciatique se situe sous le grand fessier, derrière les muscles gemelli, obturateur interne et carré fémoral. Sur ce dernier, il est situé approximativement à égale distance de la tubérosité ischiatique et du grand trochanter du fémur. En règle générale, dans la partie supérieure de la fosse poplitée, le nerf se divise en branches terminales: les nerfs tibial et péronier commun. Le nerf tibial traverse le milieu de la fosse poplitée, situé latéralement et superficiellement par rapport à la veine et à l'artère poplitées, et, avec les vaisseaux, pénètre dans le canal cheville-poplité. Le nerf tibial innerve le groupe musculaire postérieur de la jambe inférieure, tous les muscles de la plante du pied, la peau de la face postérieure de la jambe inférieure, le talon et le bord latéral du pied. Branches du nerf sciatique à l'articulation de la hanche. Dans la région du pli fessier, il se situe superficiellement sous le large fascia de la cuisse vers l'extérieur à partir de la longue tête du biceps fémoral. Le nerf péronier commun court le long du côté latéral de la fosse poplitée, autour de la tête du péroné. De là, il y a des branches vers l'articulation du genou et la peau de la surface latérale de la jambe inférieure, elle innerve également les muscles de la jambe inférieure, les muscles du dos du pied et la peau de l'arrière des orteils. L'anesthésie du nerf sciatique est réalisée par voie antérieure. Repères : axe iliaque antéro-supérieur et partie la plus saillante du grand trochanter du fémur. Technique d'anesthésie. Le patient est allongé sur le dos, l'épine iliaque antéro-supérieure et le point le plus saillant du grand trochanter du fémur sont reliés par une ligne droite, et une perpendiculaire à la face antérieure de la cuisse est restaurée à partir du dernier point. La longueur de la perpendiculaire est égale à la distance entre l'épine iliaque antéro-supérieure et le grand trochanter du fémur, l'extrémité de cette perpendiculaire est le point de projection. En position physiologique du membre inférieur, après traitement de la peau avec une solution désinfectante et création d'un "zeste de citron", une aiguille de 12-15 cm de long est dirigée verticalement vers le bas jusqu'à ce qu'elle repose contre le petit trochanter du fémur. Une fois que l'aiguille a glissé du petit trochanter, sans changer la direction principale, l'aiguille est portée encore plus profondément - 4-5 cm jusqu'à ce que la paresthésie se produise. S'il n'est pas possible d'obtenir une paresthésie, l'aiguille est ramenée dans l'os et, en tournant le membre vers l'intérieur de 7 à 10 °, l'aiguille est à nouveau avancée jusqu'à ce que la paresthésie apparaisse chez le patient. Anesthésie du nerf sciatique par voie postérieure Technique d'anesthésie. Le patient est allongé sur un côté sain, le membre anesthésié est fléchi au niveau des articulations de la hanche et du genou à un angle de 45 à 60°. De la partie la plus saillante du grand trochanter du fémur, une ligne droite est tracée jusqu'à l'épine iliaque postéro-supérieure, à partir du milieu de laquelle une perpendiculaire de 4 à 5 cm de long est abaissée dans la direction caudale. comme point de projection du nerf sciatique. L'aiguille est injectée à un angle de 90° par rapport au plan frontal du corps du patient et avancée jusqu'à obtention d'une paresthésie ou d'un contact avec l'os. Si nécessaire, l'aiguille est tirée vers le haut et insérée à environ 0,5 cm latéralement ou médialement par rapport à l'injection initiale. Obtenir paresthésie est un must. Entrez 20-25 ml d'une solution à 2% de lidocaïne (trimécaïne). La technique d'anesthésie ne changera pas si le patient est allongé sur le ventre. Anesthésie dans la fosse poplitée Pour les interventions chirurgicales sur le bas de la jambe et le pied, il suffit d'anesthésier les nerfs tibial et péronier dans le creux poplité. La position du patient - du côté sain ou sur le ventre. Repères : tendons du biceps, muscles semi-membraneux et semi-tendineux de la cuisse, rotule, muscle du mollet. Topographie. La fosse poplitée contient des fibres, des vaisseaux sanguins, des nerfs et des ganglions lymphatiques. Le bord externe supérieur est formé par le tendon du biceps fémoral, le bord interne supérieur est formé par les tendons des muscles semi-membraneux et semi-tendineux, la tête latérale du muscle gastrocnémien est en dessous et à l'extérieur, et la partie interne inférieure est la tête médiale. du muscle gastrocnémien. La projection de l'angle supérieur de la fosse poplitée correspond principalement au bord supérieur de la rotule dans le coin supérieur de la fosse rhomboïde du nerf sciatique et est divisée en nerfs tibial et péronier commun. Ce dernier du bord supérieur va jusqu'au bord latéral du gastrocnémien et s'enroule autour du col de la tête du péroné en demi-spirale. Dans la fosse poplitée, le nerf tibial passe le plus superficiellement le long de la ligne médiane, une veine se trouve plus profondément et médialement à partir de celui-ci, et encore plus profondément et médialement, plus près de l'os, se trouve l'artère poplitée. Technique d'anesthésie. Le coin supérieur de la fosse rhomboïde se situe au niveau du bord supérieur de la rotule. Le point d'injection se situe à 1-1,5 cm sous l'angle supérieur sur la bissectrice abaissée de cet angle, formée de l'extérieur par le tendon du biceps fémoral, de l'intérieur par les tendons des muscles semi-membraneux et semi-tendineux de la cuisse. Le sens de déplacement de l'aiguille est strictement vertical avec le patient en décubitus ventral jusqu'à obtention d'une paresthésie du nerf tibial. En l'absence de paresthésie, l'aiguille est dirigée en éventail, en la remontant à chaque fois au niveau du tissu sous-cutané. Après un test d'aspiration, 5 à 10 ml d'une solution à 2 % de trimécaïne sont injectés. Pour bloquer le nerf péronier commun à partir du même point, l'aiguille est dirigée latéralement à un angle de 30 à 45° par rapport au plan frontal. Après avoir reçu une paresthésie, 5 à 10 ml d'une solution à 2% de trimécaïne sont injectés. Il n'y a pas de complications ni de contre-indications. Complications de l'anesthésie régionale Au cours de la PR, les complications surviennent assez rarement et peuvent être divisées en deux groupes. 1. Spécifiques, qui sont davantage liés aux erreurs techniques de la méthodologie : 1) injection erronée d'un anesthésique local dans le canal rachidien ou l'espace épidural, par voie intraveineuse ou intra-artérielle (avec anesthésie du plexus cervical, anesthésie du plexus lombaire avec accès inguinal); 2) ponction de cavités et d'organes (cavité pleurale, poumon); 3) la formation d'un hématome avec négligence de la ponction et lésion d'un gros vaisseau; l'hématome comprime le tissu environnant ou le faisceau neurovasculaire; 4) hypotension prolongée et sévère qui se produit avec une résorption rapide de l'anesthésique local ; 5) traumatisme du plexus nerveux ou du conducteur avec l'extrémité de l'aiguille d'injection lors d'une manipulation brutale ; 6) l'absence d'effet analgésique après anesthésie plexique ou conductive. 2. Non spécifique, se manifestant principalement par des réactions générales et locales du corps à l'action d'un anesthésique local sous forme de réactions toxiques et allergiques. Des complications non spécifiques peuvent se développer en fonction du moment, de la dose et du site d'administration de l'anesthésique. Dans ce cas, les lésions du système nerveux central ou cardiovasculaire prédominent. Les complications du SNC peuvent être légères (limitées uniquement à l'excitation centrale) ou sévères, ce qui se manifeste par une inhibition du SNC avec une éventuelle paralysie totale. La nature des complications non spécifiques : 1) un surdosage d'anesthésique avec l'administration simultanée d'une dose importante (plus de 1 g) de trimécaïne ou de lidocaïne par voie intra-artérielle ou intraveineuse. Avec l'injection intravasculaire d'un anesthésique local, des réactions toxiques apparaissent immédiatement et en cas de surdosage du médicament - après 10 à 15 minutes. Les réactions toxiques graves avec des doses excessives d'anesthésiques locaux sont extrêmement rares. Beaucoup plus souvent (jusqu'à la mort), ils sont observés avec l'administration intravasculaire d'une solution hautement concentrée d'anesthésique local; 2) réactions allergiques à l'introduction d'un anesthésique local, caractérisées par un complexe de symptômes de troubles des systèmes nerveux central et cardiovasculaire: anxiété, troubles de la conscience, troubles de la parole, contractions musculaires, convulsions, respiration profonde, perturbation du rythme cardiaque, expansion QR, abaissement de la tension artérielle, tachycardie, apnée , asystole; 3) complications infectieuses dues à un traitement de mauvaise qualité du champ opératoire sur le site de l'anesthésie, à une stérilisation insuffisante des seringues, des aiguilles et des solutions, ainsi qu'à la présence d'une infection cutanée locale (pyodermite) dans la zone de la proposition de manipulation ; 4) le développement de l'hypotension avec l'anesthésie du plexus et de la conduction est beaucoup moins fréquent qu'avec l'anesthésie péridurale et rachidienne, mais cela ne réduit pas l'importance de corriger l'hypovolémie ; 5) avec l'introduction de solutions concentrées d'anesthésiques locaux dans un petit pourcentage de cas, on note le développement d'une bradycardie, qui est bien arrêtée par le sulfate d'atropine. Les cas de fibrillation ventriculaire et d'arrêt cardiaque sont extrêmement rares. Contre-indications pour la conduite Les contre-indications sont les suivantes. 1. Hystérie. 2. Tendance à aggraver. 3. Complications neurologiques: hémiplégie et hémiparésie de la zone d'anesthésie proposée, maladies de la moelle épinière, sclérose en plaques, maladies des nerfs périphériques. 4. Infection de la peau dans la zone du point d'injection de l'aiguille. 5. Septicémie. 6. Tendance aux saignements et à l'hypovolémie sévère après une perte de sang massive. 7. Anémie pernicieuse (contre-indication relative). 7. Anesthésie péridurale Son essence réside dans le blocage des nerfs rachidiens et de leurs racines avec un anesthésique introduit dans l'espace épidural. La technique de conduite et la zone d'anesthésie sont indiquées dans la leçon n° 2. Doses et durée de l'analgésie 1. La lidocaïne est injectée dans un volume de 4 ml (2%), la durée de l'anesthésie est de 4 heures. 2. La marcaïne est administrée à une dose de 6 à 10 ml (0,5 %), la durée de l'anesthésie est de 6 à 8 heures. 3. Naropin est administré à une dose de 4 à 6 ml (1%), la durée de l'anesthésie est de 4 à 6 heures. Avec ce type d'anesthésie, l'hémodynamique en souffre, il y a une forte diminution de la pression artérielle. Par conséquent, lors de l'utilisation de ce type d'anesthésie, une surveillance constante de la pression du patient et, si nécessaire, sa correction est nécessaire. 8. Anesthésie lombaire Ce type d'anesthésie est réalisé en injectant un anesthésique dans le canal rachidien. La technique de ponction lombaire est décrite dans la conférence n ° 2. Les caractéristiques sont que le niveau de ponction est plus élevé (T12-L1, L1-L2) et après avoir retiré le mandrin de l'aiguille, un anesthésique est immédiatement injecté. Le volume d'anesthésique est de 3 à 5 ml. Naropin est administré à une concentration de 0,5%, la lidocaïne - à 2%, la marcaïne - à 0,5%. La durée de l'anesthésie est de 4 à 6 heures.Ce type d'anesthésie provoque également une hypotension sévère. Avec un haut niveau d'anesthésie (T12-L1) peut causer des problèmes respiratoires. La complication la plus fréquente est le mal de tête. 9. Blocage vagosympathique du cou selon A. V. Vishnevsky Le patient est placé sur la table sur le dos de manière à ce que la main du côté du blocage proposé pende au-dessus du bord de la table. Le muscle sternocléidomastoïdien doit être relâché. Un rouleau est placé sous la ceinture scapulaire, la tête est rétractée dans le sens opposé; dans cette position, les contours anatomiques du cou sont bien dessinés. Le champ est traité avec une lubrification à l'alcool et à l'iode. Le médecin se tient du côté du blocus du même nom. Le site d'injection est l'angle formé par l'intersection du bord postérieur du muscle sternocléidomastoïdien avec une veine. L'index de la main gauche est placé au bord postérieur du muscle sternocléidomastoïdien, au-dessus de l'endroit où il croise la veine jugulaire externe. En appuyant fortement sur un doigt à cet endroit, ils essaient de déplacer le faisceau neurovasculaire vers la ligne médiane. Dans ce cas, le doigt sent facilement la surface antérieure des vertèbres cervicales. L'injection de l'aiguille et son avancement doivent se faire lentement, vers le haut et vers l'intérieur, tout en se concentrant sur la face antérieure de la colonne vertébrale. L'aiguille se déplace le long de la solution de novocaïne à 2% envoyée par petites portions (3-0,25 cm), ce qui assure la sécurité de l'injection. La seringue pendant l'injection est retirée à plusieurs reprises de l'aiguille à des fins de contrôle (sang). Ayant apporté l'aiguille à la vertèbre, ils sentent comment elle s'y appuie. Ensuite, la pression sur l'aiguille est affaiblie, en raison de laquelle elle s'éloigne de 1 à 2 mm, après quoi 40 à 60 ml d'une solution sont injectés, qui, se répandant dans un infiltrat rampant le long de l'aponévrose prévertébrale, recouvre le nerf vague, sympathique , et souvent des nerfs phréniques, interrompant (bloquant) la transmission des irritations de la région pleuro-pulmonaire. L'efficacité du blocage vagosympathique est mise en évidence par l'apparition du symptôme de Horner (rétrécissement de la pupille, rétrécissement de la fissure palpébrale et rétraction du globe oculaire). Le rythme respiratoire et le pouls deviennent moins fréquents, l'essoufflement et la cyanose diminuent et l'état général s'améliore. Pour éviter que l'aiguille ne pénètre dans les vaisseaux du cou, le muscle sternocléidomastoïdien avec le faisceau neurovasculaire sous-jacent doit être déplacé suffisamment fort avec l'index vers la ligne médiane. Il est important de diriger l'aiguille vers le haut et vers l'intérieur, car la déplacer dans une direction horizontale menace d'introduire une solution sous l'aponévrose prévertébrale et une complication ultérieure sous la forme d'un syndrome douloureux qui ne s'arrête pas pendant la journée. Conférence n ° 14. Évaluation de la gravité du patient et surveillance Évaluation de l'état somatique du patient. 1 point - patients dont la maladie est localisée et, en règle générale, ne provoque pas de troubles systémiques, c'est-à-dire des personnes pratiquement en bonne santé. 2 points - cela inclut les patients présentant des troubles inexprimés qui perturbent modérément l'activité vitale du corps sans changements prononcés de l'homéostasie. 3 points - patients présentant des troubles systémiques vitaux qui perturbent de manière significative le fonctionnement du corps, mais n'entraînent pas d'invalidité. 4 points - patients atteints de troubles systémiques graves qui présentent un danger élevé pour la vie humaine et entraînent une invalidité. 5 points - patients dont l'état est considéré comme critique, le risque de décès dans les 24 heures est élevé. Le volume et la nature de l'intervention chirurgicale : 1 point - petites opérations pour: ablation de tumeurs superficielles et localisées, ouverture de petits abcès, amputation des doigts et des orteils, ligature et ablation des hémorroïdes, appendicectomie et herniotomie non compliquées. 2 points - opérations de gravité modérée : ablation de tumeurs malignes superficielles nécessitant une intervention prolongée ; ouverture d'abcès localisés dans des cavités ; amputation et désarticulation des membres supérieurs et inférieurs; opérations sur navires périphériques; appendicectomie et herniotomie compliquées nécessitant une intervention importante ; thoracotomie et laparotomie d'essai; d'autres similaires en termes de complexité et de portée d'intervention. 3 points - interventions chirurgicales étendues : opérations radicales sur les organes abdominaux (sauf celles énumérées ci-dessus) ; opérations radicales sur les organes de la cavité thoracique; les amputations étendues des membres, telles que l'amputation transiliosacrée ; chirurgie cérébrale. 4 points - opérations sur le cœur, les gros vaisseaux et autres interventions complexes réalisées dans des conditions particulières (circulation artificielle, hypothermie, etc.). Les interventions chirurgicales d'urgence sont évaluées, ainsi que celles planifiées, en fonction de l'état physique et du volume de l'opération, mais elles sont incluses dans un groupe distinct ou désignées en plus du chiffre par l'indice "C". Noter Le risque opérationnel et anesthésique est désigné comme suit: le numérateur indique la gravité de l'état initial en points, le dénominateur - le volume de l'opération, également en points. Classification de l'état objectif du patient, développée par l'American Society of Anesthesiologists (ASA). 1. Il n'y a pas de troubles systémiques. 2. Troubles systémiques légers sans altération fonctionnelle. 3. Maladies systémiques modérées et sévères avec dysfonctionnement. 4. Maladie systémique grave qui constitue constamment une menace pour la vie et entraîne une défaillance des fonctions. 5. Etat terminal, risque élevé de décès dans la journée, quelle que soit l'opération. 6. Mort cérébrale, don d'organes pour transplantation. Si l'intervention est réalisée en urgence, l'appréciation de l'état est complétée par la lettre "E". L'évaluation de l'état du patient et la létalité possible de chaque cas sont présentées dans le tableau 7. Tableau 7 Évaluation de l'état du patient et de la mortalité périopératoire
La surveillance (tableau 7) est le contrôle des fonctions et des processus, l'identification de leurs déviations dangereuses afin de prévenir les complications, en particulier lors de l'anesthésie et des soins intensifs. Une surveillance est effectuée pour contrôler : 1) pour les fonctions du patient (électrocardiographie, oxymétrie de pouls, capnographie, etc.) ; 2) actions thérapeutiques (contrôle du bloc neuromusculaire) ; 3) environnement (composition gazeuse du mélange inhalé) ; 4) fonctionnement des moyens techniques (ventilateur, etc.). Le suivi des fonctions par degré de complexité peut être réalisé par : 1) surveillance continue des paramètres ; 2) contrôle avec signalisation lorsqu'un paramètre échoue au-delà des limites établies ; 3) surveillance continue avec notification lorsque le paramètre dépasse les limites établies, et en plus un indice pour la solution ; 4) de même avec la mise en place de mesures de normalisation de la fonction. La pertinence du suivi tient à : 1) la complexité et la durée toujours croissantes des interventions chirurgicales ; 2) une augmentation de la sévérité des troubles fonctionnels chez les patients ; 3) la complication des moyens techniques utilisés en médecine critique. Importance de la surveillance : 1) diagnostic rapide des troubles et prévention des complications graves, y compris les arrêts cardiaques et respiratoires ; 2) des tactiques de soins intensifs plus adéquates et une efficacité élevée du traitement. Indications de surveillance : 1) surveillance minimale - toujours obligatoire pendant l'anesthésie et les soins intensifs ; 2) surveillance approfondie (méthodes non invasives et invasives) en cas de violations importantes des fonctions de l'organisme, en particulier lorsqu'un patient développe une défaillance multiviscérale ; 3) surveillance préventive - au risque de développer une condition critique. Normes de surveillance. En 1978, le Conseil néerlandais de la santé a introduit la première norme de surveillance de la salle d'opération, qui énumérait l'équipement nécessaire pour la surveillance. En 1985, à la suggestion des compagnies d'assurance, la norme de surveillance de Harvard pour l'anesthésiologie a été proposée, qui fournit des paramètres pour la surveillance des patients pendant l'anesthésie pendant la chirurgie et le mode de cette surveillance. Son introduction dans la pratique a réduit le risque de complications anesthésiques et l'a rendue plus sûre pour le patient. En Russie, en 1997, le système MORF a défini des normes pour une surveillance minimale de l'anesthésie, de la réanimation et des soins intensifs (n° 161/DM-2 du 24 février 1997 « Sur les mesures visant à assurer la sécurité des patients pendant l'anesthésie, la réanimation et les soins intensifs). "). Les données sont présentées dans le tableau 8, tableau 9. Tableau 8 anesthésie
Tableau 9 Réanimation et soins intensifs
Pour mener des soins intensifs efficaces, il est nécessaire de surveiller les systèmes cardiovasculaire, respiratoire et nerveux, les fonctions du foie, des reins, du tractus gastro-intestinal, l'hématopoïèse, l'hémostase, ainsi que l'énergie, l'eau-électrolyte, l'acide-base et l'onco-osmotique. solde. La surveillance intensive des interventions thérapeutiques en cours et de leurs résultats est tout aussi importante. Un rôle important est joué par la surveillance de l'état microbiologique externe et interne, ainsi que l'utilisation de critères pronostiques et l'évaluation des résultats. Tout d'abord, il est nécessaire d'utiliser une évaluation clinique de l'état du patient et des méthodes de surveillance non invasives. Le suivi clinique, c'est-à-dire l'observation des signes et symptômes cliniques, les données qualitatives, n'est pas moins important que les indicateurs quantitatifs obtenus à l'aide d'une technologie sophistiquée. Surveillance du fonctionnement du système Surveillance du système circulatoire La surveillance de la circulation permet une détection rapide des arythmies cardiaques et de l'ischémie myocardique grâce à l'utilisation de l'électrocardiographie. Les arythmies cardiaques peuvent être identifiées par l'onde P et le complexe ORS sur l'électrocardiomoniteur dans les dérivations V1 et V2 de la dérivation standard des membres ou leurs modifications. L'ischémie myocardique peut être identifiée par la dépression résultante du segment ST sur l'ECG : 1) dans la dérivation thoracique V5, ainsi que sur l'une de ses modifications - ischémie du septum de la paroi latérale gauche; 2) dérivation standard 2 des extrémités - ischémie de la zone basale du myocarde dans le bassin de l'artère coronaire droite. La dépression du segment ST en pente descendante (élévation) est un indicateur d'ischémie induite par le stress. La surveillance de l'hémodynamique est effectuée par: 1) mesures de la tension artérielle ; 2) Mesures de CVP en combinaison avec des tests d'effort volumétriques (il s'agit d'informations sur le remplissage vasculaire) ; 3) la détermination de la pression artérielle pulmonaire et de la pression de coin (PWP) à l'aide d'un cathéter artériel pulmonaire flottant est une méthode plus précise pour évaluer le volume intravasculaire que la CVP, et peut également servir de mesure de la précharge ventriculaire gauche ; 4) détermination du débit cardiaque par une technique de thermodilution, la méthode de Fick (CO = VCO2 /CaCO2), diverses modifications de la technique Doppler (échocardiographie Doppler oesophagienne), échographie du cœur. Surveillance de la respiration La surveillance respiratoire est effectuée en fonction des symptômes cliniques et des données de la capnographie, de l'oxymétrie de pouls, de la spirométrie volumique et des gaz sanguins périodiques. Pendant la ventilation mécanique, la pression dans le système "ventilateur - patient" et la concentration en oxygène dans le mélange inhalé (FiO2). Signes cliniques d'insuffisance respiratoire : respiration superficielle fréquente (plus de 24-30 par minute chez l'adulte), participation à la respiration de muscles annexes (sterno-cléido-mastoïdien, abdominaux et autres, qui se manifeste par une rétraction des espaces intercostaux, un gonflement des ailes du nez, position semi-assise forcée), transpiration, cyanose, modifications de la fréquence cardiaque (première augmentation, puis il peut y avoir une arythmie) et de la pression artérielle (augmentation et hypoxie sévère - diminution), modification de la conscience de l'euphorie au coma . La capnographie permet de détecter à temps les troubles ventilatoires : hypoventilation (augmentation du CO2 dans l'air expiré final - FetCO2 > 6,4 %), hyperventilation (FetCO2 < 4,9 %), ventilation inégale (angle d'inclinaison du plateau du capnogramme alvéolaire - 5°). Pendant la ventilation mécanique, s'il n'y a pas de capnographe, le volume de ventilation est contrôlé par le volume minute de respiration (Vist.), mesuré à l'aide d'un spiromètre volumétrique, qui est installé dans le trajet expiratoire. De plus, le volume inspiratoire minute (Vappar.) est surveillé, ce qui est nécessaire pour calculer la concentration en oxygène dans le mélange gazeux inhalé et déterminer l'étanchéité de ce système - "ventilateur malade". Le contrôle de l'étanchéité est également réalisé par la pression dans le système "appareil-malade", mesurée au moyen d'un monovacuomètre. L'oxymétrie de pouls permet une détection rapide de l'oxygénation altérée dans les poumons, de l'hypoxémie (SaO2 < 94 %. De plus, en fonction de la nature du pléthysmogramme, on peut juger de l'état de la microcirculation et du débit cardiaque. Une étude supplémentaire des gaz sanguins permet d'évaluer le degré d'échange gazeux altéré dans les poumons (par l'ampleur du gradient alvéolo-artériel de la tension d'oxygène. Certains moniteurs peuvent fournir une évaluation de la biomécanique de la respiration pendant la ventilation mécanique en fonction de la conformité des poumons et de la poitrine (C, normalement 60-100 ml) et la résistance (résistance) des voies respiratoires (R, normalement 2-3 cm). Surveillance des fonctions neurologiques La surveillance des fonctions neurologiques est réalisée en évaluant la conscience sur l'échelle de Glasgow (basée sur la réaction d'ouverture des yeux, les réponses motrices et verbales à un stimulus croissant : 15 points - normal, 3 points - mort cérébrale). De plus, la pression intracrânienne et le débit sanguin cérébral sont déterminés (par exemple, à l'aide d'un moniteur Doppler transcrânien). La fonction rénale est le plus souvent surveillée en mesurant le débit urinaire horaire, qui est normalement > 0,5 ml/kg/h. Conférence numéro 15. Ventilation pulmonaire artificielle La ventilation pulmonaire artificielle (ALV) assure l'échange de gaz entre l'air ambiant (ou un certain mélange de gaz) et les alvéoles des poumons, est utilisée comme moyen de réanimation en cas d'arrêt soudain de la respiration, en tant que composant de l'anesthésie et comme moyen de soins intensifs pour l'insuffisance respiratoire aiguë, ainsi que certaines maladies des systèmes nerveux et musculaire. Les méthodes modernes de ventilation pulmonaire artificielle (ALV) peuvent être divisées en simples et matérielles. Une méthode simple de ventilation mécanique est généralement utilisée dans les situations d'urgence (apnée, avec rythme anormal, respiration agonique, avec augmentation de l'hypoxémie et (ou) de l'hypercapnie, et troubles métaboliques sévères). Les méthodes expiratoires de IVL (respiration artificielle) de bouche à bouche et de bouche à nez sont simples. Des méthodes matérielles sont utilisées si nécessaire pour une ventilation mécanique de longue durée (d'une heure à plusieurs mois voire années). Le respirateur Phase-50 a un grand potentiel. Pour la pratique pédiatrique, l'appareil "Vita-1" est produit. Le respirateur est relié aux voies respiratoires du patient par un tube endotrachéal ou une canule de trachéotomie. La ventilation matérielle est effectuée en mode de fréquence normale, qui varie de 12 à 20 cycles par minute. En pratique, il existe une ventilation mécanique en mode haute fréquence (plus de 1 cycles par 60 min), dans laquelle le volume courant diminue fortement (jusqu'à 1 ml ou moins), la pression positive dans les poumons à la fin de l'inhalation diminue , ainsi que la pression intrathoracique, et le flux sanguin vers le cœur s'améliore. De plus, en mode haute fréquence, l'adaptation du patient au respirateur est facilitée. Il existe trois méthodes de ventilation à haute fréquence : volumétrique, oscillatoire et à jet. Le volume est généralement effectué avec une fréquence respiratoire de 80-100 par 1 min, IVL oscillatoire - 600-3600 par 1 min, ce qui assure la vibration d'un flux de gaz continu ou intermittent. La ventilation à haute fréquence par jet la plus répandue avec une fréquence respiratoire de 100 à 300 par minute, dans laquelle un jet d'oxygène à une pression de 1 à 2 atm est soufflé dans les voies respiratoires à travers une aiguille ou un cathéter d'un diamètre de 2 à 4 mm. La ventilation par jet est réalisée par un tube endotrachéal ou une trachéotomie (en même temps l'air atmosphérique est aspiré dans les voies respiratoires) et par un cathéter qui est inséré dans la trachée par le passage nasal ou par voie percutanée (ponction). Ce dernier est important dans les situations où il n'y a pas de conditions pour l'intubation trachéale. La ventilation pulmonaire artificielle peut être effectuée en mode automatique, mais cela est acceptable dans les cas où la respiration spontanée du patient est complètement absente ou supprimée par des médicaments pharmacologiques (relaxants musculaires). Une ventilation assistée est également réalisée, mais dans ce cas, la respiration indépendante du patient est préservée. Le gaz est fourni après que le patient a fait une faible tentative d'inhalation, ou le patient est synchronisé sur un mode de fonctionnement de l'appareil sélectionné individuellement. Il existe également un mode de ventilation obligatoire intermittente (VPM) qui est appliqué lors de la transition progressive de la ventilation mécanique à la respiration spontanée. Dans ce cas, le patient respire seul, mais en plus, un flux continu du mélange gazeux est fourni aux voies respiratoires. Dans ce contexte, avec une fréquence spécifiée (de 10 à 1 fois par minute), l'appareil effectue une respiration artificielle, coïncidant (PVL synchronisée) ou non coïncidant (PVL non synchronisée) avec l'inspiration indépendante du patient. La réduction progressive des respirations artificielles vous permet de préparer le patient à la respiration spontanée. Les circuits respiratoires sont présentés dans le tableau 10. Tableau 10 Circuits respiratoires
La ventilation manuelle avec un sac ou un masque est facilement disponible et est souvent suffisante pour gonfler adéquatement les poumons. Son succès, en règle générale, est déterminé par la sélection correcte des tailles de masque et l'expérience de l'opérateur, et non par la gravité de la pathologie pulmonaire. Показания 1. Réanimation et préparation du patient dans un court laps de temps pour une intubation ultérieure. 2. Ventilation périodique avec un ballon et un masque afin de prévenir l'atélectasie post-extubation. 3. Restrictions de ventilation avec un sac et un masque. équipement Un sac respiratoire conventionnel et un masque avec un manomètre installé ou un sac respiratoire auto-gonflant avec une chambre à oxygène sont utilisés. Technique 1. Il est nécessaire de placer le masque fermement sur le visage du patient, en donnant à la tête du patient une position médiane avec le menton fixé avec un doigt. Le masque ne doit pas reposer sur les yeux. 2. Fréquence respiratoire - généralement 30-50 par 1 min. 3. Pression inspiratoire - généralement 20 à 30 cm d'eau. Art. 4. Une pression plus élevée (30 à 60 cm de colonne d'eau) est acceptable lors de la réanimation primaire dans l'activité de travail d'une femme. Évaluation de l'efficacité 1. Retour du rythme cardiaque à des valeurs normales et disparition de la cyanose centrale. 2. L'excursion de la poitrine doit être bonne, la respiration s'effectue également bien des deux côtés. 3. L'étude de la composition gazeuse du sang est généralement requise et réalisée lors d'une réanimation prolongée. Complications 1. Pneumothorax. 2. Ballonnements. 3. Syndrome d'hypoventilation ou épisodes d'apnée. 4. Irritation de la peau du visage. 5. Décollement de la rétine (lors de l'application d'un masque sur les yeux et de la création d'un pic de pression élevé à long terme). 6. La ventilation au masque et au sac peut aggraver l'état du patient si celui-ci résiste activement à la procédure. Matériel IVL Показания 1. Apnée. 2. Coma dans la période aiguë, même sans signes d'insuffisance respiratoire. 3. Crises non maîtrisées par un traitement anticonvulsivant standard. 4. Choc de toute étiologie. 5. Augmentation de la dynamique du syndrome de dépression du SNC dans le syndrome d'hyperventilation. 6. Avec une blessure à la colonne vertébrale à la naissance chez les nouveau-nés - l'apparition d'une respiration forcée et d'une respiration sifflante généralisée crépitante sur fond d'essoufflement. 7. RO2 sang capillaire inférieur à 50 mm Hg. Art. pendant la respiration spontanée avec un mélange avec FiO2 0,6 ou plus. 8. RSO2 sang capillaire supérieur à 60 mm Hg. Art. ou moins de 35 mm Hg. Art. avec respiration spontanée. Equipement : "PHASE-5", "BP-2001", "Infant-Star 100 ou 200", "Sechrist 100 ou 200", "Babylog 1", "Stephan", etc. Principes de traitement 1. L'oxygénation dans les poumons raides peut être obtenue en augmentant la concentration d'oxygène inspiré, en augmentant la pression inspiratoire, en augmentant la PEP, en prolongeant le temps inspiratoire, en augmentant la pression de plateau. 2. Ventilation (élimination du CO2) peut être améliorée par une augmentation du volume courant, une augmentation de la fréquence et une prolongation du temps expiratoire. 3. La sélection des paramètres de ventilation (fréquence, pression inspiratoire, plateau inspiratoire, rapport inspiratoire-expiratoire, PEP) variera en fonction de la nature de la maladie sous-jacente et de la réponse du patient au traitement. Objectifs de l'IVL 1. Oxygène : atteindre pO2 50-100 mmHg Art. 2. Maintenez pCO2 dans les 35-45 mm Hg. Art. 3. Exceptions : dans certaines situations, les indicateurs de pO2 et pCO2 peut différer de ce qui précède : 1) en pathologie pulmonaire chronique, valeurs de pCO plus élevées2 portable; 2) avec des malformations cardiaques graves, des nombres de pO plus petits sont tolérés2; 3) selon l'approche thérapeutique en cas d'hypertension pulmonaire, des valeurs de pCO plus ou moins importantes sont tolérées2. 4. Les indications et les paramètres de ventilation doivent toujours être documentés. Technique 1. Paramètres initiaux d'IVL : pression inspiratoire 20-24 cm d'eau. Art.; PEER de 4-6 cm d'eau. Art.; fréquence respiratoire 16-24 par 1 min, temps d'inhalation 0,4-0,6 s, DO de 6 à 10 l/min, MOV (volume de ventilation minute) 450-600 ml/min. 2. Synchronisation avec un respirateur. En règle générale, les patients sont synchrones avec le respirateur. Mais l'excitation peut altérer la synchronisation, dans de tels cas, un traitement médicamenteux (morphine, promédol, oxybutyrate de sodium, relaxants musculaires) peut être nécessaire. Examen 1. Les analyses répétées des gaz du sang constituent un élément important de l'enquête. 2. Examen physique. Contrôle de l'adéquation de l'IVL. Lors de la ventilation d'urgence, une méthode simple suffit pour observer la couleur de la peau et les mouvements de la poitrine du patient. La paroi thoracique doit se dilater à chaque inspiration et tomber à chaque expiration, mais si la région épigastrique monte, l'air soufflé pénètre dans l'œsophage et l'estomac. La raison en est souvent la mauvaise position de la tête du patient. Lors de la conduite d'une ventilation mécanique à long terme, il est nécessaire de juger de son adéquation. Si la respiration spontanée du patient n'est pas supprimée par des préparations pharmacologiques, l'un des principaux signes de l'adéquation de l'IVL réalisée est la bonne adaptation du patient au respirateur. En présence d'une conscience claire, le patient ne doit pas ressentir de sensation de manque d'air, d'inconfort. Les bruits respiratoires dans les poumons doivent être les mêmes des deux côtés et la peau doit avoir une couleur normale. Complications 1. Les complications les plus courantes de la ventilation mécanique sont : la rupture des alvéoles avec développement d'emphysème interstitiel, de pneumothorax et de pneumomédiastinite. 2. D'autres complications peuvent être : contamination bactérienne et infection, obturation de la sonde endotrachéale ou extubation, intubation unipulmonaire, pneumopéricardite avec tamponnade cardiaque, diminution du retour veineux et diminution du débit cardiaque, chronicité du processus dans les poumons, sténose et obstruction des la trachée. Dans le contexte de la ventilation mécanique, il est possible d'utiliser un certain nombre d'analgésiques, qui devraient fournir un niveau et une profondeur d'anesthésie suffisants à des doses qui, dans des conditions de respiration spontanée, s'accompagneraient d'hypoxémie. En maintenant un bon apport d'oxygène dans le sang, la ventilation mécanique contribue au fait que le corps fait face à la blessure chirurgicale. Dans de nombreuses opérations sur les organes de la poitrine (poumons, œsophage), une intubation bronchique séparée est utilisée, ce qui permet de désactiver la ventilation d'un poumon lors d'interventions chirurgicales afin de faciliter le travail du chirurgien. Cette intubation empêche également le contenu du poumon opéré de fuir dans le poumon sain. Lors des opérations sur le larynx et les voies respiratoires, une ventilation haute fréquence par jet transcathéter est utilisée, ce qui facilite l'examen du champ opératoire et permet de maintenir un échange gazeux adéquat avec la trachée et les bronches ouvertes. Dans des conditions d'anesthésie générale et de relaxation musculaire, le patient n'est pas en mesure de répondre à l'hypoxie et à l'hypoventilation qui en résultent. Il est donc important de contrôler la teneur en gaz sanguins (surveillance continue de la pression partielle d'oxygène et de la pression partielle de dioxyde de carbone) par voie percutanée. à l'aide de capteurs spéciaux. En cas de décès clinique ou d'agonie, la ventilation mécanique est une composante obligatoire de la réanimation. Il est possible d'arrêter la ventilation mécanique uniquement après que la conscience est complètement restaurée et que la respiration spontanée est terminée. Dans le complexe de soins intensifs, la ventilation mécanique est la méthode la plus efficace pour traiter l'insuffisance respiratoire aiguë. Elle est réalisée à travers un tube qui est inséré dans la trachée par le passage nasal inférieur ou la trachéotomie. Une importance particulière est le soin des voies respiratoires, leur drainage adéquat. La ventilation mécanique auxiliaire est utilisée en séances de 30 à 40 minutes pour traiter les patients souffrant d'insuffisance respiratoire chronique. IVL est utilisé chez les patients qui sont dans le coma (traumatisme, chirurgie cérébrale), ainsi qu'avec des lésions périphériques des muscles respiratoires (polyradiculonévrite, lésion de la moelle épinière, sclérose latérale amyotrophique). L'ALV est également largement utilisé dans le traitement des patients souffrant de traumatismes thoraciques, d'empoisonnements divers, d'accidents vasculaires cérébraux, de tétanos et de botulisme. Conférence n ° 16. Thérapie par perfusion La thérapie par perfusion est une injection goutte à goutte ou une infusion par voie intraveineuse ou sous la peau de médicaments et de liquides biologiques afin de normaliser l'équilibre eau-électrolyte, acido-basique du corps, ainsi que pour la diurèse forcée (en association avec des diurétiques). Indications de la thérapie par perfusion : tous types de choc, perte de sang, hypovolémie, perte de liquide, d'électrolytes et de protéines à la suite de vomissements indomptables, diarrhée intense, refus de boire, brûlures, maladie rénale ; violations de la teneur en ions basiques (sodium, potassium, chlore, etc.), acidose, alcalose et empoisonnement. Les principaux signes de déshydratation du corps: rétraction des globes oculaires dans les orbites, cornée terne, peau sèche et inélastique, palpitations caractéristiques, oligurie, l'urine devient concentrée et jaune foncé, l'état général est déprimé. Les contre-indications au traitement par perfusion sont l'insuffisance cardiovasculaire aiguë, l'œdème pulmonaire et l'anurie. Les solutions cristalloïdes sont capables de compenser la carence en eau et en électrolytes. Appliquer une solution de chlorure de sodium à 0,85 %, des solutions Ringer et Ringer-Locke, une solution de chlorure de sodium à 5 %, des solutions de glucose à 5-40 % et d'autres solutions. Ils sont administrés par voie intraveineuse et sous-cutanée, par jet (avec déshydratation sévère) et goutte à goutte, dans un volume de 10 à 50 ml/kg ou plus. Ces solutions n'entraînent pas de complications, sauf en cas de surdosage. Les objectifs de la thérapie par perfusion sont : la restauration du BCC, l'élimination de l'hypovolémie, la garantie d'un débit cardiaque adéquat, le maintien et la restauration d'une osmolarité plasmatique normale, la garantie d'une microcirculation adéquate, la prévention de l'agrégation des cellules sanguines, la normalisation de la fonction de transport de l'oxygène du sang. Les solutions colloïdales sont des solutions de substances macromoléculaires. Ils contribuent à la rétention de liquide dans le lit vasculaire. Hemodez, polyglucine, reopoliglyukin, reogluman sont utilisés. Avec leur introduction, des complications sont possibles, qui se manifestent sous la forme d'une réaction allergique ou pyrogène. Voies d'administration - par voie intraveineuse, moins souvent sous-cutanée et goutte à goutte. La dose quotidienne ne dépasse pas 30-40 ml/kg. Ils ont une qualité détoxifiante. En tant que source de nutrition parentérale, ils sont utilisés en cas de refus prolongé de manger ou d'incapacité à se nourrir par la bouche. Des hydrolysines de sang et de caséine sont utilisées (alvezin-neo, polyamine, lipofundine, etc.). Ils contiennent des acides aminés, des lipides et du glucose. Parfois, il y a une réaction allergique à l'introduction. Débit et volume de perfusion. Toutes les perfusions en termes de débit de perfusion volumétrique peuvent être divisées en deux catégories : nécessitant et ne nécessitant pas une correction rapide du déficit en CBC. Le principal problème peut être les patients qui ont besoin d'une élimination rapide de l'hypovolémie. c'est-à-dire que le débit de perfusion et son volume doivent assurer la performance du cœur afin de fournir correctement la perfusion régionale des organes et des tissus sans centralisation significative de la circulation sanguine. Chez les patients avec un cœur initialement sain, trois repères cliniques sont les plus informatifs : TA moyenne > 60 mm Hg. Art.; pression veineuse centrale - CVP> 2 cm d'eau. Art.; diurèse 50 ml/h. Dans les cas douteux, un test est effectué avec une charge en volume: 15-20 ml d'une solution cristalloïde sont versés en 400-500 minutes et la dynamique de la CVP et de la diurèse est observée. Une augmentation significative de la CVP sans augmentation de la diurèse peut indiquer une insuffisance cardiaque, ce qui suggère la nécessité de méthodes plus complexes et informatives pour évaluer l'hémodynamique. Maintenir les deux lectures basses suggère une hypovolémie, puis maintenir un débit de perfusion élevé avec une évaluation répétée étape par étape. Une augmentation de la diurèse indique une oligurie prérénale (hypoperfusion des reins d'origine hypovolémique). La thérapie par perfusion chez les patients insuffisants circulatoires nécessite une connaissance claire de l'hémodynamique, une surveillance importante et particulière. Les dextranes sont des substituts colloïdaux du plasma, ce qui les rend très efficaces pour la récupération rapide du BCC. Les dextranes ont des propriétés protectrices spécifiques contre les maladies ischémiques et la reperfusion, dont le risque est toujours présent lors d'interventions chirurgicales majeures. Les aspects négatifs des dextranes comprennent le risque de saignement dû à la désagrégation plaquettaire (particulièrement caractéristique de la rhéopolyglucine), lorsqu'il devient nécessaire d'utiliser des doses importantes du médicament (> 20 ml / kg), et une modification temporaire des propriétés antigéniques du du sang. Les dextranes sont dangereux en raison de leur capacité à provoquer une "brûlure" de l'épithélium des tubules des reins et sont donc contre-indiqués en cas d'ischémie rénale et d'insuffisance rénale. Ils provoquent souvent des réactions anaphylactiques, qui peuvent être assez graves. Une solution d'albumine humaine est particulièrement intéressante, car il s'agit d'un colloïde naturel d'un substitut du plasma. Dans de nombreuses conditions critiques accompagnées de lésions de l'endothélium (principalement dans tous les types de maladies inflammatoires systémiques), l'albumine est capable de passer dans l'espace intercellulaire du lit extravasculaire, attirant l'eau et aggravant l'œdème des tissus interstitiels, principalement les poumons. Le plasma frais congelé est un produit prélevé sur un seul donneur. Le PFC est séparé du sang total et congelé immédiatement dans les 6 heures suivant le prélèvement sanguin. Stocké à 30°C dans des sachets plastiques pendant 1 an. Compte tenu de la labilité des facteurs de coagulation, le FFP doit être perfusé dans les 2 premières heures après une décongélation rapide à 37°C. La transfusion de plasma frais congelé (FFP) présente un risque élevé de contracter des infections dangereuses, telles que le VIH, l'hépatite B et C, etc. La fréquence des réactions anaphylactiques et pyrogènes lors de la transfusion de FFP est très élevée, donc la compatibilité selon le système ABO doit être pris en compte. Et pour les jeunes femmes, la compatibilité Rh doit être prise en compte. Actuellement, la seule indication absolue de l'utilisation du FFP est la prévention et le traitement des saignements coagulopathiques. Le FFP remplit deux fonctions importantes à la fois - hémostatique et maintien de la pression oncotique. Le FFP est également transfusé avec une hypocoagulation, avec une surdose d'anticoagulants indirects, avec une plasmaphérèse thérapeutique, avec une CIVD aiguë et avec des maladies héréditaires associées à un déficit en facteurs de coagulation sanguine. Les indicateurs d'un traitement adéquat sont une conscience claire du patient, une peau chaude, une hémodynamique stable, l'absence de tachycardie sévère et d'essoufflement, une diurèse suffisante - dans les 30 à 40 ml/h. 1. Transfusion sanguine Complications de la transfusion sanguine: troubles post-transfusionnels du système de coagulation sanguine, réactions pyrogènes sévères avec présence de syndrome hyperthermique et décompensation cardiovasculaire, réactions anaphylactiques, hémolyse érythrocytaire, insuffisance rénale aiguë, etc. La base de la plupart des complications est la réaction de rejet par le corps d'un tissu étranger. Il n'y a pas d'indications pour la transfusion de sang total en conserve, car le risque de réactions et de complications post-transfusionnelles est important, mais le plus dangereux est le risque élevé d'infection du receveur. En cas de perte de sang aiguë lors d'une intervention chirurgicale et d'une reconstitution adéquate du déficit en BCC, même une forte diminution de l'hémoglobine et de l'hématocrite ne menace pas la vie du patient, car la consommation d'oxygène sous anesthésie est considérablement réduite, une oxygénation supplémentaire est acceptable, l'hémodilution aide prévenir l'apparition de microthrombose et la mobilisation des érythrocytes du dépôt, augmenter la vitesse du flux sanguin, etc. Les "réserves" d'érythrocytes qu'une personne possède par nature dépassent considérablement les besoins réels, en particulier dans un état de repos, dans lequel le patient est en ce moment. Recommandations pour la nomination de la transfusion de sang de donneur et d'érythrocytes pendant la chirurgie. 1. La transfusion de masse érythrocytaire est réalisée après la restauration du BCC. 2. En présence d'une pathologie concomitante sévère, pouvant entraîner la mort (par exemple, une anémie sévère est mal tolérée dans les maladies coronariennes sévères). 3. En présence des indicateurs suivants du sang rouge du patient: 70-80 g / l pour l'hémoglobine et 25% pour l'hématocrite, et le nombre de globules rouges est de 2,5 millions. Les indications de la transfusion sanguine sont : les saignements et la correction de l'hémostase. Types d'érythrocytes : sang total, masse érythrocytaire, EMOLT (masse érythrocytaire séparée des leucocytes, plaquettes avec solution saline). Le sang est administré par voie intraveineuse au goutte-à-goutte, en utilisant un système jetable à un débit de 60-100 gouttes par minute, dans un volume de 30-50 ml/kg. Avant la transfusion sanguine, il est nécessaire de déterminer le groupe sanguin et le facteur Rh du receveur et du donneur, d'effectuer un test de compatibilité et un test biologique de compatibilité est effectué au chevet du patient. Lorsqu'une réaction anaphylactique se produit, la transfusion est arrêtée et les mesures visant à éliminer le choc commencent. Le concentré plaquettaire standard est une suspension de plaquettes centrifugées deux fois. Le nombre minimum de plaquettes est de 0,5 x 1012 par litre, les leucocytes de 0,2 x 109 par litre. Les caractéristiques hémostatiques et la survie sont les plus prononcées au cours des 12 à 24 prochaines heures de préparation, mais le médicament peut être utilisé dans les 3 à 5 jours suivant le moment du prélèvement sanguin. Le concentré plaquettaire est utilisé pour la thrombocytopénie (leucémie, aplasie médullaire), la thrombopathie avec syndrome hémorragique. 2. Nutrition parentérale Dans les maladies graves accompagnées de graves perturbations de l'homéostasie, il est nécessaire de fournir au corps de l'énergie et de la matière plastique. Par conséquent, lorsque la nutrition par la bouche est altérée ou totalement impossible pour une raison quelconque, il est nécessaire de transférer le patient vers une nutrition parentérale. Dans des conditions critiques d'étiologies diverses, les changements les plus significatifs se produisent dans le métabolisme des protéines - une protéolyse intensive est observée, en particulier dans les muscles striés. Selon la gravité du processus en cours, les protéines corporelles sont catabolisées à raison de 75 à 150 g par jour (les pertes quotidiennes de protéines sont indiquées dans le tableau 11). Cela conduit à une carence en acides aminés essentiels, qui sont utilisés comme source d'énergie lors de la gluconéogenèse, entraînant un bilan azoté négatif. Tableau 11 Perte quotidienne de protéines dans des conditions critiques
La perte d'azote entraîne une diminution du poids corporel, puisque: 1 g d'azote \u6,25d 25 g de protéines (acides aminés) \uXNUMXd XNUMX g de tissu musculaire. Dans la journée suivant le début d'un état critique, sans traitement adéquat avec l'introduction d'une quantité suffisante de nutriments essentiels, ses propres réserves de glucides sont épuisées et le corps reçoit de l'énergie des protéines et des graisses. À cet égard, des modifications non seulement quantitatives, mais également qualitatives des processus métaboliques sont effectuées. Les principales indications de la nutrition parentérale sont : 1) anomalies du développement du tractus gastro-intestinal (atrésie de l'œsophage, sténose du pylore et autres, période pré- et postopératoire); 2) brûlures et blessures de la cavité buccale et du pharynx; 3) brûlures corporelles étendues; 4) péritonite ; 5) iléus paralytique ; 6) fistules intestinales hautes ; 7) vomissements indomptables ; 8) coma ; 9) maladies graves accompagnées d'une augmentation des processus cataboliques et de troubles métaboliques décompensés (septicémie, formes sévères de pneumonie) ; 10) atrophie et dystrophie ; 11) anorexie due à des névroses. La nutrition parentérale doit être réalisée dans des conditions de compensation des troubles volémiques, hydro-électrolytiques, d'élimination des troubles de la microcirculation, d'hypoxémie, d'acidose métabolique. Le principe de base de la nutrition parentérale est de fournir à l'organisme une quantité adéquate d'énergie et de protéines. Aux fins de la nutrition parentérale, les solutions suivantes sont utilisées. Glucides : Le médicament le plus acceptable utilisé à tout âge est le glucose. Le ratio de glucides dans l'alimentation quotidienne doit être d'au moins 50 à 60%. Pour une utilisation complète, il est nécessaire de maintenir le taux d'administration, le glucose doit être fourni avec des ingrédients - insuline 1 unité pour 4 g, potassium, coenzymes impliquées dans l'utilisation de l'énergie : phosphate de pyridoxal, cocarboxylase, acide lipoïque et ATP - 0,5-1 mg / kg par jour par voie intraveineuse. Lorsqu'il est correctement administré, le glucose hautement concentré ne provoque pas de diurèse osmotique et une augmentation significative de la glycémie. Pour la nutrition azotée, on utilise soit des hydrolysats de protéines de haute qualité (aminosol, aminone) soit des solutions d'acides aminés cristallins. Ces médicaments combinent avec succès des acides aminés essentiels et non essentiels, ils sont peu toxiques et provoquent rarement une réaction allergique. Les doses de préparations de protéines administrées dépendent du degré de violation du métabolisme des protéines. Dans les troubles compensés, la dose de protéines administrée est de 1 g/kg de poids corporel par jour. La décompensation du métabolisme des protéines, se manifestant par une hypoprotéinémie, une diminution du rapport albumine-globuline, une augmentation de l'urée dans les urines quotidiennes, nécessite l'introduction de doses accrues de protéines (3-4 g/kg par jour) et d'un traitement anti-catabolique. Cela comprend les hormones anabolisantes (retabolil, nerabolil - 25 mg par voie intramusculaire 1 fois en 5-7 jours), la construction d'un programme de nutrition parentérale en mode hyperalimentation (140-150 kcal / kg de poids corporel par jour), les inhibiteurs de protéase (kontrykal, trasylol 1000 U/kg par jour pendant 5-7 jours). Pour une assimilation adéquate de la matière plastique, chaque gramme d'azote introduit doit être fourni avec 200-220 kcal. Les solutions d'acides aminés ne doivent pas être administrées avec des solutions concentrées de glucose, car elles forment des mélanges toxiques. Contre-indications relatives à l'introduction d'acides aminés : insuffisance rénale et hépatique, choc et hypoxie. Les émulsions grasses contenant des acides gras polyinsaturés sont utilisées pour corriger le métabolisme des graisses et augmenter le contenu calorique de la nutrition parentérale. La graisse est le produit le plus calorique, cependant, pour son utilisation, il est nécessaire de maintenir des doses et un rythme d'administration optimaux. Les émulsions grasses ne doivent pas être administrées avec des solutions concentrées de glucose polyionique, ni avant ni après celles-ci. Contre-indications à l'introduction d'émulsions grasses : insuffisance hépatique, lipémie, hypoxémie, états de choc, syndrome thrombohémorragique, troubles de la microcirculation, œdème cérébral, diathèse hémorragique. Les données requises pour les principaux ingrédients de la nutrition parentérale sont présentées dans les tableaux 12 et 13. Tableau 12 Doses, taux, teneur calorique des principaux ingrédients pour la nutrition parentérale
Lors de la prescription d'une nutrition parentérale, il est nécessaire d'introduire des doses optimales de vitamines impliquées dans de nombreux processus métaboliques, étant des coenzymes dans les réactions d'utilisation de l'énergie. Tableau 13 Doses de vitamines (en mg pour 100 kcal) nécessaires lors de la nutrition parentérale
Le programme de nutrition parentérale, réalisé dans n'importe quel mode, doit être établi en termes d'un rapport équilibré d'ingrédients. Le rapport optimal entre protéines, lipides et glucides est de 1 : 1,8 : 5,6. Pour la décomposition et l'inclusion des protéines, des graisses et des glucides dans le processus de synthèse, une certaine quantité d'eau est nécessaire. Le rapport entre le besoin en eau et la teneur en calories des aliments est de 1 ml H2O - 1 kcal (1 : 1). Calcul du besoin de consommation énergétique au repos (ERP) selon Harris-Benedict : Hommes - EZP = 66,5 + 13,7 x poids, kg + 5 x taille, cm - 6,8 x âge (années). Femmes - EZP = 66,5 + 9,6 x poids, kg + 1,8 x taille, cm - 4,7 x âge (années). La valeur EZP, déterminée par la formule de Harris-Benedict, est en moyenne de 25 kcal/kg par jour. Après le calcul, le facteur d'activité physique (PFA) du patient, le facteur d'activité métabolique (FMA) basé sur l'état clinique et le facteur de température (TF) sont sélectionnés, à l'aide desquels le besoin énergétique (E) d'un patient sera déterminé. Les coefficients de calcul de FFA, FMA et TF sont présentés dans le tableau 14. Tableau 14 Coefficient de calcul de FFA, FMA et TF
Pour déterminer le PE quotidien, la valeur EZP est multipliée par FFA, FMA et TF. 3. Thérapie de désintoxication En cas d'intoxication grave, une thérapie de désintoxication active est nécessaire, visant à lier et à éliminer les toxines du corps. A cet effet, on utilise le plus souvent des solutions de polyvinylpyrrolidone (néocompensan, gemodez) et de gélatinol, adsorbant et neutralisant les toxines, qui sont ensuite excrétées par les reins. Ces solutions sont administrées goutte à goutte en une quantité de 5 à 10 ml/kg de poids du patient, en y ajoutant de la vitamine C et une solution de chlorure de potassium en une quantité minimale de 1 mmol/kg de poids corporel. Le mafusol, qui est un antihypoxant et un antioxydant efficace, possède également une propriété détoxifiante prononcée. De plus, il améliore la microcirculation et les propriétés rhéologiques du sang, ce qui contribue également à l'effet détoxifiant. Avec divers empoisonnements, l'une des méthodes de désintoxication les plus efficaces est la diurèse forcée. Des fluides intraveineux à des fins de diurèse forcée sont prescrits pour les degrés d'empoisonnement graves et pour les plus légers, lorsque le patient refuse de boire. Les contre-indications à la diurèse forcée sont : l'insuffisance cardiovasculaire aiguë et l'insuffisance rénale aiguë (anurie). La réalisation d'une diurèse forcée nécessite une comptabilité stricte du volume et de la composition quantitative du liquide injecté, la nomination en temps opportun de diurétiques, un contrôle clinique et biochimique clair. Comme solution principale pour la charge en eau, il est proposé : glucose 14,5 g ; chlorure de sodium 1,2 g; bicarbonate de sodium 2,0 g; chlorure de potassium 2,2 g; eau distillée jusqu'à 1000 ml. Cette solution est isotonique, contient la quantité requise de bicarbonate de sodium, la concentration de potassium qu'elle contient ne dépasse pas celle autorisée et le rapport de la concentration osmotique de glucose et de sels est de 2: 1. Au stade initial de la diurèse forcée, il est également conseillé d'introduire des solutions de substitution du plasma et d'éventuelles solutions de détoxification : albumine 8-10 ml/kg, gemodez ou neocompensan 15-20 ml/kg, mafusol 8-10 ml/kg, refortan ou infucol 6-8 ml/kg kg, reopoliglyukin 15-20 ml/kg. La quantité totale de solutions injectées doit dépasser d'environ 1,5 fois les besoins quotidiens. Auteur : Kolesnikova M.A.
▪ Criminalistique. Lit de bébé ▪ Finance, circulation monétaire et crédit. Lit de bébé
L'existence d'une règle d'entropie pour l'intrication quantique a été prouvée
09.05.2024 Mini climatiseur Sony Reon Pocket 5
09.05.2024 L'énergie de l'espace pour Starship
08.05.2024
▪ Le verdissement des villes protégera du réchauffement climatique ▪ La direction dans laquelle tombe l'antimatière ▪ Les avantages et les inconvénients des jeux vidéo ▪ Les enfants prolongent votre vie
▪ section du site Préamplificateurs. Sélection d'articles ▪ Article Moteur électrique. Histoire de l'invention et de la production ▪ article À quelle vitesse le sang coule-t-il en nous ? Réponse détaillée ▪ article Trottinette à pédales. Transport personnel ▪ Article Huile artificielle. Recettes et astuces simples ▪ article Papiros vu des airs. Concentration secrète
Page principale | bibliothèque | Articles | Plan du site | Avis sur le site www.diagramme.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

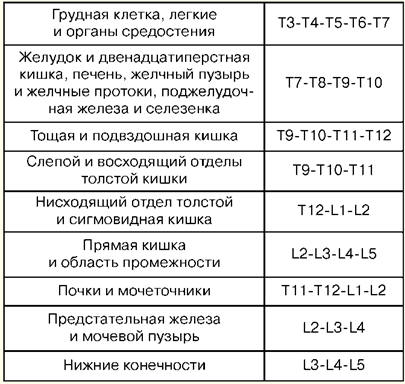











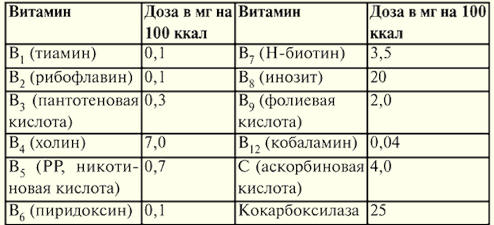

 Voir d'autres articles section
Voir d'autres articles section 